2.1: Evolution av atomteori
atomteori efter artonhundratalet
om materia bestod av atomer, vad var atomer sammansatta av? Var de de minsta partiklarna, eller var det något mindre? I slutet av 1800-talet undersökte ett antal forskare som var intresserade av frågor som dessa de elektriska urladdningarna som kunde produceras i lågtrycksgaser, med den viktigaste upptäckten som gjordes av den engelska fysikern JJ Thomson med hjälp av ett katodstrålerör. Denna apparat bestod av ett förseglat glasrör från vilket nästan all luft hade tagits bort; röret innehöll två metallelektroder. När högspänning applicerades över elektroderna uppträdde en synlig stråle som kallades en katodstråle mellan dem. Denna stråle avböjdes mot den positiva laddningen och bort från den negativa laddningen och producerades på samma sätt med identiska egenskaper när olika metaller användes för elektroderna. I liknande experiment avböjdes strålen samtidigt av ett applicerat magnetfält, och mätningar av omfattningen av avböjning och magnetfältstyrkan gjorde det möjligt för Thomson att beräkna laddningsförhållandet mellan katodstrålepartiklarna. Resultaten av dessa mätningar indikerade att dessa partiklar var mycket lättare än atomer (figur \(\PageIndex{1}\)).
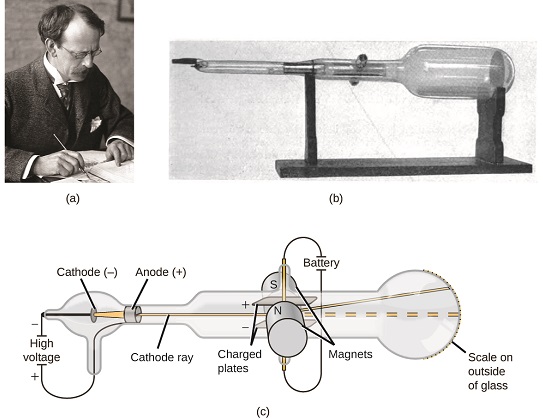
figur \(\PageIndex{5}\): (A) JJ Thomson producerade en synlig stråle i ett katodstrålerör. (b) Detta är ett tidigt katodstrålerör, uppfunnet 1897 av Ferdinand Braun. (c) i katodstrålen kommer strålen (visas i gult) från katoden och accelereras förbi anoden mot en fluorescerande skala i rörets ände. Samtidiga avböjningar av applicerade elektriska och magnetiska fält gjorde det möjligt för Thomson att beräkna mass-till-laddningsförhållandet för partiklarna som komponerar katodstrålen. (kredit a: modifiering av arbete av Nobelstiftelsen; kredit b: modifiering av arbete av Eugen Nesper; kredit c: modifiering av arbete av ”Kurzon”/Wikimedia Commons).
baserat på hans observationer, här är vad Thomson föreslog och varför: partiklarna lockas av positiva (+) laddningar och avvisas av negativa (−) laddningar, så de måste vara negativt laddade (som laddningar avvisar och till skillnad från laddningar lockar); de är mindre massiva än atomer och oskiljbara, oavsett källmaterialet, så de måste vara grundläggande, subatomära beståndsdelar i alla atomer. Även om det var kontroversiellt vid den tiden accepterades Thomsons ide gradvis, och hans katodstrålepartikel är vad vi nu kallar en elektron, en negativt laddad, subatomär partikel med en massa mer än tusen gånger mindre än en atom. Termen ” elektron ”myntades 1891 av irländsk fysiker George Stoney, från” electric ion.”
1909 upptäcktes mer information om elektronen av den amerikanska fysikern Robert A. Millikan via hans” oljedropp ” – experiment. Millikan skapade mikroskopiska oljedroppar, som kunde laddas elektriskt genom friktion när de bildades eller genom att använda röntgenstrålar. Dessa droppar föll ursprungligen på grund av tyngdkraften, men deras nedåtgående framsteg kunde bromsas eller till och med vändas av ett elektriskt fält lägre i apparaten. Genom att justera den elektriska fältstyrkan och göra noggranna mätningar och lämpliga beräkningar kunde Millikan bestämma laddningen på enskilda droppar (figur \(\PageIndex{2}\)).
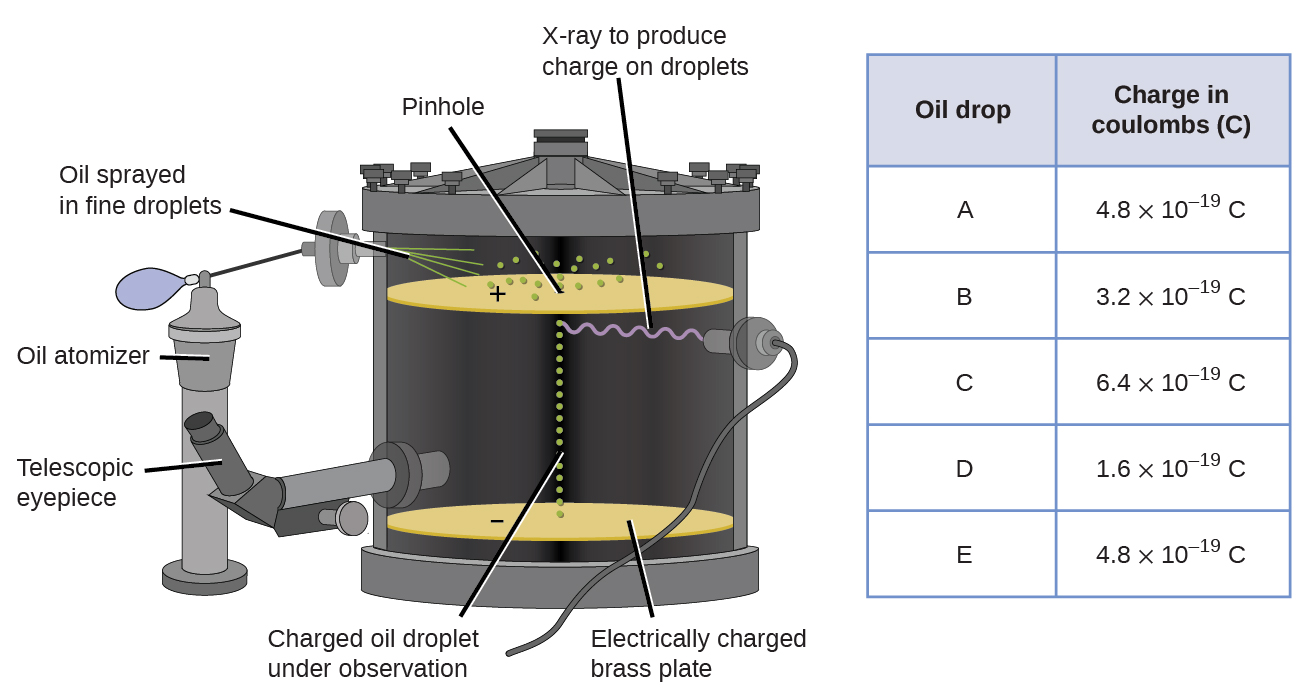
figur \(\PageIndex{6}\): Millikans experiment mätte laddningen av enskilda oljedroppar. Tabelldata är exempel på några möjliga värden.
om du tittar på laddningsdata som Millikan samlade kan du ha insett att laddningen av en oljedropp alltid är en multipel av en specifik laddning, 1.6 \(\times\) 10-19 C. Millikan drog slutsatsen att detta värde därför måste vara en grundläggande laddning—laddningen av en enda elektron—med sina uppmätta laddningar på grund av ett överskott av en elektron (1 gånger 1.6 \(\gånger\) 10-19 C), två elektroner (2 gånger 1.6 \(\gånger\) 10-19 C), tre elektroner (3 gånger 1.6 \(\gånger\) 10-19 C), och så vidare, på en given oljedropp. Eftersom laddningen av en elektron nu var känd på grund av Millikans forskning, och laddningsförhållandet redan var känt på grund av Thomsons forskning (1.759 \(\times\) 1011 C/kg), krävde det bara en enkel beräkning för att bestämma elektronens massa också.
\
forskare hade nu fastställt att atomen inte var odelbar som Dalton trodde, och på grund av Thomsons, Millikan och andra arbete var laddningen och massan av de negativa, subatomära partiklarna—elektronerna—kända. Den positivt laddade delen av en atom var emellertid ännu inte väl förstådd. 1904 föreslog Thomson” plumpudding ” – modellen av atomer, som beskrev en positivt laddad massa med lika stor negativ laddning i form av elektroner inbäddade i den, eftersom alla atomer är elektriskt neutrala. En konkurrerande modell hade föreslagits 1903 av Hantaro Nagaoka, som postulerade en Saturn-liknande atom, bestående av en positivt laddad sfär omgiven av en elektronhalo (figur \(\PageIndex{3}\)).
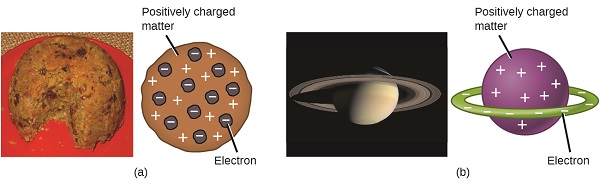
figur \(\PageIndex{7}\): (A) Thomson föreslog att atomer liknade plommonpudding, en engelsk efterrätt bestående av fuktig tårta med inbäddade russin (”plommon”). (B) Nagaoka föreslog att atomer liknade planeten Saturnus, med en ring av elektroner som omger en positiv ”planet.”(kredit a: modifiering av arbete av ”Man vyi”/Wikimedia Commons; kredit b: modifiering av arbete av ”NASA”/Wikimedia Commons).
nästa stora utveckling för att förstå atomen kom från Ernest Rutherford, en fysiker från Nya Zeeland som till stor del tillbringade sin vetenskapliga karriär i Kanada och England. Han utförde en serie experiment med hjälp av en stråle av höghastighets, positivt laddade alfapartiklar (partikel i ax) som producerades genom radioaktivt sönderfall av radium; partiklar i ax består av två protoner och två neutroner (du kommer att lära dig mer om radioaktivt sönderfall i kapitlet om kärnkemi). Rutherford och hans kollegor Hans Geiger (senare känd för Geiger-räknaren) och Ernest Marsden riktade en stråle av megapixelpartiklar, vars källa var inbäddad i ett blyblock för att absorbera det mesta av strålningen, mot en mycket tunn bit guldfolie och undersökte den resulterande spridningen av hawaiipartiklarna med hjälp av en luminescerande skärm som glödde kort där den drabbades av en hawaiipartikel.
vad upptäckte de? De flesta partiklar passerade rakt igenom folien utan att avböjas alls. Vissa avleddes dock något, och ett mycket litet antal avböjdes nästan rakt tillbaka mot källan (figur \(\PageIndex{4}\)). Rutherford beskrev att hitta dessa resultat: ”det var den mest otroliga händelsen som någonsin har hänt mig i mitt liv. Det var nästan lika otroligt som om du avfyrade ett 15-tums skal på en bit mjukpapper och det kom tillbaka och slog dig”1 (s. 68).
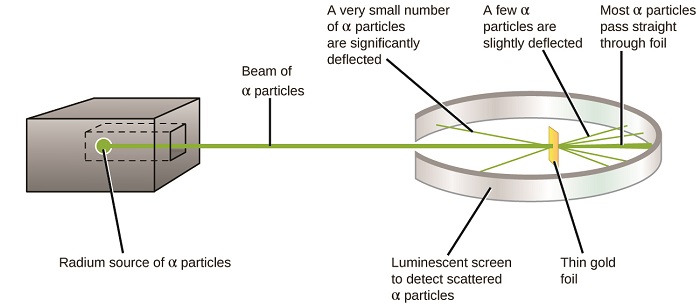
Figure \(\PageIndex{8}\): Geiger och Rutherford avfyrade partiklar från en bit av guldfolie och upptäckte vart dessa partiklar gick, vilket visas i detta schematiska diagram över deras experiment. De flesta partiklarna passerade rakt genom folien, men några avböjdes något och ett mycket litet antal avböjdes signifikant.
det här är vad Rutherford härledde: eftersom de flesta av de snabbrörliga partiklarna i Taiwan passerade genom guldatomerna obefläckade, måste de ha rest genom väsentligen tomt utrymme inuti atomen. Alfapartiklar är positivt laddade, så avböjningar uppstod när de stötte på en annan positiv laddning (som laddningar avvisar varandra). Eftersom liknande laddningar stöter bort varandra, måste de få positivt laddade megapixelpartiklarna som bytte vägar plötsligt ha träffat eller närmat sig en annan kropp som också hade en högkoncentrerad positiv laddning. Eftersom avböjningarna inträffade en liten del av tiden upptog denna laddning endast en liten del av utrymmet i guldfolien. Rutherford analyserade en serie sådana experiment i detalj och drog två slutsatser:
- volymen som upptas av en atom måste bestå av en stor mängd tomt utrymme.
- en liten, relativt tung, positivt laddad kropp, kärnan, måste vara i mitten av varje atom.
denna analys ledde Rutherford att föreslå en modell där en atom består av en mycket liten, positivt laddad kärna, där det mesta av atomens massa är koncentrerad, omgiven av de negativt laddade elektronerna, så att atomen är elektriskt neutral (figur \(\PageIndex{5}\)).
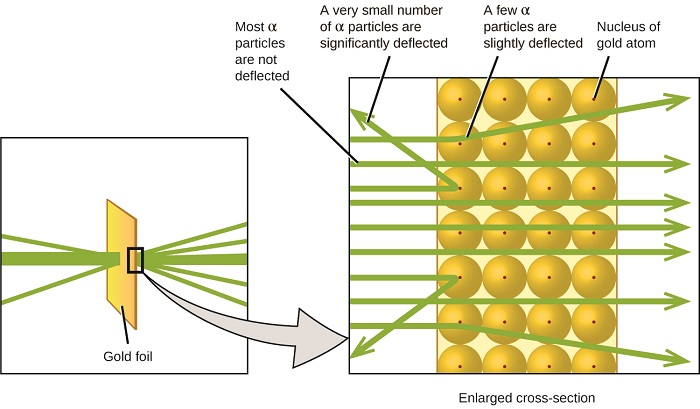
figur \(\PageIndex{9}\): partiklarna avböjs endast när de kolliderar med eller passerar nära den mycket tyngre, positivt laddade guldkärnan. Eftersom kärnan är mycket liten jämfört med storleken på en atom, avböjs mycket få megapixelpartiklar. De flesta passerar genom den relativt stora regionen som upptas av elektroner, som är för lätta för att avleda de snabbt rörliga partiklarna.efter många fler experiment upptäckte Rutherford också att kärnorna i andra element innehåller vätekärnan som en ”byggsten” och han kallade denna mer grundläggande partikel protonen, den positivt laddade, subatomära partikeln som finns i kärnan. Med ett tillägg, som du kommer att lära dig nästa, används denna kärnmodell av atomen, som föreslogs för över ett sekel sedan, fortfarande idag.
ett annat viktigt resultat var upptäckten av isotoper. Under början av 1900-talet identifierade forskare flera ämnen som tycktes vara nya element och isolerade dem från radioaktiva malmer. Till exempel fick ett” nytt element ” producerat av det radioaktiva sönderfallet av torium ursprungligen namnet mesothorium. En mer detaljerad analys visade emellertid att mesothorium var kemiskt identiskt med radium (en annan sönderfallsprodukt), trots att den hade en annan atommassa. Detta resultat, tillsammans med liknande fynd för andra element, ledde den engelska kemisten Frederick Soddy att inse att ett element kunde ha typer av atomer med olika massor som var kemiskt oskiljbara. Dessa olika typer kallas isotoper-atomer av samma element som skiljer sig åt i massa. Soddy tilldelades Nobelpriset i kemi 1921 för denna upptäckt.
ett pussel återstod: kärnan var känd för att innehålla nästan hela massan av en atom, med antalet protoner som bara gav hälften eller mindre av den massan. Olika förslag gjordes för att förklara vad som utgjorde den återstående massan, inklusive förekomsten av neutrala partiklar i kärnan. Som du kan förvänta dig är det mycket utmanande att upptäcka oladdade partiklar, och det var inte förrän 1932 som James Chadwick hittade bevis på neutroner, oladdade, subatomära partiklar med en massa ungefär samma som protoner. Förekomsten av neutronen förklarade också isotoper: de skiljer sig i massa eftersom de har olika antal neutroner, men de är kemiskt identiska eftersom de har samma antal protoner. Detta kommer att förklaras mer detaljerat senare i denna enhet.