5.3: Lewis-Diagram
Lewis använde enkla diagram (nu kallade Lewis-diagram) för att hålla reda på hur många elektroner som fanns i det yttersta eller valensskalet av en given atom. Atomkärnan, dvs kärnan tillsammans med de inre elektronerna, representeras av den kemiska symbolen, och endast valenselektronerna dras som prickar som omger den kemiska symbolen. Således kan de tre atomerna som visas i Figur 1 från elektroner och Valens representeras av följande Lewis-diagram:
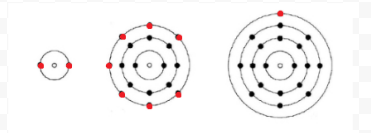

om atomen är en ädelgasatom är två alternativa procedurer möjliga. Antingen kan vi betrakta atomen som nollvalenselektroner eller så kan vi betrakta det yttersta fyllda skalet som valensskalet. De tre första ädelgaserna kan således skrivas som:
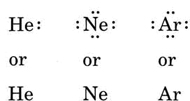
exempel \(\PageIndex{1}\): Lewis Structures
Rita Lewis-diagram för en atom av vart och ett av följande element: Li, N, F, Na
lösning
vi finner från det periodiska bordet inuti frontluckan att Li har ett atomnummer på 3. Den innehåller således tre elektroner, en mer än ädelgasen He. Detta innebär att det yttersta eller valensskalet endast innehåller en elektron, och Lewis-diagrammet är
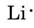
efter samma resonemang har N sju elektroner, fem mer än han, medan F har nio elektroner, sju mer än han, vilket ger
![]()
Na har nio fler elektroner än han, men åtta av dem finns i kärnan, vilket motsvarar de åtta elektronerna i det yttersta skalet av Ne. Eftersom Na bara har 1 mer elektron än Ne är dess Lewis-diagram
![]()
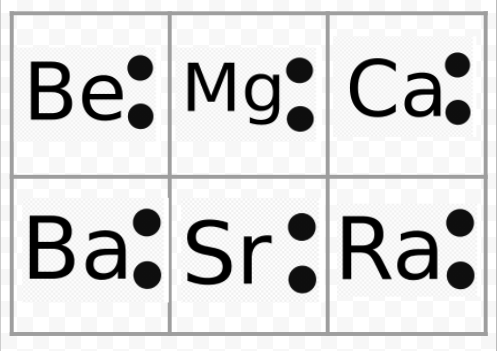
meddelande från föregående exempel att Lewis-diagrammen för alkalimetallerna är identiska med undantag för deras kemiska symboler. Detta överensstämmer fint med alkalimetallernas mycket liknande kemiska beteende. På samma sätt ser Lewis-diagram för alla element i andra grupper, såsom alkaliska jordar eller halogener, likadana ut.
Lewis-diagrammen kan också användas för att förutsäga elementens valenser. Lewis föreslog att antalet valenser av en atom var lika med antalet elektroner i dess valensskal eller till antalet elektroner som skulle behöva läggas till valensskalet för att uppnå den elektroniska skalstrukturen för nästa ädelgas. Som ett exempel på den här tanken, överväga elementen vara och O. deras Lewis-diagram och de av ädelgaserna han och Ne är

jämför Be med He, vi ser att den förra har ytterligare två elektroner och därför bör ha en valens på 2. Elementet O kan förväntas ha en valens av 6 eller en valens av 2 eftersom den har sex valenselektroner—två mindre än Ne. Med hjälp av valensregler som utvecklats på detta sätt kunde Lewis redogöra för den regelbundna ökningen och minskningen av prenumerationerna av föreningarna i tabellen som finns i Valensavsnittet och reproduceras här. Dessutom kunde han stå för mer än 50 procent av formlerna i tabellen. (De som håller med hans tankar är skuggade i färg i tabellen. Du kanske vill hänvisa till den tabellen nu och verifiera att några av de angivna formlerna följer Lewis regler.) Lewis framgång i detta sammanhang gav en tydlig indikation på att elektroner var den viktigaste faktorn för att hålla atomer ihop när molekyler bildades.
trots dessa framgångar finns det också svårigheter i Lewis teorier, särskilt för element utöver kalcium i det periodiska systemet. Elementet Br (Z = 35) har till exempel 17 fler elektroner än ädelgasen Ar (Z = 18). Detta leder oss till slutsatsen att Br har 17 valenselektroner, vilket gör det besvärligt att förklara varför Br liknar Cl och F så nära även om dessa två atomer bara har sju valenselektroner.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Han är en av de mest kända och mest kända i världen.