Concepts of Biology – 1st Canadian Edition
virus upptäcktes först efter utvecklingen av ett porslinsfilter, kallat Chamberland-Pasteur-filtret, som kunde ta bort alla bakterier som är synliga under mikroskopet från något flytande prov. År 1886 visade Adolph Meyer att en sjukdom av tobaksväxter, tobaksmosaiksjukdom, kunde överföras från en sjuk växt till en frisk genom flytande växtextrakt. 1892 visade Dmitri Ivanowski att denna sjukdom kunde överföras på detta sätt även efter att Chamberland-Pasteur-filtret hade tagit bort alla livskraftiga bakterier från extraktet. Ändå var det många år innan det bevisades att dessa ”filtrerbara” smittämnen inte bara var mycket små bakterier utan var en ny typ av liten, sjukdomsframkallande partikel.
virioner, enstaka viruspartiklar, är mycket små, cirka 20-250 nanometer (1 nanometer = 1/1 000 000 mm). Dessa enskilda viruspartiklar är den infektiösa formen av ett virus utanför värdcellen. Till skillnad från bakterier (som är cirka 100 gånger större) kan vi inte se virus med ett ljusmikroskop, med undantag för några stora virioner i poxvirusfamiljen (figur 12.3).
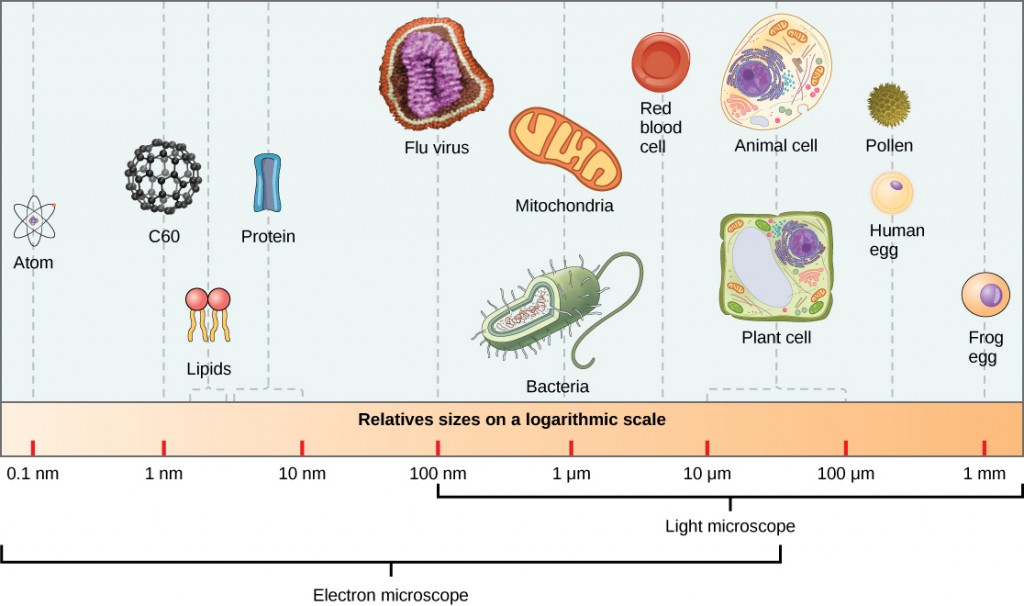
det var inte förrän utvecklingen av elektronmikroskopet på 1940-talet som forskare fick sin första goda bild av tobaksmosaikvirusets struktur (figur 12.2) och andra. Ytstrukturen hos virioner kan observeras genom både skanning och transmissionselektronmikroskopi, medan virusets inre strukturer endast kan observeras i bilder från ett transmissionselektronmikroskop (figur 12.4).
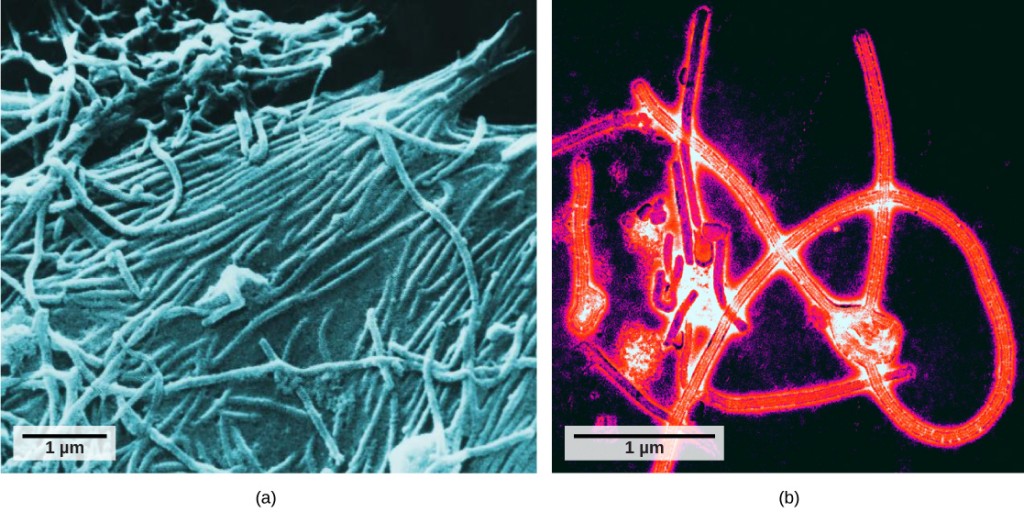
användningen av denna teknik har möjliggjort upptäckten av många virus av alla typer av levande organismer. De grupperades ursprungligen efter delad morfologi, vilket betyder deras storlek, form och särskiljande strukturer. Senare klassificerades grupper av virus efter den typ av nukleinsyra de innehöll, DNA eller RNA, och om deras nukleinsyra var enkel – eller dubbelsträngad. På senare tid har molekylär analys av virala replikationscykler förfinat deras klassificering ytterligare.
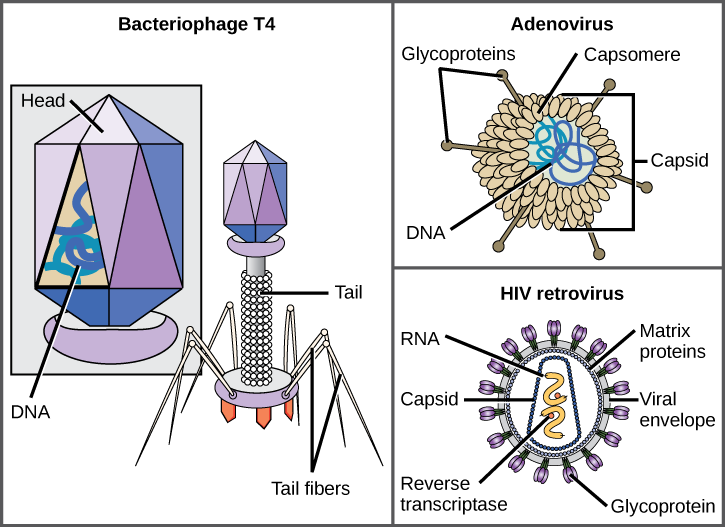
en virion består av en nukleinsyrakärna, en yttre proteinbeläggning och ibland ett yttre hölje av protein-och fosfolipidmembran härledda från värdcellen. Den mest synliga skillnaden mellan medlemmar av virusfamiljer är deras morfologi, vilket är ganska olika. En intressant egenskap av viral komplexitet är att värdens komplexitet inte korrelerar med komplexiteten hos virionen. Några av de mest komplexa virionstrukturerna observeras i bakteriofager, virus som infekterar de enklaste levande organismerna, bakterier.
virus finns i många former och storlekar, men dessa är konsekventa och distinkta för varje virusfamilj (figur 12.5). Alla virioner har ett nukleinsyragenom täckt av ett skyddande skikt av protein, kallat en kapsid. Kapsiden är gjord av proteinunderenheter som kallas kapsomerer. Vissa virala kapsider är enkla polyedriska” sfärer”, medan andra är ganska komplexa i struktur. Den yttre strukturen som omger kapsiden hos vissa virus kallas virushöljet. Alla virus använder någon form av glykoprotein för att fästa vid sina värdceller vid molekyler på cellen som kallas virala receptorer. Viruset utnyttjar dessa cellytmolekyler, som cellen använder för något annat ändamål, som ett sätt att känna igen och infektera specifika celltyper. Till exempel använder mässlingviruset ett cellyt glykoprotein hos människor som normalt fungerar i immunreaktioner och eventuellt i sperma-ägginteraktionen vid befruktning. Attachment är ett krav för virus att senare tränga in i cellmembranet, injicera virusgenomet och slutföra deras replikering inuti cellen.
T4-bakteriofagen, som infekterar E. coli-bakterien, är bland de mest komplexa virionerna som är kända; T4 har en proteinsvansstruktur som viruset använder för att fästa vid värdcellen och en huvudstruktur som rymmer dess DNA.
Adenovirus, ett nonenveloped djurvirus som orsakar andningssjukdomar hos människor, använder proteinspikar som sticker ut från kapsomererna för att fästa vid värdcellen. Nonenveloped virus inkluderar också de som orsakar polio (poliovirus), plantarwarts (papillomavirus) och hepatit A (Hepatit A-virus). Nonenveloped virus tenderar att vara mer robusta och mer benägna att överleva under svåra förhållanden, såsom tarmen.
omslutna virioner som HIV (humant immunbristvirus), orsaksmedlet i AIDS (förvärvat immunbristsyndrom), består av nukleinsyra (RNA i fallet med HIV) och kapsidproteiner omgivna av ett fosfolipid dubbelskikthölje och dess associerade proteiner (figur 12.5). Vattkoppor, influensa och påssjuka är exempel på sjukdomar orsakade av virus med kuvert. På grund av Kuvertets bräcklighet är nonenveloped virus mer resistenta mot förändringar i temperatur, pH och vissa desinfektionsmedel än omslutna virus.
sammantaget berättar virionens form och närvaron eller frånvaron av ett kuvert lite om vilka sjukdomar virusen kan orsaka eller vilka arter de kan infektera, men är fortfarande ett användbart sätt att börja viral klassificering.
vilket av följande påståenden om virusstruktur är sant?
A) alla virus är inneslutna i ett viralt membran.
B) capsomeren består av små proteinunderenheter som kallas capsids.
C) DNA är det genetiska materialet i alla virus.
D) glykoproteiner hjälper viruset att fästa vid värdcellen.
<!- D – >
till skillnad från alla levande organismer som använder DNA som sitt genetiska material kan virus använda antingen DNA eller RNA som deras. Viruskärnan innehåller genomet eller det totala genetiska innehållet i viruset. Virala genom tenderar att vara små jämfört med bakterier eller eukaryoter, som endast innehåller de gener som kodar för proteiner som viruset inte kan få från värdcellen. Detta genetiska material kan vara enkelsträngat eller dubbelsträngat. Det kan också vara linjärt eller cirkulärt. Medan de flesta virus innehåller ett enda segment av nukleinsyra, har andra genom som består av flera segment.
DNA-virus har en DNA-kärna. Viralt DNA styr värdcellens replikationsproteiner för att syntetisera nya kopior av virusgenomet och att transkribera och översätta det genomet till virala proteiner. DNA-virus orsakar mänskliga sjukdomar som vattkoppor, hepatit B och vissa könssjukdomar som herpes och könsvårtor.
RNA-virus innehåller endast RNA i sina kärnor. För att replikera deras Genom i värdcellen kodar genomerna av RNA-virus enzymer som inte finns i värdceller. RNA-polymerasenzymer är inte lika stabila som DNA-polymeraser och gör ofta misstag under transkription. Av denna anledning förekommer mutationer, förändringar i nukleotidsekvensen, i RNA-virus oftare än i DNA-virus. Detta leder till snabbare utveckling och förändring av RNA-virus. Till exempel är det faktum att influensa är ett RNA-virus en anledning till att ett nytt influensavaccin behövs varje år. Mänskliga sjukdomar orsakade av RNA-virus inkluderar hepatit C, mässling och rabies.
virus kan ses som obligatoriska intracellulära parasiter. Viruset måste fästa vid en levande cell, tas inuti, tillverka dess proteiner och kopiera dess genom och hitta ett sätt att fly från cellen så att viruset kan infektera andra celler och i slutändan andra individer. Virus kan infektera endast vissa arter av värdar och endast vissa celler inom den värden. Den molekylära grunden för denna specificitet är att en viss ytmolekyl, känd som virusreceptorn, måste hittas på värdcellytan för att viruset ska fästa. Metaboliska skillnader som ses i olika celltyper baserat på differentiellt genuttryck är också en sannolik faktor i vilken celler ett virus kan använda för att replikera. Cellen måste göra de ämnen som viruset behöver, såsom enzymer som virusgenomet själv inte har gener för, eller viruset kommer inte att kunna replikera med den cellen.
steg för virusinfektioner
ett virus måste ”ta över” en cell för att replikera. Virusreplikationscykeln kan producera dramatiska biokemiska och strukturella förändringar i värdcellen, vilket kan orsaka cellskador. Dessa förändringar, som kallas cytopatiska effekter, kan ändra cellfunktioner eller till och med förstöra cellen. Vissa infekterade celler, såsom de som är infekterade av förkylningsviruset (rhinovirus), dör genom Lys (sprängning) eller apoptos (programmerad celldöd eller ”cellmord”) och släpper ut alla avkomman virioner på en gång. Symtomen på virussjukdomar är resultatet av immunsvaret mot viruset, som försöker kontrollera och eliminera viruset från kroppen och från cellskador orsakade av viruset. Många djurvirus, såsom HIV (humant immunbristvirus), lämnar de infekterade cellerna i immunsystemet genom en process som kallas spirande, där virioner lämnar cellen individuellt. Under den spirande processen genomgår cellen inte Lys och dödas inte omedelbart. Skadorna på cellerna som HIV infekterar kan dock göra det omöjligt för cellerna att fungera som medlare av immunitet, även om cellerna förblir levande under en tidsperiod. Mest produktiva virusinfektioner följer liknande steg i virusreplikationscykeln: fastsättning, penetration, beläggning, replikering, montering och frisättning.
ett virus fäster vid ett specifikt receptorställe på värdcellmembranet genom fästproteiner i kapsiden eller proteiner inbäddade i dess hölje. Bindningen är specifik, och vanligtvis kommer ett virus bara att fästa vid celler av en eller några få arter och endast vissa celltyper inom dessa arter med lämpliga receptorer.
koncept i aktion

se den här videon för en visuell förklaring av hur HIV och influensa attackerar kroppen.
Till skillnad från djurvirus injiceras nukleinsyran av bakteriofager i värdcellen naken och lämnar kapsiden utanför cellen. Växt-och djurvirus kan komma in i sina celler genom endocytos, där cellmembranet omger och uppslukar hela viruset. Vissa höljda virus kommer in i cellen när virushöljet smälter direkt med cellmembranet. En gång inuti cellen bryts den virala kapsiden ned och den virala nukleinsyran frigörs, som sedan blir tillgänglig för replikering och transkription.
replikationsmekanismen beror på virusgenomet. DNA-virus använder vanligtvis värdcellproteiner och enzymer för att göra ytterligare DNA som används för att kopiera genomet eller transkriberas till messenger RNA (mRNA), som sedan används i proteinsyntes. RNA-virus, såsom influensavirus, brukar använda RNA-kärnan som en mall för syntes av viralt genomiskt RNA och mRNA. Viral mRNA översätts till virala enzymer och kapsidproteiner för att montera nya virioner (figur 12.6). Naturligtvis finns det undantag från detta mönster. Om en värdcell inte tillhandahåller de enzymer som är nödvändiga för viral replikation, levererar virusgener informationen för direkt syntes av de saknade proteinerna. Retrovirus, såsom HIV, har ett RNA-genom som måste transkriberas omvänd för att göra DNA, som sedan sätts in i värdens DNA. För att omvandla RNA till DNA innehåller Retrovirus gener som kodar för det virusspecifika enzymet omvänd transkriptas som transkriberar en RNA-Mall till DNA. Det faktum att HIV producerar några av sina egna enzymer, som inte finns i värden, har gjort det möjligt för forskare att utveckla läkemedel som hämmar dessa enzymer. Dessa läkemedel, inklusive den omvända transkriptashämmaren AZT, hämmar HIV-replikation genom att minska enzymets aktivitet utan att påverka värdens metabolism.
det sista steget av viral replikation är frisättningen av de nya virionerna i värdorganismen, där de kan infektera intilliggande celler och upprepa replikationscykeln. Vissa virus frigörs när värdcellen dör och andra virus kan lämna infekterade celler genom att spira genom membranet utan att döda cellen direkt.
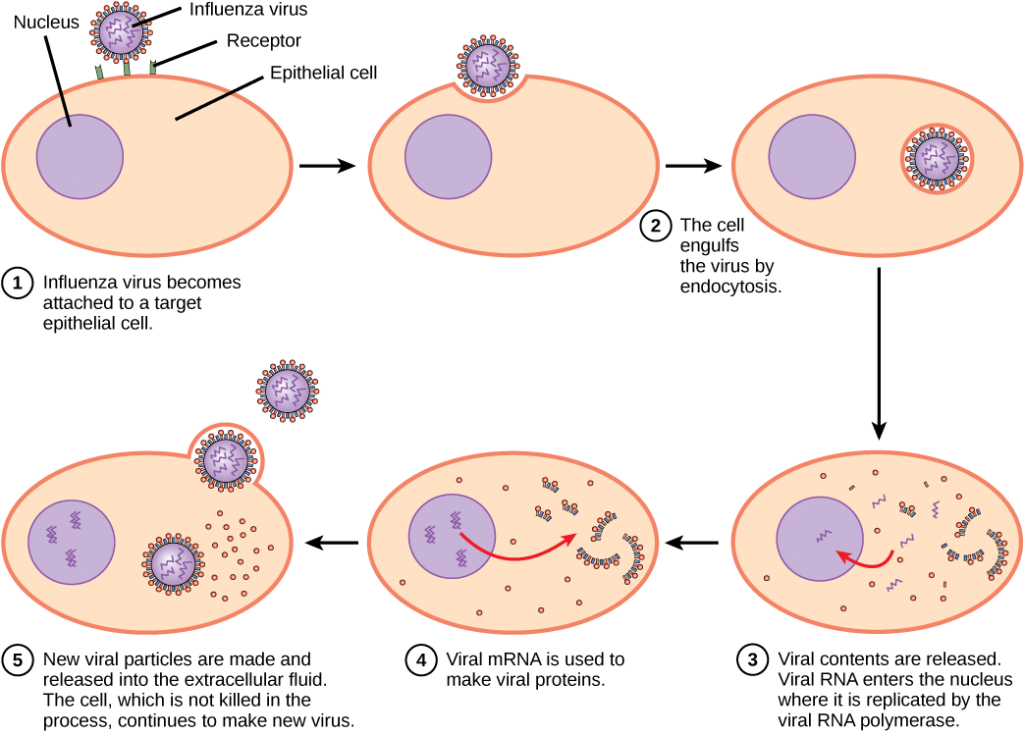
influensavirus är förpackat i ett viralt kuvert som smälter samman med plasmamembranet. På så sätt kan viruset lämna värdcellen utan att döda den. Vilken fördel får viruset genom att hålla värdcellen vid liv?
<!- Värdcellen kan fortsätta att skapa nya viruspartiklar.- >
koncept i aktion

klicka igenom denna handledning om virus för att identifiera strukturer, överföringslägen, replikering och mer.