Entalpi och kemiska reaktioner
7.3 entalpi och kemiska reaktioner
inlärningsmål
- definiera entalpi.
- korrekt uttrycka entalpiförändringen av kemiska reaktioner.
- förklara hur entalpiförändringar mäts experimentellt.
Nu när vi har visat hur energi, arbete och värme är relaterade är vi redo att överväga energiförändringar i kemiska reaktioner. Ett grundläggande begrepp är att varje kemisk reaktion sker med en samtidig energiförändring. Nu behöver vi lära oss hur man korrekt uttrycker dessa energiförändringar.
vår studie av gaser i kapitel 6 ” gaser ”och vår definition av arbete i avsnitt 7.2″ arbete och värme ” indikerar att förhållanden som tryck, volym och temperatur påverkar energiinnehållet i ett system. Vad vi behöver är en definition av energi som håller när några av dessa förhållanden specificeras (något som liknar vår definition av standardtemperatur och tryck i vår studie av gaser). Vi definierar entalpiförändringenvärmen av en process vid konstant tryck; betecknad USUKH. (UBR) som värmen i en process när trycket hålls konstant:
UCLH UCL qat konstant tryck
bokstaven H står för” entalpi”, en slags energi, medan UCL innebär en förändring i kvantiteten. Vi kommer alltid att vara intresserade av förändringen i H, snarare än det absoluta värdet av H själv.
När en kemisk reaktion inträffar är det en karakteristisk förändring i entalpi. Entalpiförändringen för en reaktion skrivs vanligtvis efter en balanserad kemisk ekvation och på samma linje. Till exempel, när två mol väte reagerar med en mol syre för att göra två mol vatten, är den karakteristiska entalpiförändringen 570 kJ. Vi skriver ekvationen som
2h2(g) + O2(g) 2H2O (GHz) 2H = -570 kj
en kemisk ekvation som innehåller en entalpiförändring kallas en termokemisk ekvationenkemisk ekvation som innehåller en entalpiförändring.. En termokemisk ekvation antas hänvisa till ekvationen i molära kvantiteter, vilket innebär att den måste tolkas i termer av mol, inte enskilda molekyler.
exempel 5
skriv den termokemiska ekvationen för reaktionen av PCl3(g) med Cl2(g) för att göra PCl5(g), som har en entalpiförändring på -88 kJ.
lösning
den termokemiska ekvationen är
PCl3(g) + Cl2(g) bisexuell PCl5(g) UXBL = -88 kJ
Testa dig själv
skriv den termokemiska ekvationen för reaktionen av N2(g) med O2(g) för att göra 2NO (g), som har en entalpiförändring på 181 kJ.
svar
N2 (g) + O2(g) 2NR (g) 2NR = 181 kj
Du kanske har märkt att en kemisk reaktion kan vara positiv eller negativ. Numret antas vara positivt om det inte har något tecken; ett + tecken kan läggas till uttryckligen för att undvika förvirring. En kemisk reaktion som har en positiv UIH sägs vara endotermen kemisk reaktion som har en positiv förändring i entalpi., medan en kemisk reaktion som har en negativ AUDH sägs vara exotermen kemisk reaktion som har en negativ förändring i entalpi..
vad betyder det om en process är positiv? Det betyder att systemet där den kemiska reaktionen inträffar får energi. Om man betraktar energin i ett system som representerad som en höjd på en vertikal energiplott, kan entalpiförändringen som följer med reaktionen diagrammas som delvis (A) i Figur 7.3 ”Reaktionsenergi”: reaktanternas energi har viss energi, och systemet ökar sin energi när det går till produkter. Produkterna är högre i vertikal skala än reaktanterna. Endoterm innebär då att systemet får eller absorberar energi.
en motsatt situation existerar för en exoterm process, som visas i del (b) i Figur 7.3 ”Reaktionsenergi”. Om entalpiförändringen av en reaktion är negativ förlorar systemet energi, så produkterna har mindre energi än reaktanterna, och produkterna är lägre på den vertikala energiskalan än reaktanterna är. Exoterm innebär då att systemet förlorar eller avger energi.
figur 7.3 Reaktionsenergi
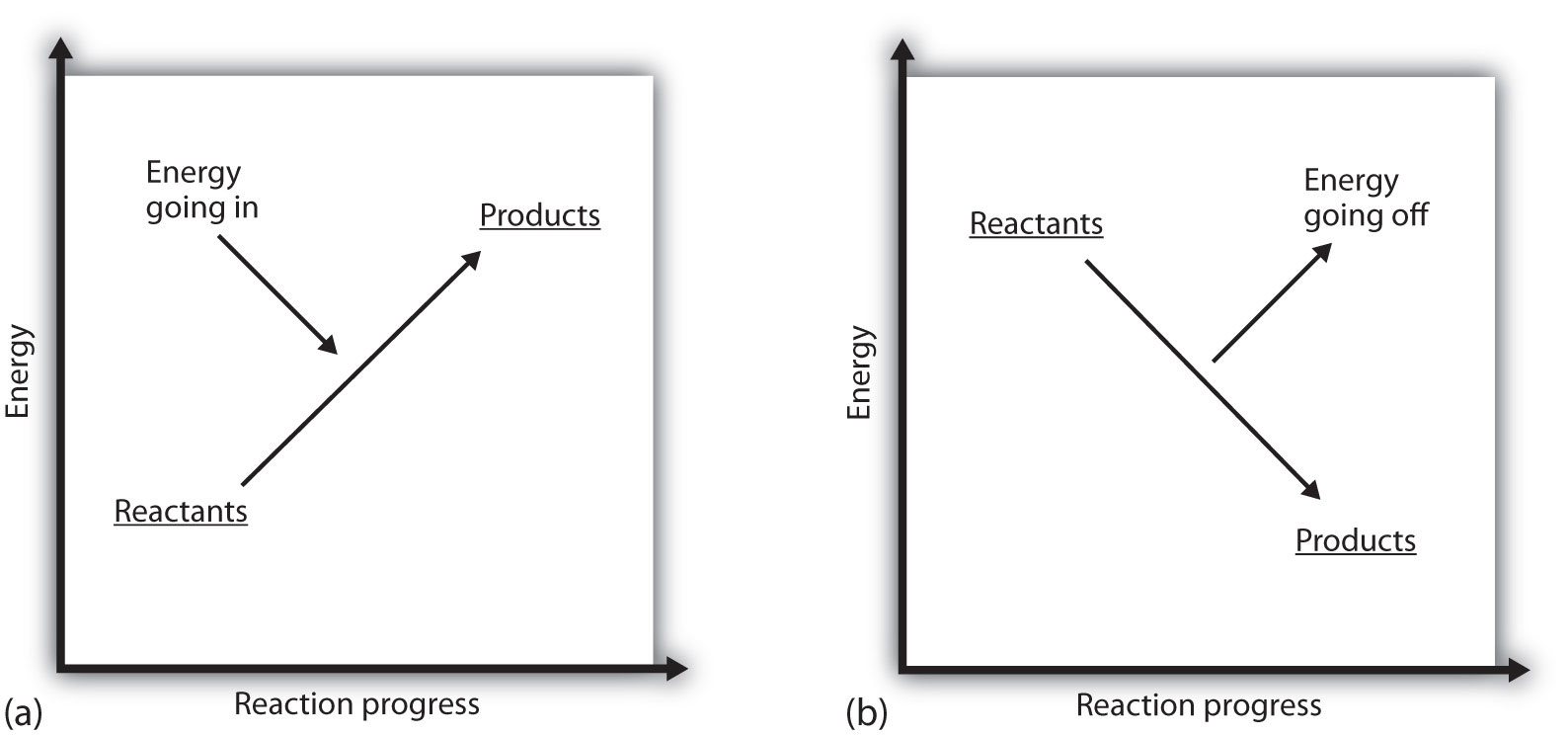
(a) i en endoterm reaktion ökar systemets energi (dvs rör sig högre på den vertikala energiskalan). (b) i en exoterm reaktion minskar systemets energi (dvs rör sig lägre på den vertikala energiskalan).
exempel 6
Tänk på denna termokemiska ekvation.
2CO (g) + O2(g) 0co2(g) 2C = -565 kj
är det exoterm eller endoterm? Hur mycket energi avges eller absorberas?
lösning
per definition är en kemisk reaktion som har en negativ Macau exoterm, vilket innebär att så mycket energi—i detta fall 565 kJ—avges av reaktionen.
Testa dig själv
Tänk på denna termokemiska ekvation.
CO2 (g) + H2(g) 2CB CO(g) + H2O(g) 2CB = 42 kJ
är det exoterm eller endoterm? Hur mycket energi avges eller absorberas?
svar
endoterm; 42 kJ absorberas.
hur mäts mätvärden för HCG experimentellt? I själva verket mäts inte AUDH; q mäts. Men mätningarna utförs under betingelser med konstant tryck, så att den uppmätta Q är lika med den uppmätta.
experimentellt mäts q genom att dra fördel av ekvationen
q = mc oguilt
vi förmäter massan av kemikalierna i ett system. Sedan låter vi den kemiska reaktionen inträffa och mäter temperaturförändringen (ACCRT) i systemet. Om vi känner till den specifika värmen hos materialen i systemet (vanligtvis gör vi) kan vi beräkna q. det värdet av q är numeriskt lika med processens process, som vi kan skala upp till en molär skala. Behållaren i vilken systemet ligger är vanligtvis isolerat, så någon energiförändring går till att ändra systemets temperatur snarare än att läcka ut från systemet. Behållaren kallas en kalorimeteren behållare som används för att mäta värmen av en kemisk reaktion., och processen att mäta förändringar i entalpi kallas kalorimetriprocessen att mäta entalpi förändras för kemiska reaktioner..
figur 7.4 kalorimetrar
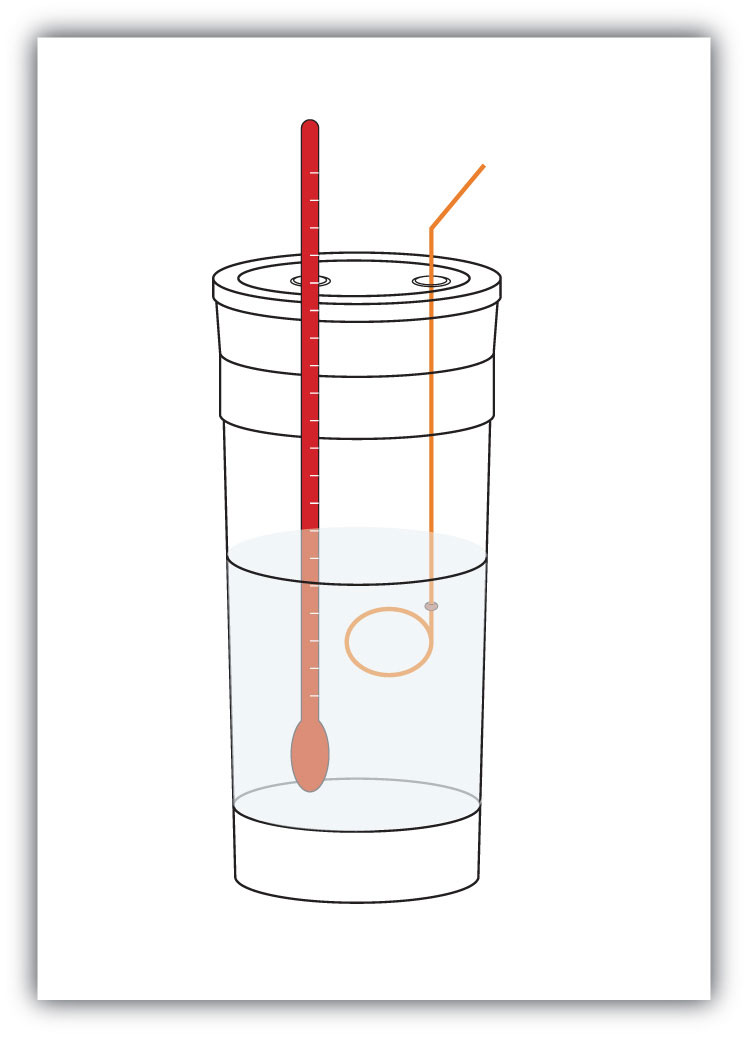
en enkel kalorimeter kan konstrueras från några kapslade skumkaffekoppar, ett lock, en termometer och en omrörare.
Antag till exempel att 4,0 g NaOH eller 0,10 mol NaOH löses för att göra 100,0 mL vattenlösning, medan 3,65 g HCl eller 0,10 mol HCl löses för att göra ytterligare 100,0 mL vattenlösning. De två lösningarna blandas i en isolerad kalorimeter, en termometer sätts in och kalorimetern täcks (se figur 7.4 ”kalorimetrar” för en exempelinställning). Termometern mäter temperaturförändringen när följande kemiska reaktion inträffar:
NaOH(aq) + HCl(aq) bisexuell NaCl(aq) + H2O (XHamster)
en observatör noterar att temperaturen ökar från 22,4 C till 29,1 C. förutsatt att lösningarnas värmekapacitet och densiteter är desamma som för rent vatten, har vi nu den information vi behöver för att bestämma entalpiförändringen av den kemiska reaktionen. Den totala mängden lösning är 200,0 mL och med en densitet av 1,00 g/mL har vi således 200,0 g lösning. Med hjälp av ekvationen för q ersätter vi våra experimentella mätningar och den specifika värmen av vatten (tabell 7.1 ”specifika värmer av olika ämnen”):
q=(200.0 g)(4.184 J G C. C)(6.7 C. C)
lösning för Q, vi får
q=5,600 J U. C. för reaktionen
värmen Q är lika med U. C. C. för reaktionen eftersom den kemiska reaktionen sker vid konstant tryck. Reaktionen avger emellertid denna mängd energi, så det faktiska tecknet på avsugningar är negativt:
USC = -5,600 J för reaktionen
Således har vi följande termokemiska ekvation för den kemiska reaktionen som inträffade i kalorimetern:
110 NaOH(aq)+110 HCl(aq) USC 110 NaCl(aq)+110 H2o(USC)USC=-5,600 J
de 1/10 koefficienterna är närvarande för att påminna oss om att vi började med en tiondel av en mol av varje reaktant, så vi gör en tiondel av en mol av varje produkt. Vanligtvis rapporterar vi dock termokemiska ekvationer i termer av mol, inte en tiondel av en mol. För att skala upp till molära kvantiteter måste vi multiplicera koefficienterna med 10. Men när vi gör det får vi 10 gånger så mycket energi. Vi har alltså
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
ΔH kan omvandlas till kJ-enheter, så vår sista termokemiska ekvationen
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Vi har bara tagit vår experimentella data från kalorimetri och bestäms entalpi förändring av en kemisk reaktion. Liknande mätningar på andra kemiska reaktioner kan bestämma värdena för vilken kemisk reaktion som helst som du vill studera.
exempel 7
en 100 mL lösning av 0.25 mol Ca2+(aq) blandades med 0,50 mol F−(aq) joner, och CaF2 utfälldes:
Ca2+(aq) + 2F−(aq) sackios CaF2(s)
lösningens temperatur ökade med 10,5 kcal C. Vad var entalpiförändringen för den kemiska reaktionen? Vad var entalpiförändringen för produktion av 1 mol CaF2? Antag att lösningen har samma densitet och specifik värme som vatten.
lösning
eftersom vi ges direkt direkt kan vi bestämma reaktionsvärmen, vilket är lika med 0h:
q=(100 g)(4,184 j g 2CB) (10.5 msk c)
lösning för q, vi får
q = 4400 J
därför är USC = -4400 J.
enligt stökiometrin av reaktionen kommer exakt 0,25 mol CaF2 att bildas, så denna mängd värme är för 0,25 mol. För 1 mol CaF2 måste vi skala upp värmen med en faktor fyra:
q = 4.400 J 6 = 17.600 J för 1 mol CaF2
på molär basis är förändringen i entalpi
USBI = -17.600 J = -17.6 kJ
Testa dig själv
i en kalorimeter vid konstant tryck, 0,10 mol CH4(g) och 0,20 mol av O2(g) reageras.
CH4 (g) + 2O2(g) cu CO2(g) + 2H2O(cu)
reaktionen värmer 750.0 g H2O med 28,4 GHz C. Vad är det för reaktionen på en molär skala?
svar
-891 kJ
viktiga Takeaways
- varje kemisk reaktion sker med en samtidig energiförändring.
- förändringen i entalpi är lika med värme vid konstant tryck.
- entalpiförändringar kan uttryckas med hjälp av termokemiska ekvationer.
- entalpiförändringar mäts med hjälp av kalorimetri.
övningar
-
under vilka omständigheter är q och usci samma?
-
under vilka omständigheter är q och usci olika?
-
vätgas och klorgas reagerar för att göra vätekloridgas med en åtföljande entalpiförändring på -184 kJ. Skriv en korrekt balanserad termokemisk ekvation för denna process.
-
propan (C3H8) reagerar med elementär syrgas för att producera koldioxid och flytande vatten med en åtföljande entalpiförändring på -2,220 kJ. Skriv en korrekt balanserad termokemisk ekvation för denna process.
-
kvävgas reagerar med syrgas för att göra NO (g) medan den absorberar 180 kJ. Skriv en korrekt balanserad termokemisk ekvation för denna process.
-
fast natrium reagerar med klorgas för att göra fast natriumklorid medan den avger 772 kJ. Skriv en korrekt balanserad termokemisk ekvation för denna process.
-
vätgas och klorgas reagerar för att göra vätekloridgas med en åtföljande entalpiförändring på -184 kJ. Är denna process endoterm eller exoterm?
-
propan (C3H8) reagerar med elementär syrgas för att producera koldioxid samtidigt som den avger 2 220 kJ energi. Är denna process endoterm eller exoterm?
-
kvävgas reagerar med syrgas för att göra NO (g) medan den absorberar 180 kJ. Är denna process exoterm eller endoterm?
-
natriummetall kan reagera med kväve för att göra natriumazid (NaN3) med en 21,72 kj. Är denna process exoterm eller endoterm?
-
rita ett energinivådiagram för den kemiska reaktionen i Övning 8. (Se figur 7.3 ”Reaktionsenergi” för ett exempel.)
-
rita ett energinivådiagram för den kemiska reaktionen i Övning 9. (Se figur 7.3 ”Reaktionsenergi” för ett exempel.)
-
i en 250 mL lösning kombineras 0,25 mol KOH(aq) och 0,25 mol HNO3(aq). Lösningens temperatur ökar från 22,5 CCG till 35,9 CCG.Antag att lösningen har samma densitet och värmekapacitet för vatten. Vad är reaktionens värme, och vad är reaktionen av reaktionen på molär basis?
-
i en 600 mL lösning, 0.50 mol Ca(OH)2(aq) och 0,50 mol H2SO4(aq) kombineras. Lösningens temperatur ökar med 22,3 kcal C. Vad är reaktionens värme,och vad är reaktionen av reaktionen på molär basis? Antag att lösningen har samma densitet och värmekapacitet för vatten.
-
för att värma 400,0 g H2O bränns 0,050 mol etanol (C2H5OH). Vattnet värms från 24,6 C till 65,6 C. Vad är reaktionens värme, och vad är reaktionen av reaktionen på molär basis?
-
för att värma 100,0 g H2O bränns 0,066 mol bivax. Vattnet värms från 21,4 C till 25,5 C. Vad är reaktionens värme, och vad är reaktionen av reaktionen på molär basis?
svar
-
under förhållanden med konstant tryck
-
H2(g) + Cl2(g) 2HCl(g) 2HCl = -184 kj
-
N2(g) + O2(g) 2NJ(g) 2NJ (g) = 180 kj
-
exoterm
-
endoterm
-
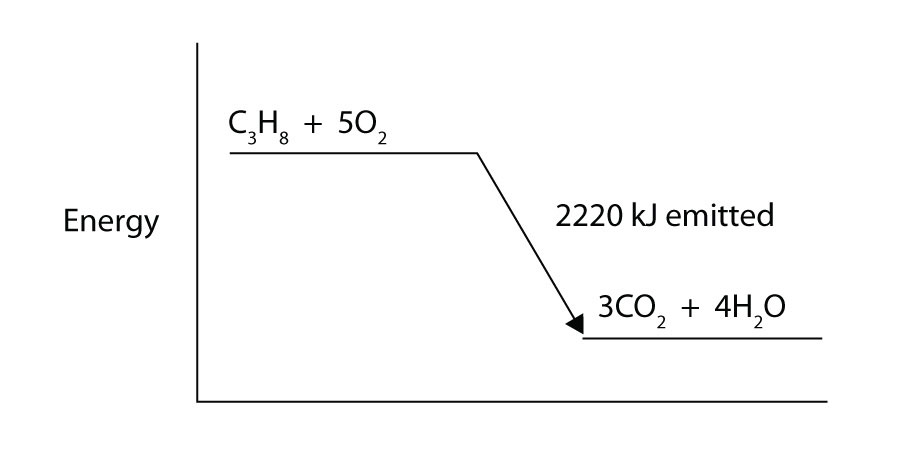
-
reaktionsvärme = -14,0 kj; -56,0 kJ/mol av reaktanter
-
reaktionsvärme = -68,6 kJ; -1370 kJ/mol etanol