inledande Kemi-1: A kanadensiska upplagan
inlärningsmål
- definiera vätskans ångtryck.
- förklara ursprunget för både ytspänning och kapillärverkan.
det finns några egenskaper som alla vätskor har. Vätskan som vi är mest bekanta med är förmodligen vatten, och den har dessa egenskaper. Andra vätskor har dem också, vilket är något att tänka på.
alla vätskor har en viss del av sina partiklar som har tillräckligt med energi för att komma in i gasfasen, och om dessa partiklar ligger på vätskans yta gör de det (figur 10.6 ”indunstning”). Bildandet av en gas från en vätska vid temperaturer under kokpunkten kallas förångning. Vid dessa temperaturer kallas materialet i gasfasen ånga, snarare än gas; termen gas är reserverad för när gasfasen är den stabila fasen.
Figur 10.6 indunstning

vissa partiklar av en vätska har tillräckligt med energi för att undkomma vätskefasen för att bli en ånga.
om den tillgängliga volymen är tillräckligt stor blir all vätska så småningom ånga. Men om den tillgängliga volymen inte räcker, kommer så småningom några av ångpartiklarna att återgå till vätskefasen (figur 10.7 ”jämvikt”). Vid någon tidpunkt kommer antalet partiklar som kommer in i ångfasen att motsvara antalet partiklar som lämnar ångfasen, så det sker ingen nettoförändring i mängden ånga i systemet. Vi säger att systemet är i jämvikt. Ångans partiella tryck vid jämvikt kallas vätskans ångtryck.
figur 10.7 jämvikt

vid någon tidpunkt kommer antalet partiklar som kommer in i ångfasen att balanseras av antalet partiklar som återvänder till vätskan. Denna punkt kallas jämvikt.
förstå att vätskan inte har slutat avdunsta. Den omvända processen-kondensation-sker så snabbt som avdunstning är, så det finns ingen nettoförändring i mängden ånga i systemet. Termen dynamisk jämvikt representerar en situation där en process fortfarande inträffar, men den motsatta processen sker också i samma takt så att det inte sker någon nettoförändring i systemet.
ångtrycket för ett ämne är beroende av ämnets temperatur; när temperaturen ökar ökar också ångtrycket. Figur 10.8 ”tomter av ångtryck kontra temperatur för flera vätskor” är en plot av ångtryck kontra temperatur för flera vätskor. Efter att ha definierat ångtrycket kan vi också omdefiniera kokpunkten för en vätska: temperaturen vid vilken ångtrycket i en vätska är lika med det omgivande miljötrycket. Det normala ångtrycket är då den temperatur vid vilken ångtrycket är 760 torr, eller exakt 1 atm. Således varierar kokpunkterna med omgivande tryck, ett faktum som kan ha stora konsekvenser för att laga mat vid lägre eller högre än normala höjder. Atmosfärstrycket varierar avsevärt med höjden.
figur 10.8 tomter av ångtryck kontra temperatur för flera vätskor
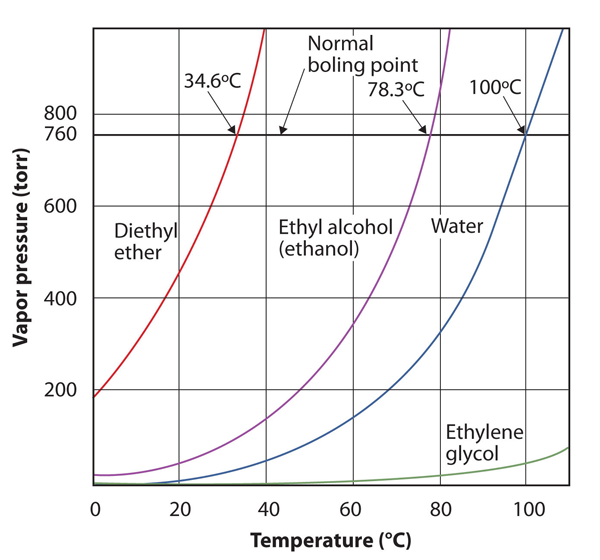
ångtrycket av en vätska beror på vätskans identitet och temperaturen, som denna plot visar.
exempel 4
använd figur 10.8″ tomter av ångtryck kontra temperatur för flera vätskor ” för att uppskatta kokpunkten för vatten vid 500 torr, vilket är det ungefärliga atmosfärstrycket på toppen av Mount Everest.
lösning
se medföljande figur. Femhundra torr är mellan 400 och 600, så vi sträcker en linje från den punkten på y-axeln över till kurvan för vatten och släpper sedan ner den till x-axeln för att läsa den tillhörande temperaturen. Det ser ut som att punkten på vattenångtryckskurvan motsvarar en temperatur på ca 90 kg C, så vi drar slutsatsen att kokpunkten för vatten vid 500 torr är 90 kg C.
figur 10.9 med Figur 10.8 ”tomter av ångtryck kontra temperatur för flera vätskor”för att svara på Exempel 4
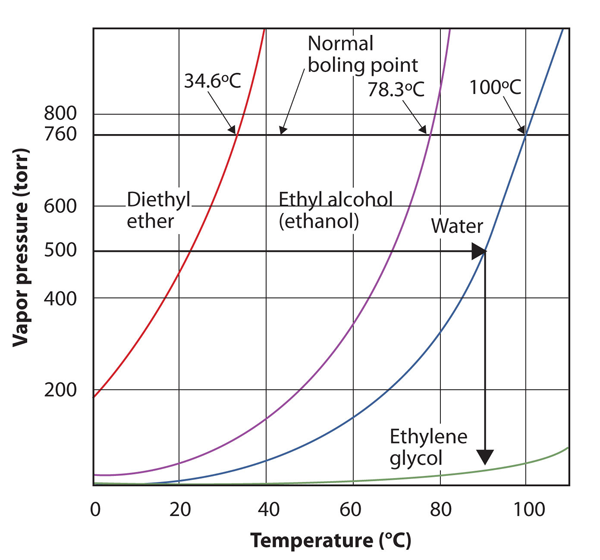
genom att läsa grafen ordentligt kan du uppskatta kokpunkten för en vätska vid olika temperaturer.
Testa dig själv
använd figur 10.8 ”tomter av ångtryck kontra temperatur för flera vätskor” för att uppskatta kokpunkten för etanol vid 400 torr.
svar
ca 65 kg c
ångtryckskurvan för vatten är inte exakt noll vid smältpunkten-0 kg C. Även IS har ett ångtryck; det är därför det sublimerar över tiden. Emellertid är ångtrycket för fasta ämnen vanligtvis mycket lägre än för vätskor. Vid -1 oc C är isens ångtryck 4,2 torr. Vid en frystemperatur på 0 kg f (-17 kg C) är isens ångtryck endast 1,0 torr; så kallade djupfrysare kan komma ner till -23 kg C, där isens ångtryck endast är 0,6 torr.
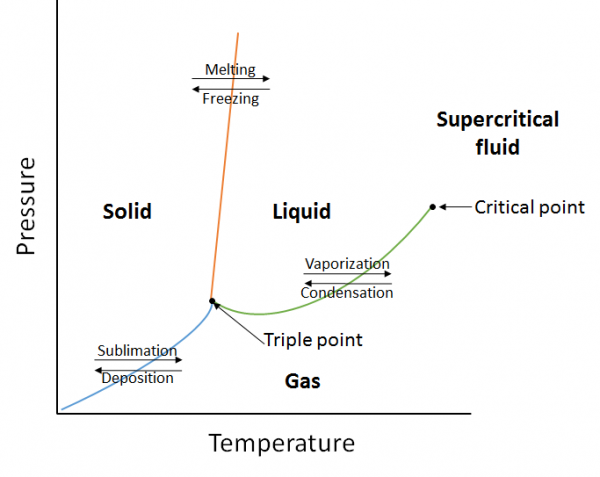
fasdiagram
ett fasdiagram är en grafisk representation av jämviktsförhållandena som finns mellan faserna av ett ämne under specificerade tryck och temperaturer (figur 10.10). Fasdiagrammet är en kombination av tre kurvor: ångtryckskurvan, smältkurvan och sublimeringskurvan. Vi har tidigare sett att ångtryckskurvor representerar jämvikten mellan vätske-och gasfasen, och den punkt vid vilken trycket är lika med 1 atm är den normala kokpunkten. En ytterligare egenskap hos denna kurva i fasdiagrammet (grönt) är att det slutar vid den kritiska punkten. Den kritiska punkten är punkten vid högsta temperatur och tryck vid vilket vätskor och gaser förblir urskiljbara. Vid temperaturer och tryck bortom denna punkt finns materien i en fas med egenskaper hos både vätskor och gaser som kallas en superkritisk vätska.
smältkurvan (orange) representerar jämvikten mellan fast och flytande, och den punkt vid vilken trycket är lika med 1 atm är den normala smältpunkten. Sublimeringskurvan (blå) representerar jämvikten som finns mellan fast och gas. Slutligen är punkten där alla tre kurvorna möts känd som trippelpunkten. Vid denna tidpunkt finns tre faser (fast, flytande och gas) alla vid jämvikt.
exempel:
med hjälp av följande fasdiagram bestämmer du vad som skulle hända om:
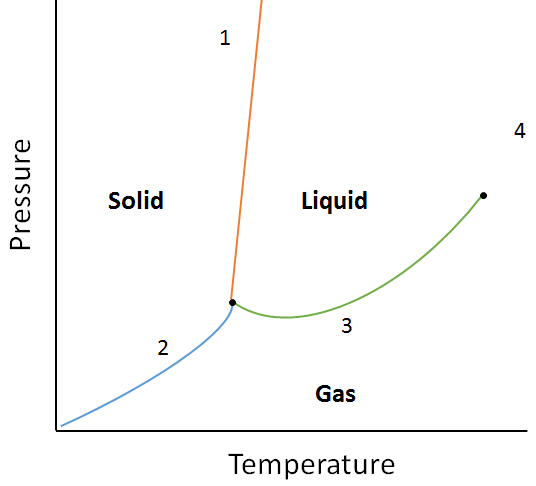
a. temperaturen ökas för materia vid punkt 1.
b. trycket ökas för materia vid punkt 3.
lösning:
A. materia vid punkt 1 smälter (förändringsfas från fast till flytande) om temperaturen ökas.
b. Materia vid punkt 3 kommer att kondensera (ändra fas från gas till vätska) om temperaturen höjs.
ytspänning och kapillärverkan
alla vätskor delar också några andra egenskaper. Ytspänning är en effekt som orsakas av en obalans av krafter på atomerna vid ytan av en vätska, som visas i Figur 10.11 ”Ytspänning”. Den blå partikeln i huvuddelen av vätskan upplever intermolekylära krafter från hela världen, vilket illustreras av pilarna. Den gula partikeln på ytan upplever emellertid inga krafter ovanför den eftersom det inte finns några partiklar ovanför den. Detta leder till en obalans av krafter som vi kallar ytspänning.
figur 10.11 Ytspänning

ytspänning kommer från det faktum att partiklar vid ytan av en vätska inte upplever interaktioner från alla håll, vilket leder till en obalans av krafter på ytan.
figur 10.12 effekter av ytspänning

Källa:” wet apple ” av cristian ruberti är licensierat under Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic.