inledande Kemi-1: A kanadensiska upplagan
inlärningsmål
- definiera buffert.
- identifiera de två komponenterna i en buffert korrekt.
som anges i avsnitt 12.4 ”starka och svaga syror och baser och deras salter” är svaga syror relativt vanliga, även i de livsmedel vi äter. Men vi stöter ibland på en stark syra eller bas, såsom magsyra, som har ett starkt surt pH på 1,7. Per definition kan starka syror och baser producera en relativt stor mängd H + eller OH-joner och har följaktligen markerade kemiska aktiviteter. Dessutom kan mycket små mängder starka syror och baser ändra pH i en lösning mycket snabbt. Om 1 mL magsyra tillsattes till blodomloppet och ingen korrigeringsmekanism var närvarande, skulle blodets pH minska från cirka 7,4 till cirka 4,7—ett pH som inte bidrar till fortsatt levande. Lyckligtvis har kroppen en mekanism för att minimera sådana dramatiska pH-förändringar.
mekanismen innefattar en buffert, en lösning som motstår dramatiska förändringar i pH. buffertar gör det genom att bestå av vissa par lösta ämnen: antingen en svag syra plus ett salt som härrör från den svaga syran eller en svag bas plus ett salt av den svaga basen. Till exempel kan en buffert bestå av upplöst HC2H3O2 (en svag syra) och NaC2H3O2 (saltet härrörande från den svaga syran). Ett annat exempel på en buffert är en lösning innehållande NH3 (en svag bas) och NH4Cl (ett salt som härrör från den svaga basen).
Låt oss använda en HC2H3O2 / nac2h3o2 buffert för att visa hur buffertar fungerar. Om en stark bas—en källa till OH−(aq) joner—läggs till buffertlösningen, kommer dessa OH− joner att reagera med HC2H3O2 i en syra-basreaktion:
HC2H3O2(aq) + OH−(aq) 2o(c2h3o2−(aq)
snarare än att ändra pH dramatiskt genom att göra lösningen grundläggande, reagerar de tillsatta OH− jonerna för att göra H2O, så pH förändras inte mycket.
om en stark syra—en källa till H+—joner-läggs till buffertlösningen, kommer H+ – jonerna att reagera med anjonen från saltet. Eftersom HC2H3O2 är en svag syra joniseras den inte mycket. Detta innebär att om massor av H+− joner och C2H3O2−joner är närvarande i samma lösning, kommer de att samlas för att göra HC2H3O2:
H+(aq) + C2H3O2 – (aq) bisexuell HC2H3O2(aq)
snarare än att ändra pH dramatiskt och göra lösningen sur, reagerar de tillsatta H+ – jonerna för att göra molekyler av en svag syra. Figur 12.2″ buffertens åtgärder ” illustrerar båda åtgärderna i en buffert.
figur 12.2 buffertens åtgärder
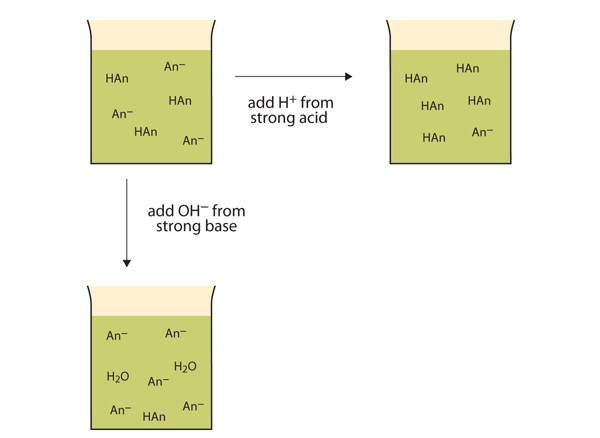
buffertar kan reagera med både starka syror (topp) och starka baser (sida) för att minimera stora förändringar i pH.
buffertar gjorda av svaga baser och salter av svaga baser verkar på liknande sätt. Till exempel, i en buffert som innehåller NH3 och NH4Cl, kan NH3− molekyler reagera med eventuella överskott av H+−joner som införs av starka syror:
NH3(aq) + H+(aq) ACC NH4+(aq) medan NH4+(aq) Jonen kan reagera med alla OH-joner som införs av starka baser:
NH4+(aq) + OH – (aq) ACC NH3(aq) + H2o(0)
exempel 15
vilka kombinationer av föreningar kan göra en buffertlösning?
- HCHO2 och NaCHO2
- HCl och NaCl
- CH3NH2 och CH3NH3Cl
- NH3 och NaOH
lösning
- HCHO2 är myrsyra, en svag syra, medan NaCHO2 är saltet tillverkat av anjonen av den svaga syran (formatjonen ). Kombinationen av dessa två lösta ämnen skulle göra en buffertlösning.
- HCl är en stark syra, inte en svag syra, så kombinationen av dessa två lösta ämnen skulle inte göra en buffertlösning.
- CH3NH2 är metylamin, som är som NH3 med en av dess H-atomer substituerad med en CH3-grupp. Eftersom det inte anges i tabell 12.2 ”Starka syror och baser”, vi kan anta att det är en svag bas. Föreningen CH3NH3Cl är ett salt tillverkat av den svaga basen, så kombinationen av dessa två lösta ämnen skulle göra en buffertlösning.
- NH3 är en svag bas, men NaOH är en stark bas. Kombinationen av dessa två lösta ämnen skulle inte göra en buffertlösning.
Testa dig själv
vilka kombinationer av föreningar kan göra en buffertlösning?
- NaHCO3 och NaCl
- H3PO4 och NaH2PO4
- NH3 och (NH4)3PO4
- NaOH och NaCl
svar
- nej
- ja
- ja
- nej
buffertar fungerar bra endast för begränsade mängder tillsatt stark syra eller bas. När endera lösta ämnet är fullständigt reagerat, är lösningen inte längre en buffert, och snabba förändringar i pH kan inträffa. Vi säger att en buffert har en viss kapacitet. Buffertar som har mer löst ämne upplöst i dem till att börja med har större kapacitet, vilket kan förväntas.
humant blod har ett buffertsystem för att minimera extrema förändringar i pH. en buffert i blod är baserad på närvaron av HCO3− och H2CO3 . Med denna buffert närvarande, även om någon magsyra skulle hitta sin väg direkt in i blodomloppet, skulle förändringen i blodets pH vara minimal. Inuti många av kroppens celler finns ett buffertsystem baserat på fosfatjoner.
mat och dryck App: Syran som lindrar smärta
även om läkemedel inte är exakt” mat och dryck”, tar vi dem, så låt oss ta en titt på en syra som förmodligen är den vanligaste medicinen: acetylsalicylsyra, även känd som aspirin. Aspirin är välkänt som smärtstillande och antipyretisk (feberreducerare).
strukturen av aspirin visas i den medföljande figuren. Syradelen är inringad; det är H-atomen i den delen som kan doneras som aspirin fungerar som en br-Uclunsted-Lowry-syra. Eftersom det inte anges i tabell 12.2 ”starka syror och baser” är acetylsalicylsyra en svag syra. Det är dock fortfarande en syra, och med tanke på att vissa människor konsumerar relativt stora mängder aspirin dagligen kan dess sura natur orsaka problem i magslemhinnan, trots magens försvar mot sin egen magsyra.
figur 12.3 molekylstrukturen för Aspirin
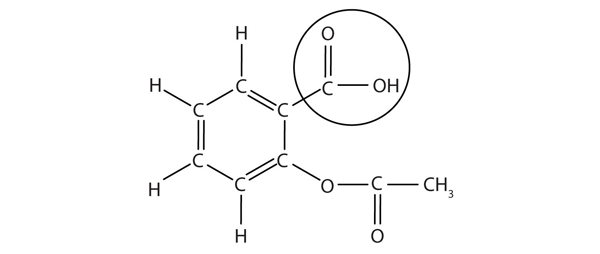
de cirklade atomerna är den sura delen av molekylen.
eftersom syraegenskaperna hos aspirin kan vara problematiska, erbjuder många aspirinmärken en” buffrad aspirin ” – form av läkemedlet. I dessa fall innehåller aspirinet också ett buffertmedel-vanligtvis MgO-som reglerar aspirinets surhet för att minimera dess sura biverkningar.
lika användbart och vanligt som aspirin är, marknadsfördes det formellt som ett läkemedel som började 1899. US Food and Drug Administration (FDA), den statliga myndigheten som ansvarar för att övervaka och godkänna droger i USA, bildades inte förrän 1906. Vissa har hävdat att om FDA hade bildats innan aspirin infördes, kan aspirin aldrig ha fått godkännande på grund av dess potential för biverkningar—gastrointestinal blödning, ringning i öronen, Reyes syndrom (ett leverproblem) och vissa allergiska reaktioner. Men nyligen aspirin har tippad för dess effekter i att minska hjärtinfarkt och stroke, så det är troligt att aspirin är här för att stanna.
Key Takeaways
- en buffert är en lösning som motstår plötsliga förändringar i pH.
övningar
-
definiera buffert. Vilka två relaterade kemiska komponenter krävs för att göra en buffert?
-
kan en buffert göras genom att kombinera en stark syra med en stark bas? Varför eller varför inte?
-
vilka kombinationer av föreningar kan göra en buffert? Antag vattenhaltiga lösningar.
a) HCl och NaCl
b) HNO2 och NaNO2
c) NH4NO3 och HNO3
d) NH4NO3 och NH3
4. Vilka kombinationer av föreningar kan göra en buffert? Antag vattenhaltiga lösningar.
a) H3PO4 och Na3PO4
b) NaHCO3 och Na2CO3
c)NaNO3 och Ca(NO3) 2
d) HN3 och NH3
5. För varje kombination i övning 3 som är en buffert, skriv de kemiska ekvationerna för reaktionerna hos buffertkomponenterna när en stark syra och en stark bas tillsätts.
6. För varje kombination i övning 4 som är en buffert, skriv de kemiska ekvationerna för reaktionerna hos buffertkomponenterna när en stark syra och en stark bas tillsätts.
7. Det kompletta fosfatbuffertsystemet är baserat på fyra ämnen: H3PO4, H2PO4 -, HPO42−och PO43 -. Vilka olika buffertlösningar kan göras av dessa ämnen?
8. Förklara varför NaBr inte kan vara en komponent i antingen en sur eller en basisk buffert.
9. Två lösningar tillverkas innehållande samma koncentrationer av lösta ämnen. En lösning består av H3PO4 och Na3PO4, medan den andra består av HCN och NaCN. Vilken lösning ska ha större kapacitet som buffert?
10. Två lösningar tillverkas innehållande samma koncentrationer av lösta ämnen. En lösning består av NH3 och NH4NO3, medan den andra består av H2SO4 och Na2SO4. Vilken lösning ska ha större kapacitet som buffert?
svar
en buffert är kombinationen av en svag syra eller bas och ett salt av den svaga syran eller basen.
a) nej
b) ja
c) nej
d) ja
3b: stark syra: NO2− + H+ kg HNO2; stark bas: HNO2 + OH− kg NO2− + H2O; 3D: stark bas: NH4+ + OH− kg NH3 + H2O; stark syra: NH3 + h+ kg NH4+7.
buffertar kan tillverkas av tre kombinationer: (1) H3PO4 och H2PO4−, (2) H2PO4− och HPO42−, och (3) HPO42− och PO43−. (Tekniskt sett kan en buffert göras från vilka två komponenter som helst.)
fosfatbufferten bör ha större kapacitet.