Mupirocin Cream
Generiskt Namn: mupirocin calcium
doseringsform: cream
medicinskt granskad av Drugs.com. Senast uppdaterad den 1 Jan 2021.
- översikt
- biverkningar
- dosering
- Professional
- graviditet
- mer
indikationer och användning för mupirocin Cream
Mupirocin Cream USP, 2% är indicerat för behandling av sekundärt infekterade traumatiska hudskador (upp till 10 cm i längd eller 100 cm2 i området) på grund av mottagliga isolat av Staphylococcus aureus (S. aureus) och Streptococcus pyogenes (S. pyogenes).
Mupirocin Cream dosering och administrering
- endast för lokal användning.
- applicera en liten mängd Mupirocinkräm, med en bomullspinne eller gasväska, till det drabbade området 3 gånger dagligen i 10 dagar.
- täck det behandlade området med gasbindning om så önskas.
- omvärdera patienter som inte visar ett kliniskt svar inom 3 till 5 dagar.
- Mupirocin Cream är inte för intranasal, oftalmisk eller annan mukosal användning .
- Applicera inte mupirocin-kräm samtidigt med andra lotioner, krämer eller salvor .
doseringsformer och styrkor
Mupirocin Cream USP, 2% är en vit kräm som innehåller 20 mg (2% w/w) mupirocin per gram i en olje – och vattenbaserad emulsion, levererad i 15 gram och 30 gram rör.
kontraindikationer
mupirocin Cream är kontraindicerat hos patienter med känd överkänslighet mot mupirocin eller något hjälpämne i Mupirocin Cream.
varningar och försiktighet
allvarliga allergiska reaktioner
systemiska allergiska reaktioner, inklusive anafylaxi, urtikaria, angioödem och generaliserade utslag, har rapporterats hos patienter som behandlats med formuleringar av mupirocin, inklusive Mupirocinkräm .
ögonirritation
Undvik kontakt med ögonen. Vid oavsiktlig kontakt, skölj väl med vatten.
lokal Irritation
vid sensibilisering eller allvarlig lokal irritation från Mupirocinkräm ska användningen avbrytas och lämplig alternativ behandling för infektionen inledas.
Clostridium difficile-associerad diarre
Clostridium difficile-associerad diarre (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel och kan variera i svårighetsgrad från mild diarre till dödlig kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen som leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och dödlighet, eftersom dessa infektioner kan vara eldfasta mot antimikrobiell behandling och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som uppvisar diarre efter användning av antibakteriella läkemedel. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa över 2 månader efter administrering av antibakteriella medel.
om CDAD misstänks eller bekräftas kan pågående antibakteriell läkemedelsanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske-och elektrolythantering, proteintillskott, antibakteriell behandling av C. difficile och kirurgisk utvärdering bör inledas enligt klinisk indikation.
potential för mikrobiell överväxt
som med andra antibakteriella produkter kan långvarig användning av Mupirocinkräm leda till överväxt av icke-mottagliga mikroorganismer, inklusive svampar .
Risk förknippad med mukosal användning
mupirocin Cream är inte formulerad för användning på mukosala ytor. En separat formulering, mupirocin calcium nasal salva, är tillgänglig för intranasal användning.
biverkningar
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- allvarliga allergiska reaktioner
- ögonirritation
- lokal Irritation
- Clostridium difficile-associerad diarre
kliniska prövningar erfarenhet
eftersom kliniska prövningar utförs under mycket varierande förhållanden observerades biverkningar i de kliniska prövningarna av en läkemedel kan inte direkt jämföras med priser i de kliniska prövningarna av ett annat läkemedel och kanske inte återspeglar de priser som observerats i praktiken.
i 2 randomiserade, dubbelblinda, dubbelblinda studier behandlades 339 försökspersoner med topisk Mupirocinkräm plus oral placebo. Biverkningar förekom hos 28 (8, 3%) patienter. Följande biverkningar rapporterades av minst 1% av patienterna i samband med användning av Mupirocinkräm i kliniska prövningar: huvudvärk (1, 7%), utslag (1, 1%) och illamående (1, 1%).
andra biverkningar som inträffade hos mindre än 1% av patienterna var: buksmärta, brännande känsla på applikationsstället, cellulit, dermatit, yrsel, klåda, sekundär sårinfektion och ulcerös stomatit.
i en stödjande studie vid behandling av sekundärt infekterat eksem behandlades 82 personer med Mupirocinkräm. Förekomsten av biverkningar var följande: illamående (4, 9%), huvudvärk och brännande på applikationsstället (3, 6% vardera), klåda (2, 4%) och 1 rapporterar var och en av buksmärta, blödning sekundär till eksem, smärta sekundär till eksem, nässelfeber, torr hud och utslag.
erfarenhet efter marknadsföring
förutom biverkningar som rapporterats från kliniska prövningar har följande reaktioner identifierats vid användning efter marknadsföring av Mupirocinkräm. Eftersom de rapporteras frivilligt från en population av okänd storlek, uppskattningar av frekvens kan inte göras. Dessa reaktioner har valts för inkludering på grund av en kombination av deras allvarlighetsgrad, rapporteringsfrekvens eller potentiellt orsakssamband med Mupirocinkräm.
immunsystemet
systemiska allergiska reaktioner, inklusive anafylaxi, urtikaria, angioödem och generaliserat utslag .
användning i specifika populationer
graviditet
Risköversikt
det finns otillräckliga humandata för att fastställa om det finns en läkemedelsassocierad risk med Mupirocinkräm hos gravida kvinnor. Systemisk absorption av mupirocin genom intakt human hud är minimal efter topisk administrering av Mupirocinkräm . Ingen utvecklingstoxicitet observerades hos råttor eller kaniner som behandlades med mupirocin subkutant under organogenes i doser på 160 respektive 40 mg per kg per dag (22 respektive 11 gånger den humana topiska dosen baserat på dosberäkningar dividerat med hela kroppsytan).
den uppskattade bakgrundsrisken för större fosterskador och missfall för den angivna populationen är okänd. Den uppskattade bakgrundsrisken i USA: s allmänna befolkning av större fosterskador är 2% till 4% och missfall är 15% till 20% av kliniskt erkända graviditeter.
Data
djurdata: Utvecklingstoxicitetsstudier har utförts med mupirocin administrerat subkutant till råttor och kaniner i doser upp till 160 mg per kg per dag under organogenes. Denna dos är 22 respektive 43 gånger den humana topiska dosen (cirka 60 mg mupirocin per dag) baserat på dosberäkningar dividerat med hela kroppsytan. Maternell toxicitet observerades (viktminskning/minskad viktökning och minskad utfodring) hos båda arterna utan tecken på utvecklingstoxicitet hos råttor. Hos kaniner utesluter överdriven maternell toxicitet vid den höga dosen utvärderingen av fostrets resultat. Det fanns ingen utvecklingstoxicitet hos kaniner vid 40 mg per kg per dag, 11 gånger den humana topiska dosen baserat på dosberäkningar dividerat med hela kroppsytan.
mupirocin administrerat subkutant till råttor i en pre-och postnatal utvecklingsstudie (doserad under sen dräktighet genom laktation) var associerad med minskad avkommans livskraft i den tidiga postnatala perioden i en dos av 106.7 mg per kg, i närvaro av irritation på injektionsstället och/eller subkutan blödning. Denna dos är 14 gånger den humana topiska dosen baserat på dosberäkningar dividerat med hela kroppsytan. Den icke observerade biverkningsnivån i denna studie var 44,2 mg per kg per dag, vilket är 6 gånger den humana topiska dosen.
amning
Risköversikt
det är inte känt om mupirocin förekommer i bröstmjölk, har effekter på det ammade barnet eller har effekter på mjölkproduktionen. Amning förväntas dock inte leda till exponering av barnet för läkemedlet på grund av minimal systemisk absorption av mupirocin hos människor efter topisk administrering av Mupirocinkräm . Utvecklings-och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av Mupirocinkräm och eventuella negativa effekter på det ammade barnet från Mupirocinkräm eller från det underliggande moderns tillstånd.
kliniska överväganden
för att minimera oral exponering av läkemedlet för barn, bör ett bröst och/eller bröstvårta som behandlas med Mupirocinkräm tvättas noggrant före amning.
pediatrisk användning
mupirocinkrämens säkerhet och effektivitet har fastställts i åldersgrupperna 3 månader till 16 år. Användning av Mupirocinkräm i dessa åldersgrupper stöds av bevis från adekvata och välkontrollerade studier av Mupirocinkräm hos vuxna med ytterligare data från 93 pediatriska patienter som studerats som en del av de pivotala studierna på vuxna .
geriatrisk användning
i 2 adekvata och välkontrollerade studier behandlades 30 patienter äldre än 65 år med Mupirocinkräm. Ingen Total skillnad i effekt eller säkerhet för Mupirocinkräm observerades i denna patientpopulation jämfört med den som observerades hos yngre patienter.
mupirocin Cream beskrivning
Mupirocin Cream USP, 2% innehåller dihydratkristallint kalciumhemi-salt av RNA-syntetashämmaren antibakteriell, mupirocin. Kemiskt är det (aE,2s, 3R, 4R, 5S)-5-tetrahydro-3,4-dihydroxi-sackari-metyl-2H-pyran-2-krotonsyra, ester med 9-hydroxynonansyra, kalciumsalt (2:1), dihydrat.
molekylformeln för mupirocinkalcium är (C26H43O9) 2CA 2H2O och molekylvikten är 1075,3. Molekylvikten för mupirocinfri syra är 500,6. Strukturformeln för mupirocinkalcium är:
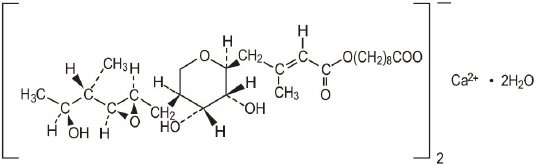
varje gram Mupirocinkräm innehåller 20 mg (2% vikt/vikt) mupirocin motsvarande 21, 5 mg (2, 15% vikt/vikt) mupirocinkalcium. The inactive ingredients are benzyl alcohol, cetomacrogol 1000, cetyl alcohol, mineral oil, phenoxyethanol, purified water, stearyl alcohol, and xanthan gum.
Mupirocin Cream – Clinical Pharmacology
Mechanism of Action
Mupirocin is an RNA synthetase inhibitor antibacterial .
Pharmacokinetics
Absorption
Systemic absorption of mupirocin through intact human skin is minimal. Den systemiska absorptionen av mupirocin studerades efter applicering av Mupirocinkräm 3 gånger dagligen i 5 dagar på olika hudskador som är större än 10 cm långa eller 100 cm2 i området hos 16 vuxna (i åldern 29 till 60 år) och 10 barn (i åldern 3 till 12 år). Viss systemisk absorption observerades, vilket framgår av detekteringen av metaboliten, moninsyra, i urinen. Data från denna studie indikerade mer frekvent förekomst av perkutan absorption hos barn (90% av patienterna) jämfört med vuxna (44% av patienterna); de observerade urinkoncentrationerna hos barn (0, 07 till 1.3 mcg per mL) ligger inom det observerade intervallet (0, 08 till 10, 03 mcg per mL ) i den vuxna populationen. I allmänhet verkar graden av perkutan absorption efter upprepad dosering vara minimal hos vuxna och barn.
effekten av samtidig applicering av Mupirocinkräm med andra topiska produkter har inte studerats .
eliminering
i en studie utförd på 7 friska vuxna manliga försökspersoner var eliminationshalveringstiden efter intravenös administrering av mupirocin 20 till 40 minuter för mupirocin och 30 till 80 minuter för moninsyra.
Metabolism: Efter intravenös eller oral administrering metaboliseras mupirocin snabbt. Huvudmetaboliten, moninsyra, uppvisar ingen antibakteriell aktivitet.
utsöndring: Moninsyra elimineras huvudsakligen genom renal utsöndring.
mikrobiologi
Mupirocin är en RNA-syntetashämmare antibakteriell producerad genom jäsning med hjälp av organismen Pseudomonas fluorescens.
verkningsmekanism
Mupirocin hämmar bakteriell proteinsyntes genom reversibelt och specifikt bindning till bakteriellt isoleucyl-transfer RNA (tRNA) – syntetas.
Mupirocin är bakteriedödande vid koncentrationer som uppnås genom topisk administrering. Mupirocin är starkt proteinbundet (mer än 97%) och effekten av sårutsöndringar på de minsta hämmande koncentrationerna (Mic) av mupirocin har inte fastställts.
resistans
När mupirocinresistens uppstår beror det på produktion av ett modifierat isoleucyl-tRNA-syntetas eller förvärv av, genom genetisk överföring, en plasmid som medierar ett nytt isoleucyl-tRNA-syntetas. Högnivåplasmidmedierad resistens (mic 212 mcg/ml) har rapporterats i ökande antal isolat av S. aureus och med högre frekvens i koagulasnegativa stafylokocker. Mupirocinresistens uppträder med större frekvens i meticillinresistenta än meticillinkänsliga stafylokocker.
korsresistens
på grund av dess verkningssätt visar mupirocin inte korsresistens med andra klasser av antimikrobiella medel.
antimikrobiell aktivitet
Mupirocin har visats vara aktivt mot känsliga isolat av S. aureus och S. pyogenes, både in vitro och i kliniska prövningar . Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Mupirocin är aktivt mot de flesta isolat av Staphylococcus epidermidis.
Känslighetstestmetoder
mupirocinresistens på hög nivå (512 mcg / ml) kan bestämmas med standarddiffusion eller buljongmikrodilutionstest.1,2 på grund av förekomsten av mupirocinresistens i meticillinresistent S. aureus (MRSA), det är lämpligt att testa MRSA-populationer för mupirocinkänslighet före användning av mupirocin med en standardiserad metod.3,4,5
icke-klinisk toxikologi
karcinogenes, mutagenes, nedsatt fertilitet
långtidsstudier på djur för att utvärdera karcinogenicitet av mupirocinkalcium har inte utförts.
resultat från följande studier utförda med mupirocinkalcium eller mupirocinnatrium in vitro och in vivo indikerade inte någon potential för Genotoxicitet: råtta primär hepatocyt oschemalagd DNA-syntes, sedimentanalys för DNA-strängbrott, Salmonellareversionstest (Ames), Escherichia coli-mutationsanalys, metafasanalys av humana lymfocyter, muslymfomanalys och benmärgsmikrokärnanalys hos möss.
i en fertilitets – / reproduktionsstudie (med dosering genom laktation) gav mupirocin subkutant till han-och honråttor i doser upp till 100 mg per kg per dag, vilket är 14 gånger den humana topiska dosen (cirka 60 mg mupirocin per dag) baserat på beräkningar av dosen dividerat med hela kroppsytan, inte nedsatt fertilitet eller nedsatt reproduktionsförmåga som kan hänföras till mupirocin.
kliniska studier
effekten av topisk Mupirocinkräm för behandling av sekundärt infekterade traumatiska hudskador (t. ex. sår och skrubbsår inte mer än 10 cm i längd eller 100 cm2 i total yta) jämfördes med den för oral cephalexin i 2 randomiserade, dubbelblinda, dubbelblinda kliniska prövningar. Klinisk effekt vid uppföljning i Per-protokollpopulationerna (vuxna och pediatriska patienter inkluderade) var 96,1% för Mupirocinkräm (n = 231) och 93,1% för oral cefalexin (n = 219). Patogenutrotningsgraden vid uppföljning i Per-protokollpopulationerna var 100% för både Mupirocinkräm och oral cephalexin.
Pediatrik
det var 93 pediatriska patienter i åldern 2 veckor till 16 år inskrivna per protokoll i sekundärt infekterade hudlesionsstudier, även om endast 3 var yngre än 2 år i populationen som behandlades med Mupirocinkräm. Försökspersonerna randomiserades till antingen 10 dagars topisk Mupirocinkräm 3 gånger dagligen eller 10 dagars oral cefalexin (250 mg 4 gånger dagligen för försökspersoner större än 40 kg eller 25 mg per kg per dag oral suspension i 4 uppdelade doser för försökspersoner mindre än eller lika med 40 kg). Klinisk effekt vid uppföljning (7 till 12 dagar efter behandling) i Per-protokollpopulationerna var 97, 7% (43 av 44) för Mupirocinkräm och 93, 9% (46 av 49) för cefalexin.
- Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiell Känslighetstestning; tjugosjätte informationstillägg. CLSI dokument M100-S26. Kliniska och laboratorie Standards Institute, 950 West Valley Rd., Svit 2500, Wayne, PA 19087, USA, 2016.
- Patel J, Gorwitz RJ, et al. Mupirocinresistens. Kliniska Infektionssjukdomar. 2009; 49(6):935-41.
- kliniska och laboratorie Standards Institute (CLSI). Metoder för utspädning antimikrobiella Känslighetstester för bakterier som växer aerobt; godkänd Standard-tionde upplagan. CLSI dokument M07-A10. Clinical and Laboratory Standards Institute, 950 West Valley Road, Svit 2500, Wayne, Pennsylvania 19087, USA, 2015.
- kliniska och laboratorie Standards Institute (CLSI). Prestandastandarder för antimikrobiella Diskdiffusionskänslighetstester; godkänd Standard-tolfte upplagan. CLSI-dokument M02-A12. Clinical and Laboratory Standards Institute, 950 West Valley Road, Svit 2500, Wayne, Pennsylvania 19087, USA, 2015.
- Finlay JE, Miller LA, Poupard JA. Tolkningskriterier för testning av stafylokockers mottaglighet för mupirocin. Antimicrob Medel Chemother 1997; 41 (5):1137-1139.
hur levereras / förvaras och hanteras
Mupirocin Cream är en vit kräm som innehåller 20 mg (2 viktprocent) mupirocin per gram i en oljebaserad emulsion.
Mupirocin Cream USP, 2% levereras i 15 gram (NDC 16714-055-01) och 30 gram (NDC 16714-055-02) rör.
Förvara vid 20 till 25 till C (68 till 77 till f) . Får ej frysas.
Patientrådgivningsinformation
råda patienten att läsa FDA-godkänd patientmärkning (patientinformation).
råda patienten att administrera Mupirocinkräm enligt följande:
- Använd endast Mupirocinkräm enligt anvisningar från vårdgivaren. Det är endast för extern användning. Undvik kontakt med Mupirocin-kräm med ögonen. Om mupirocin-kräm kommer i ögonen, skölj noggrant med vatten.
- Använd inte Mupirocinkräm i näsan.
- tvätta händerna före och efter applicering av Mupirocin-kräm.
- använd en gasväska eller bomullspinne för att applicera en liten mängd Mupirocinkräm på det drabbade området. Det behandlade området kan täckas av gasbindning om så önskas.
- rapportera till vårdgivaren eventuella tecken på lokala biverkningar. Mupirocin-kräm ska stoppas och vårdgivaren kontaktas om irritation, svår klåda eller utslag uppstår.
- rapportera till vårdgivaren eller gå till närmaste akutmottagning om allvarliga allergiska reaktioner, såsom svullnad i läppar, ansikte eller tunga eller väsande andning uppstår .
- Om ingen förbättring ses på 3 till 5 dagar, kontakta vårdgivaren.
tillverkad för: Northstar RxLLC
Memphis,TN 38141.
Tillverkad av: Taro Pharmaceuticals Inc.
Brampton, Ontario, Kanada L6T 1C1.
utfärdat: November 2020
5214500
54
| denna patientinformation har godkänts av US Food and Drug Administration. utfärdat: November 2020 5214500 54 |
||
| patientinformation MUPIROCIN (mue pir ’ Oh sin) kräm, för topisk användning |
||
| vad är mupirocin cream?Mupirocin Cream är ett receptbelagt läkemedel som används på huden (lokal användning) för att behandla vissa hudinfektioner orsakade av bakterier som kallas Staphylococcus aureus och Streptococcus pyogenes. Det är inte känt om Mupirocin-kräm är säker och effektiv hos barn under 3 månader. | ||
| vem ska inte använda Mupirocin-kräm? Använd inte Mupirocin Cream om:
|
||
| Vad ska jag berätta för min vårdgivare innan du använder Mupirocin Cream? innan du använder Mupirocin Cream, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Blanda inte Mupirocinkräm med andra lotioner, krämer eller salvor. |
||
hur ska jag använda Mupirocin Cream?
|
||
| vilka är de möjliga biverkningarna av Mupirocin-kräm? Mupirocin kräm kan orsaka allvarliga biverkningar, inklusive:
|
||
|
|
|
de vanligaste biverkningarna av mupirocin-kräm inkluderar:
dessa är inte alla möjliga biverkningar av Mupirocin-kräm. Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088. |
||
hur ska jag förvara Mupirocin Cream?
|
||
| allmän information om säker och effektiv användning av mupirocin-kräm. läkemedel ordineras ibland för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte Mupirocinkräm för ett tillstånd för vilket det inte var föreskrivet. Ge inte mupirocin-kräm till andra människor, även om de har samma symtom som du har. Det kan skada dem. Du kan fråga din apotekspersonal eller vårdgivare om information om Mupirocin-kräm som är skriven för vårdpersonal. |
||
| vilka är ingredienserna i Mupirocin Cream? aktiv ingrediens: mupirocin kalcium Inaktiva Ingredienser: bensylalkohol, cetomacrogol 1000, cetylalkohol, mineralolja, fenoxietanol, renat vatten, stearylalkohol och xantangummi tillverkad för: Northstar RxLLC, Memphis, TN 38141. Manufactured by: Taro Pharmaceuticals Inc., Brampton, Ontario, Canada L6T 1C1. For more information, call 1-800-206-7821. |
||
PRINCIPAL DISPLAY PANEL – 30 g Tube Carton
NDC 16714-055-02
Rx only
Mupirocin Cream USP
2%
FOR DERMATOLOGIC USE ONLY.
NORTHSTARx®
30 g

| MUPIROCIN mupirocin calcium cream |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – NORTHSTAR RX LLC (830546433)
Vanliga frågor
- kan jag använda mupirocin salva för blötsutslag?
- kan mupirocin läka eller hjälpa till med eksem?
- kan mupirocin användas för idrottare fot?
- kan mupirocin cream användas för sängsår?
mer om mupirocin topisk
- biverkningar
- under graviditet eller amning
- doseringsinformation
- jämför alternativ
- stödgrupp
- prissättning & kuponger
- spanska
- 38 recensioner
- läkemedelsklass: aktuella antibiotika
konsumentresurser
- patientinformation
- Mupirocin Nasal (avancerad läsning)
- Mupirocin aktuell (avancerad läsning)
professionella resurser
- förskrivningsinformation
- Mupirocin (professionell patientrådgivning)
- Mupirocin (FDA)
andra märken Bactroban, Bactroban nasal, centany, centany at, pirnuo
relaterade behandlingsguider
- nasal transport av Staphylococcus aureus
- hud-och Strukturinfektion
- sekundära kutana bakterieinfektioner
- Impetigo
- Paronychia
Medicinsk ansvarsfriskrivning