ta en titt på de senaste artiklarna
Abstrakt
hjärtsvikt med låg effekt (LoHF) är en ovanlig form av hjärtsvikt (HF) men en som signalerar mycket avancerad HF. Det är förknippat med olycksbådande prognos samt betydande sjuklighet och dödlighet. LoHF förblir dock till stor del underforskad. Den traditionella beskrivningen av HF fokuserade på hjärtsvikt (CHF) markerad av låg hjärtutgång och åtföljd av lung – /perifer trängsel. Detta fokus bidrog till undervärdering av LoHF-patienter som har liten eller ingen bevis på trängsel. Dessutom har LoHF-patienter ingen bevisad Terapi och valet av lämplig behandling beror på individuell patofysiologi och underliggande etiologi. LoHF-patienter har heterogen etiologi och patofysiologi som belyser vikten av fördjupad förståelse för dess kliniska egenskaper, diagnos och klinisk hantering, som ligger till grund för denna granskning.
nyckelord
lågutgångshjärtsyndrom, hjärtsvikt med låg effekt, lågt utgångsläge
introduktion
trots anmärkningsvärda framsteg inom medicinska och kirurgiska terapier fortsätter effektiv hantering av hjärtsvikt (HF) att utgöra betydande utmaningar för vårdgivare. Utmaningen återspeglas av höga HF-relaterade sjukhusåtertagningar tillsammans med ökad dödlighet och sjuklighet . En del av utmaningen är mycket heterogen etiologi, patofysiologi och kliniska presentationer av olika former av HF, där vissa HF-former har brist på kliniska prövningsdata och följaktligen en begränsad förståelse. I synnerhet har den traditionella beskrivningen av HF varit nästan synonymt med hjärtsvikt (CHF) men termen CHF utesluter en minoritet av Hf-patienter som har små eller inga påvisbara symtom på lung-och/eller perifer trängsel . Low-output HF (LoHF) har också kopplats till en olycksbådande prognos och signalerar mycket avancerad HF. Dessutom stödjer symptomatiska och patofysiologiska skillnader i CHF och LoHF behovet av olika kliniska hanteringsmetoder . Trots dessa skillnader har traditionella HF-terapier generaliserats till alla former av HF inklusive CHF och LoHF, vilket skapar ett kliniskt behov av att förstå patofysiologi, diagnos och klinisk hantering av LoHF. I den här artikeln samlar vi publicerade bevis på LoHF när det gäller epidemiologi, etiologi, patofysiologi, diagnos och klinisk hantering. Avsikten är att modernisera kunskapen om lohfs kliniska status samt förbättra klinisk hantering av HF i allmänhet.
Definition
hjärtsvikt är ett komplext kliniskt syndrom som präglas av strukturella och/eller funktionella myokardiella defekter som leder till nedsatt ventrikulär fyllning eller utstötning . Komplexiteten hos syndromet är uppenbart i dess heterogena klassificeringar: höger -, vänster-eller bi-ventrikulär baserat på defektplats; akut eller kronisk baserat på starttid; bevarad, gränslinje eller reducerad ejektionsfraktion baserad på funktionell status; låg-eller hög-utgång baserad på hjärtminutvolym (CO), och framåt eller bakåt fel baserat på riktningen av blodflödet. Var och en av dessa klassificeringar är signifikant för diagnos och behandling av HF . Trots de flera klassificeringarna har termen CHF traditionellt använts omväxlande med HF men som inte tillräckligt beskriver LoHF på grund av flera symtomatiska och patofysiologiska skillnader.
LoHF, även känd som låg CO i akut dekompenserad HF, beskriver en högskärpa form av HF som kännetecknas av minskad framåt CO (hjärtindex < 2.0 L/min/m2 och systoliskt blodtryck < 90 mmHg) och end-organ hypoperfusion med liten eller ingen tecken på lungstockning . LoHF skiljer sig från CHF, som beskriver HF som kännetecknas av minskad CO som orsakar lung-och perifer trängsel som leder till andfåddhet respektive perifert ödem . 2005 European Society of Cardiology (ESC) riktlinjer för diagnos och hantering av HF föreslår ett kontinuum från lågt hjärtutgångssyndrom (LCOS) till LoHF till kardiogen chock. ESC-riktlinjerna definierar kardiogen chock som bevis på vävnadsperfusion inducerad av HF efter korrigering av förbelastning kännetecknad av systolisk BP < 90 mmHg eller en minskning av medelartärtrycket > 30 mmHg; urinproduktion < 0,5 ml/kg/h; pulsfrekvens > 60 slag per minut (BPM) med eller utan tecken på trängsel . LCOS å andra sidan är vanligt hos postoperativa HF-patienter och definieras som behovet av postoperativ intra-aorta ballongpump eller inotrop stöd i mer än 30 minuter i en akut vårdinställning .
epidemiologi
den exakta prevalensen och förekomsten av LoHF i den allmänna populationen är helt okänd. För närvarande finns det inga befolkningsbaserade epidemiologiska data specifika för LoHF. De enda tillgängliga uppgifterna är från kliniska studier med enstaka centrum som undersökte en utvald population av HF-patienter som har genomgått hjärtkirurgi. 1975, Parr et al. den kliniska enheten för LCOS och rapporterade en incidens på 25% hos barn som hade genomgått hjärtkirurgi baserat på minskad CO definierad som CI < 2,0 L/min/m2. Två decennier senare, Wernovsky et al. visade samma förekomst av postoperativ LCOS hos patienter som hade genomgått arteriell omkopplingsoperation som inträffade inom 6-18 timmar efter operationen. Mycket nya kliniska prövningar rapporterar en stor variation i prevalens, från 3.6% (män) och 5.9% (kvinnor) till 9.1% och till 41% och en förekomst av 14.7% . På senare tid (tjugo år: 1990-2009) prospektiv klinisk prövning med 25 176 på varandra följande patienter med kranskärlstransplantation (CABG), Algarni et al. rapporterade förekomsten av postoperativa LCOS minskade signifikant från 9,1% (1990-1994) till 2,4% (2005-2009).
etiologi
etiologin för LoHF är multifaktoriell. I allmänhet är det en följd av dysfunktion i vänster kammare (LV), höger kammare (RV) eller systemisk ventrikel (enkel ventrikel anatomi) och kan inkludera endera eller båda systolisk och/eller diastolisk dysfunktion . Störningar i ventrikulär fyllning eller utstötning leder till LoHF, vilket är en frekvent komplikation hos patienter som har genomgått hjärtkirurgi eller är i kardiogen chock . Det kan förekomma som en akut försämring hos patienter med kronisk HF eller det kan vara övergående och reversibel episod med upplösning av den akuta utlösaren. Det är ett kliniskt syndrom som anses vara den slutliga vägen för en mängd sjukdomar som påverkar hjärtfunktionen. Det räcker inte att ställa diagnos av LoHF, den bakomliggande orsaken eller utlösaren måste också bestämmas och om möjligt behandlas . Tabell 1 ger en sammanfattning av tillstånd som orsakar lågt utgångsläge hos HF-patienter.
tabell 1. Etiologi av lågutgångstillstånd genom patofysiologi
|
mekanismer |
orsakssamband |
|
kranskärlssjukdom, kardiomyopati, myokardit, dekompenserad kronisk HF, post-hjärtkirurgi, toxiner, näring (fetma)m infiltrativa sjukdomar, njursvikt i slutstadiet, Chagas sjukdom eller HIV-infektion |
|
|
perikardit, perikardiell effusion, hjärttamponad, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
den nuvarande förståelsen av patofysiologin för LoHF bygger till stor del på bevis från kliniska prövningar på postoperativa CABG-patienter . Det patologiska kännetecknet är alltför deprimerat CO åtföljt av hypoperfusion i slutorganet. Fysiologiskt fungerar hjärtat som en pump för att distribuera syresatt blod i tillräckliga mängder för att tillgodose metaboliska behov hos vävnader. Eftersom metaboliska behov varierar under normala och stressiga situationer varierar CO också för att tillgodose denna dynamiska efterfrågan . Den diastoliska fasen i hjärtcykeln är kritisk hos LoHF-patienter eftersom det är under ventrikulär avkoppling som koronarfyllning inträffar för att ge syresättning i hjärtmuskeln . Hjärtfrekvens (HR) är också signifikant i diastol eftersom för snabb HR förhindrar hjärtat från att uppnå fullständig myokardiell Avslappning och perfusion. Således är hjärtdysfunktion resultatet av strukturell (kvarvarande hjärtanomali) eller funktionell hjärtsjukdom (störningar i ventrikulär fyllning eller tömning eller ökad systemisk vaskulär resistans).
patofysiologiskt är CO beroende av HR och slagvolym (SV) (CO = HR * SV). Slagvolymen är i sin tur nettoprodukten av tre interrelaterade cirkulationsvariabler: förspänning, efterbelastning och kontraktilitet. Om en eller flera av dessa komponenter försämras kan ett tillstånd med låg hjärtutgång utvecklas . Dessutom påverkar dessa komponenter både systoliska och diastoliska faser i hjärtcykeln och orsakar systolisk dysfunktion i LV/RV och/eller diastolisk dysfunktion, även känd som HF med bevarad ejektionsfraktion (Figur 1). Andra tillstånd såsom valvulär hjärtsjukdom, lunghypertension (PH), mekanisk ventildysfunktion och andningsfel kan fälla ut eller förvärra utvecklingen av LoHF .
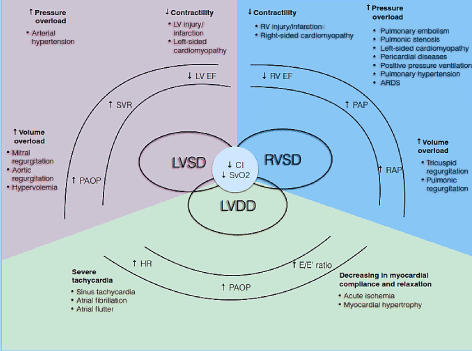
Figur 1. Patofysiologiska mekanismer för hjärtsvikt med låg effekt
vanliga orsaker och typiska; symtom på LoHF ingår. De viktigaste patofysiologiska mekanismerna för LoHF är ventrikulär dysfunktion: LV systolisk och / eller diastolisk dysfunktion och RV systolisk dysfunktion, som alla delar gemensamma patologiska egenskaper hos reducerat hjärtindex (CI) och minskad blandad venös syremättnad (SvO2). Systolisk dysfunktion i LV och RV är resultatet av ökad trycköverbelastning, ökad volymöverbelastning och minskad kontraktilitet medan diastolisk dysfunktion i LV är resultatet av svår takykardi och minskad myokardiell efterlevnad och avkoppling. Anpassad från Lomivorotov et al. 2017, p. 293
LV ystolisk dysfunktion
systolisk dysfunktion i vänster ventrikel (LV) (eller deprimerad lv-ejektionsfraktion ) är den vanligaste patofysiologiska mekanismen som ses hos LoHF-patienter. Cirkulationsvariabler som påverkar LV systolisk funktion är förspänning, efter belastning och kontraktilitet . I allmänhet är systolisk dysfunktion i LV en följd av förlust eller minskning av funktionella kardiomyocyter till följd av nekros på grund av nedsatt koronarcirkulation och ischemi, reperfusionsskada eller det mindre förstådda naturfenomenet kardiomyocytapoptos . Förlusten av funktionella kardiomyocyter kan vara övergående som ses under myokardiell bedövning definierad som ett livskraftigt myokardium som räddas av koronar reperfusion, som uppvisar långvarig post-ischemisk dysfunktion efter reperfusion . Förlusten av funktionell kardiomyocyt kan också vara eldfast mot reversering vid tillstånd som infektion; takykardi; valvulär sjukdom; metaboliska störningar såsom acidos, hypoglykemi, hypokalcemi; exponering för miljökarditoxiner och kemikalier; idiopatisk dilaterad kardiomyopati (DCM); och genetiska störningar som familjär DCM, hypertrofisk kardiomyopati och muskeldystrofier . Nedsatt hjärtrespons på förspänning orsakar en dramatisk minskning av CO-och syretillförsel till andra viktiga kroppsorgan, förhöjt förmakstryck, kapillär kiltryck och kardiogent lungödem. Även om kompensationsförändringar i LV anpassar sig till relativt högt systemiskt arteriellt tryck, kan signifikant ökning av efterbelastning inducera lv systolisk dysfunktion .
LV diastolisk dysfunktion
även om det är ovanligt kan LoHF utvecklas hos patienter med lv diastolisk dysfunktion med bevarad LVEF. Tillståndet är resultatet av oförmågan hos den ventrikulära kammaren att fylla med tillräcklig volym blod trots normal förspänning, som presenterar som diastolisk dysfunktion . Underliggande tillstånd såsom svår takykardi, minskad myokardiell överensstämmelse eller onormal ventrikulär avkoppling försämrar avslappningen och fyllningen av LV under diastolfasen i hjärtcykeln. På kardiomyocytnivå är dessa tillstånd associerade med kalciumavlägsnande från cytosolen och kalciumhomeostasen, tillräckligheten för korsbryggavlossning och inneboende funktionell cytoskeletal elementstörning . Cross-bridge detachment kan bidra till försenad isovolumisk avslappningstid, vilket resulterar i minskad lv-slagvolym, särskilt vid högre HR . Lv-avslappning beror också på sarkoplasmatisk retikulär kalciumjonupptagning och kväveoxidsignalering, vilket också underlättar avskiljning av broar. Eftersom processen med korsbryggavlossning är energikrävande kan det orsaka ett underskott i myokardiell energi och följaktligen sakta ner lv-myokardiell avkoppling .
trots att diastolisk dysfunktion är ett utbrett fenomen som ses hos upp till 70% av postoperativa hjärtpatienter , är diastolisk dysfunktion ensam otillräcklig för att förklara utvecklingen av akut HF. Vid inställning av andra kliniska tillstånd såsom förmaksflimmer (AF), nedsatt koronarcirkulation och arteriell hypertoni kan diastolisk dysfunktion resultera i dekompenserat tillstånd och tros således vara ett tidigt tecken på myokardiell ischemi . Det dynamiska förhållandet mellan LV diastoliska och systoliska funktioner bidrar också till diastolisk dysfunktion hos LoHF-patienter. Stimulering av inotrop katekolamin påverkar både diastol och systol och kan förbättra diastolisk dysfunktion. Deprimerad LVEF leder till en ökning av slut-systolisk volym och förlänger den diastoliska fasen i hjärtcykeln .
RV-dysfunktion
I LoHF, särskilt efter kranskärlskirurgi, innefattar principen patofysiologiska mekanismer för RV-dysfunktion ökad förspänning, ökad efterbelastning, nedsatt höger kranskärlsperfusion och minskad kontraktilitet . Till skillnad från vänster kransartär sker perfusionen av den högra kransartären under både diastol och systol. Närvaron av PH orsakar en ökning av RV-trycket som leder till minskad perfusion av höger kransartär, vilket förklarar vikten för att ge optimal vänster och höger kranskärlcirkulation . Hos patienter som har genomgått kranskärlskirurgi kan RV-dysfunktion utvecklas som ett resultat av en kombination av mekanismer. Perioperativ RV-ischemi och infarkt är de främsta orsakerna till nedsatt RV-kontraktilitet. Tricuspid eller pulmonic uppstötningar re vanliga orsaker till ökad volym förspänning medan vänstersidig klaffsjukdom eller kardiomyopati, PH eller lungemboli (PE), akut andnödssyndrom och högt positivt tryck ventilation är vanliga orsaker till trycköverbelastning . Eftersom RV normalt tillåter lågtrycksperfusion av lungkärlen är den mycket känslig även för måttliga ökningar av lungartärtrycket (PAP). RV-misslyckande kan utvecklas i inställningen av PH eller nedsatt kontraktilitet associerad med en snabb progression av RV-utvidgning som leder till ökat slutdiastoliskt RV-tryck . Dessa fysiologiska förändringar kan orsaka inter-ventrikulär septumförskjutning mot en redan underfylld LV-kammare och följaktligen orsaka en minskning av LV-förspänning och en minskning av CO .
riskfaktorer
riskfaktorer för LoHF är fortfarande ett underforskat område. Men lite data tillgängliga från kliniska prövningar på HF och från postoperativa LCOS-patienter ger värdefull insikt i riskfaktorer och prediktorer för LoHF. Vid analys av 452 patienter på sjukhus med dekompenserad HF och låg hjärtproduktion var signifikanta riskfaktorer för LoHF Chagas sjukdom (relativ risk : 3, 66), deprimerad ejektionsfraktion (RR: 2, 41), hyponatremi (RR: 1, 62) och njursvikt (RR: 1, 92) . Riskfaktorer för postoperativ LoHF inkluderar nedsatt LV-funktion (< 50%), on-pump CABG, akut eller hjärt-bypass (CPB) kirurgi, ofullständig revaskularisering, ålder > 65 år, och en kombinerad närvaro av diabetes mellitus och preoperativ njursvikt . Förutom riskfaktorer för patienter och operationer är biokemiska prediktorer för LoHF hos postoperativa patienter låga hemoglobinnivåer, totalt lymfocytantal < 2000 celler/aicl och preoperativa nivåer av serumnatriuretiska peptider . Under de senaste två decennierna har det skett förändringar i trenderna i vissa erkända riskfaktorer. Faktorer som högt blodtryck, kvinnligt kön, trippelkärlsjukdom och vänster huvudsjukdom är inte längre statistiskt signifikanta medan risken förknippad med deprimerad preoperativ ejektionsfraktion har fördubblats .
diagnos
det finns inga konsensusriktlinjer eller beprövade diagnostiska kriterier för LoHF-patienter. Dessutom är kliniska tecken och symtom ospecifika. I avsaknad av standardiserade riktlinjer är diagnosen vanligtvis beroende av accepterad samling av hemodynamiska och fysiologiska avvikelser som är användbara för att höja klinisk misstanke om LoHF . Diagnos av LoHF ensam är ofta inte tillräckligt. Orsaken till lågutgångstillståndet måste också fastställas. I vissa orsaker till lågutgångstillstånd som PE eller MI är behandling av den bakomliggande orsaken det viktigaste övervägandet och därför är det absolut nödvändigt att ställa diagnosen. Eftersom LoHF-patienter ofta är instabila är det också vanligt att klinisk utvärdering, diagnos och behandling sker samtidigt mer i akuta vårdinställningar .
tecken och symtom
låg hjärtminutvolym som presenterande egenskap hos akut dekompenserad HF är ovanlig och påverkar endast 8,9 till 9,6% av Hf-patienter på sjukhus . LoHF kan dela många kliniska funktioner med CHF men det finns anmärkningsvärda skillnader som kan stödja eller vägleda efterföljande diagnostiska beslut. Överdriven trötthet och ökad träningsintolerans är viktiga initiala tecken som uppmärksammas av LoHF-patienter även före diagnos . Dessutom uppvisar LoHF-patienter ofta agitation, förvirring och/eller reducerade medvetenhetsnivåer; kalla/vasokonstrikta periferier eller fördröjd kapillärpåfyllningstid; hypotoni; takykardi eller bradykardi; thready puls; upphöjt jugulärt venetryck; andfåddhet och hypoxemi; och oliguri/anuri . Dessa tecken och symtom kan skilja sig mellan låg perfusion och trängsel hos HF-patienter (Tabell 2).
tabell 2. Symtom och tecken på låg perfusion vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: 2016 ESC-riktlinjerna för diagnos och hantering av HF betonar vikten av att få detaljerad patienthistoria och fysisk undersökning på alla patienter som misstänks ha HF . Detaljerad historia från patienten, eller släkting och vänner om patienten är för sjuk, bör fokusera på att få information om symtom, tidigare och nuvarande hjärt-och extrahjärtförhållanden som kan utlösa eller förvärra HF, exponering för riskfaktorer för HF eller lågutgångstillstånd och medicinhistoria för tidigare och nuvarande medicinska tillstånd . Förutom patienthistoria rekommenderas fysisk undersökning till alla LoHF-patienter för att bedöma kliniska indikatorer för hemodynamisk, perifer perfusion, trängsel, underliggande etiologi och valvulär patologi. Hemodynamiska parametrar av intresse inkluderar blodtryck, HR och hjärtrytm, galopprytm, syremättnad och andningsfrekvens . Tester för perifer perfusion bör inkludera medvetenhetsnivåer, perifer hud/central temperatur, kapillärpåfyllningstid och urinproduktion. Tester för trängsel inkluderar förhöjt jugulärt venetryck, perifert/lungödem, hepatomegali, ascites och pleurala effusioner. Tester för den underliggande etiologin bör innehålla kardiovaskulär undersökning och hjärtljud och murmur. Slutligen bör bevis för valvulär dysfunktion inkludera perikardiell gnidning och bevis på perikardiell effusion med eller utan hjärttamponad .
kombinationen av patienthistoria och fysisk undersökning har visat sig ovärderlig vid bedömningen av hemodynamisk status och erkännande av LoHF . 1976, Forrester et al. genomfört fysisk undersökning av patienter med akut hjärtinfarkt och identifierade fyra hemodynamiska profiler (A, B, L och C) som illustreras i Figur 2. Hemodynamiska profiler är baserade på närvaro eller frånvaro av lungstockning (lungkapillärkil tryck > eller 18 mmHg i 18 mmHg) och tillräckligheten för perfusion (CI > 2,2 L/min/m2). Profil A representerar ingen trängsel / hypoperfusion; profil B trängsel utan hypoperfusion; profil C hypoperfusion utan trängsel; och profil L trängsel och hypoperfusion . LoHF-patienter faller under profilerna L och C (hypoperfusion accusil-trängsel baserat på Nohria et al. demonstration att Profil L och C har en genomsnittlig ki på 1,6 L/min/m2 respektive 1,9 L/min/m2.
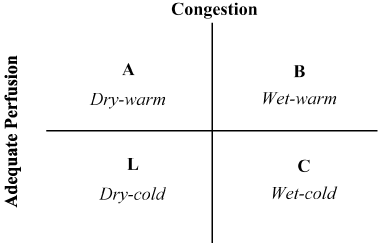
Figur 2. Schematisk presentation av klinisk profil av akut dekompenserad hjärtsvikt
trängsel bedöms genom förekomst av ortopnoea, jugular venös distension, lung rassel, hepatojugulär reflux, ascites, perifert ödem, abdominal reflux och Valsalva kvadratvåg. Låg perfusion bedömdes genom närvaron av ett smalt pulstryck, pulsförändringar, kalla extremiteter, kanske sömniga, sjunkande serumnatriumnivåer och försämrad njurfunktion. Anpassad från Nohria, et al.
elektrokardiogram( EKG): både AHA-och ESC-riktlinjer för HF rekommenderar att elektrokardiogram (EKG) ska utföras så tidigt som möjligt hos alla patienter som misstänks ha HF. EKG kan visa olika avvikelser och är mycket osannolikt att det är normalt hos HF-patienter. Det kan också ge bevis på en underliggande etiologi av hjärtdysfunktion inklusive bradykardi, atrioventrikulärt block, sinus takykardi, atriell eller ventrikulär takyarytmi, ischemi, lv-hypertrofi och lågspänningskomplex .
grundläggande laboratorietester: AHA-och ESC HF-riktlinjerna rekommenderar också grundläggande laboratorietester i den inledande kliniska utvärderingen för att stödja diagnos av HF eller orsaken till lågutgångstillståndet. Blodprov ska utföras hos alla misstänkta HF-patienter. Hemoglobin (HB > 10 g/dL) indikerar optimal syretillförsel till vävnader), kronisk anemi är vanlig vid kronisk HF och markant ökade vita blodkroppar ökar misstanken för alternativ diagnos. Test för serumelektrolyt för att bestämma nivåer av kalium, magnesium och kalcium. Urea-och kreatinintest för att bedöma renal hypoperfusion och dysfunktion som är vanlig vid HF. Tester för nedsatt leverfunktion, vilket tyder på nedsatt RV och / eller leverstockning. Glukostest för att bedöma hypoglykemi som kan försämra hjärtfunktionen. Sköldkörtelfunktionstester för hypo-eller hyper-thyroidism som kan orsaka inneboende hjärtinfarkt. Slutligen tester för serumnatriuretiska peptider vars förhöjda nivåer indikerar ökad ventrikulär väggspänning men som inte upptäcker abrupta förändringar i ventrikulärt fyllningstryck på grund av deras långa halveringstid .
Hjärtbildningstester: Hjärtavbildning spelar en central roll vid diagnos av HF såväl som vid övervakning och vägledande terapi. Ekokardiografi är den föredragna modaliteten på grund av noggrannhet, tillgänglighet, säkerhet och kostnadseffektivitet . Det kan kompletteras med andra avbildningsmetoder valda baserat på förmågan att svara på specifika kliniska frågor samtidigt som man överväger kontraindikationer och risker .ekokardiografi: ekokardiografi rekommenderas starkt för alla misstänkta patienter på grund av dess förmåga att bekräfta eller utesluta klinisk diagnos av LoHF, för att bedöma SV och dess variationer och för att bestämma orsaken till lågutgångstillstånd . Transthoracic ekokardiografi bör utföras så snart som möjligt efter klinisk diagnos av låg hjärtproduktion. Det mäter inte bara omfattningen av systolisk och diastolisk dysfunktion, det ger också värdefull information om ventrikulär morfologi, valvulär dysfunktion, myokardiell och perikardiell sjukdom och regionala väggrörelseavvikelser . Ekokardiografi utvärderar systolisk funktion genom att mäta LEVF, där > 45-50% anses vara normalt. Å andra sidan utvärderas diastolisk funktion med mitral i flödesmönster, lungvenflöde och vävnadsdoppler vid mitralringen, medan CO och SV utvärderas med Doppler-principen. Lungartärtryck (PAP) kan uppskattas genom att mäta regurgitate jethastighet. Hög PAP i närvaro av dilaterad RV med septal utplattning eller böjning i LV som indikerar akut ökning av RV-tryckhöjande klinisk misstanke om PE som orsak till lågt utgångstillstånd .
lungröntgen: lungröntgen kan övervägas hos patienter som misstänks ha LoHF. Viktiga indikatorer som bör övervägas för bedömning inkluderar förstorat hjärta som indikerar kardiomegali eller lv-hypertrofi; pulmonell venös trängsel som indikerar förhöjt lv-fyllningstryck; och pleural effusion som indikerar förhöjt LV-tryck, lungemboli eller post-hjärtkirurgi (.
koronarangiografi: indikationer för koronarangiografi hos LoHF-patienter bör överensstämma med rekommendationen av relevanta konsensusriktlinjer för HF . Hos HF-patienter som uppvisar bröstsmärta och bevis på ST-elevation hjärtinfarkt (STEMI) på EKG, bör revaskularisering med primär perkutan koronarintervention utföras så snart som möjligt. Koronarangiografi bör också övervägas hos patienter med post-hjärtstopp av ischemisk etiologi, när det finns tecken på HF och hos patienter som har återhämtat sig från lågutgångstillstånd när orsaken inte har fastställts .
klinisk hantering
närvaron av LoHF representerar ett mycket högrisktillstånd som kräver snabb behandling men saknar standardiserade riktlinjer för klinisk hantering . Följaktligen överväger kliniker normalt individuell patofysiologi för att välja den mest lämpliga behandlingsstrategin . Hos akuta LoHF-patienter rekommenderar 2016 ESC HF-riktlinjerna användning av hemodynamiska profiler (baserat på närvaro eller frånvaro av trängsel och tillräcklighet för perfusion) för att vägleda klinisk hantering . För LoHF-patienter i Profil L (ingen trängsel men hypoperfuserad) och profil C (både trängsel och hypoperfuserad) som befinner sig i akut dekompensationstillstånd kan akutbehandlingsmål inkludera återupplivande patienter, återställande av syresättning, förbättring av organperfusion och optimering av hemodynamisk (strokevolym och CO) och lösa symtom. Andra efterföljande mål inkluderar optimal övervakning och fastställande av den bakomliggande orsaken till låg hjärtminutvolym och behandla orsaken om reversibel . För närvarande optimerar tillgängliga terapeutiska mål för LoHF vävnadssyresättning, stabiliserar cirkulationen och behandlar reversibla orsaker till lågutgångstillstånd (Figur 3).
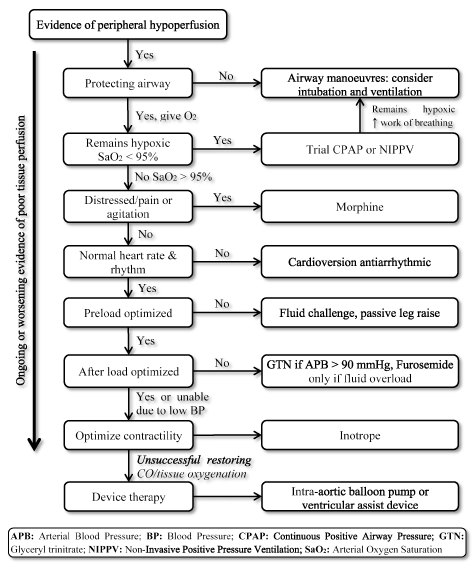
Figur 3. Behandlingsalgoritm för hjärtsvikt med låg effekt
behandling av LoHF-mål som förbättrar vävnadssyresättning och stabiliserar cirkulationen baserat på pågående eller förvärrade symptom på vävnadsperfusion. Behandlingen börjar med att förbättra ventilationen med hjälp av tillförsel av högt flödessyre, kontinuerligt positivt luftvägstryck (CPAP) eller icke-invasiv positiv tryckventilation (NIPPV). Om det misslyckas ges kardioversion eller antiarytmiska läkemedel för att normalisera hjärtfrekvensen, vätskeutmaningen för att optimera förbelastningen och/eller vasodilatatorer och inotroper för att manipulera respektive förbättra kontraktiliteten. Om tidigare ventilation och medicinering misslyckas med att återställa hjärtutgången och/eller vävnadssyresättning, kan enhetsbehandling med hjälp av intra-aorta ballongpump eller ventrikulära hjälpanordningar övervägas
optimera vävnadssyresättning (ventilationsstrategier)
klinisk hantering av LoHF-patienter börjar ofta med bedömningen av luftvägar, andning och cirkulation för bevis på perifer hypoperfusion. Ventilatorstrategier som orofaryngeala eller nasofaryngeala luftvägar är vanliga tillägg som används för att återställa eller upprätthålla luftvägsförmåga hos LoHF-patienter med minskade medvetenhetsnivåer på grund av minskad cerebral perfusion. Ytterligare endotrakeal intubation bör övervägas om patienten förblir med komprometterade luftvägar . Om patienter fortsätter att förbli hypoxiska (SaO2 < 95%), maximering av syretillförsel med högt flödessyre, kontinuerligt positivt luftvägstryck (CPAP) eller icke-invasiv positiv tryckventilation (NIPPV) kan övervägas. Hos patienter utan förbättring kan intubation eller ventilation övervägas .
stabilisera cirkulationen
hjärtutgång (CO) är en funktion av HR och SV. SV beror i sin tur på fyra cirkulationsvariabler-hjärtfrekvens, förspänning, kontraktilitet och efterbelastning. Optimering av alla dessa variabler kommer att förbättra CO hos LoHF-patienter . I klinisk miljö beror strategier för att öka CO på den bakomliggande orsaken och den drabbade cirkulationsvariabeln . Kliniska ingrepp inkluderar volymjustering, farmakologiskt stöd och enhetsbehandling.
hjärtfrekvens / rytm: Som en del av kroppens fysiologiska svar ökar ökande HR CO. För snabb eller långsam HR har en skadlig effekt på CO. Hos LoHF-patienter med takykardi (för snabb vilande HR > 100 bpm) som är nödställda, rastlösa och andnöd kan morfin administreras för att lindra andnöd, smärta och agitation såväl som det är en mild venodilator för att minska efterbelastningen, särskilt hos CPAP-eller NIPPV-patienter . Om HR < 40 bpm med bevis på hemodynamisk kompromiss och/eller nedsatt CO, bör läkemedel som ökar HR (atropin och antikolinergika ) eller ingrepp som transkutan/transvenös stimulering utföras. Urgent elektrisk kardioversion bör övervägas i utvald LoHF med ventrikulär/supraventrikulär takykardi eller snabb AF med tecken på kardiovaskulär kompromiss .
optimera förspänning (volymjusteringar): mätning av förspänning är avgörande för dess optimering. Det rekommenderas till patienter med kliniska tecken på nedsatt perifer perfusion. En vätskeutmaning bör utföras för att bedöma förspänningsrespons. Infusera snabbt 250 ml vätska (kristalloid eller kolloid) i över fem minuter och objektivt bedöma effekten på SV. Om effekten är en ökning eller minskning > 10%, ska patienten fortsätta att få vätskebolus för att optimera förspänningen tills de inte längre svarar på vätska . För patienter med tecken på trängsel och lungödem som inte behöver vätskebolus kan en passiv benhöjning göras – lyfta patientens ben till 45 grader för att utesluta behovet av vätskeutmaning. Om svaret om gynnsamt kan en verklig flytande utmaning ges .
manipulera afterload( farmakologiskt stöd): Afterload är motståndet mot vilket ventrikeln matar ut blod, ibland uppskattat som SVR. Afterload bör minskas hos LoHF-patienter med hög afterload, låg CO, tecken på dålig perifer perfusion och lungödem. Farmakologiskt stöd med vasodilatatorer ska ges till LoHF-patienter med systolisk BP 110 mmHg. Hos patienter med systolisk BP < 90 mmHG och medelartärtryck < 65 mmHg rekommenderas inte vasodilatatorer på grund av risken för hypotoni, vilket kan komplicera organperfusion. Hos dessa patienter rekommenderas inotroper som den första behandlingslinjen .
förbättra kontraktiliteten (farmakologiskt stöd): Om patienten kvarstår med tecken på vävnadshypoperfusion eller minskad syretillförsel trots ingrepp för hjärtfrekvens, förspänning och efterbelastning, bör behandling för att förbättra kontraktiliteten övervägas. Under tiden bör optimering av syretillförseln fortsätta för att sikta på hemoglobin 10 g/dl och säkerställa optimal syremättnad (SaO2). Faktorer som påverkar myokardiell kontraktilitet är hyperkalemi, hypomagnesemi, hypokalcemi, svår acidos, hypoxi och hypoglykemi, vilket måste korrigeras. Inotroper rekommenderas för att förbättra kontraktiliteten och därefter CO hos LoHF-patienter med lågt BP och/eller lågt CI i närvaro av tecken på dålig perifer perfusion eller trängsel . Farmakologiskt stöd med dobutamin (en inotrop) bör dock användas med försiktighet hos patienter som har takykardi eller AF eftersom det ökar av-nodledningen och kan fälla ut snabba ventrikulära rytmer . Å andra sidan rekommenderas levosimendan hos LoHF-patienter med akut myokardiell ischemisk eller efter hjärtkirurgi eftersom det inte ökar myokardiell syrebehov . Långtidseffekten av inotroper kan vara skadlig och därför bör deras användning stoppas när stabiliteten har uppnåtts. Vasopressorer bör inte vara första linjens medicinering i lågproduktionstillstånd eftersom de ökar SVR och därefter försämrar CO. En dubbel terapi av vasopressorer och inotrop rekommenderas dock hos patienter som har sepsis som den bakomliggande orsaken till lågutgångstillstånd .
enhetsbehandling: enhetsbehandling bör övervägas hos LoHF-patienter när optimala medicinska behandlingar inte har lyckats återställa CO-och vävnadssyresättning. Vanliga enhetsterapier inkluderar intra-aorta ballongpump (IABP) och ventrikulär hjälpanordning (VAD). Användningen av IABP är vanlig hos LoHF-patienter med ischemisk hjärtsjukdom, före eller efter perkutan ingrepp eller post-hjärtkirurgi. Iabp består av en ballong införd i aortan genom lårbensartären. Ballongen blåses upp under diastol och töms under systole för att öka diastoliskt BP och följaktligen koronar perfusion, och minskar efterbelastningen och ökar därmed CO . Å andra sidan är användningen av VAD ovanlig. Den kan endast användas i specialistcentra. Det används ofta som en bro till hjärttransplantation hos patienter med gynnsam livskvalitet eller till återhämtning hos patienter med akut myokardit .
behandling av bakomliggande orsaker
vissa orsaker till lågt utgångsläge hos patienter med LoHF kan vändas med specifika terapier. Reversibla orsaker bör identifieras tidigt under den första kliniska utvärderingen. Dessa orsaker inkluderar akut hjärtinfarkt, hjärttamponad, spänningspneumotorax, lungemboli och akut ventilfel . (Tabell 3).
metaanalys av diagnos och klinisk hantering
grunden för klinisk diagnos av LoHF har varit ekokardiografiska bevis på LV/RV systolisk dysfunktion och / eller lv diastolisk dysfunktion åtföljd av bevis på minskad CO och SvO2 . Hemodynamiska profiler baserade på mått på trängsel och perfusion har använts för att klassificera akuta HF-patienter i fyra profiler: torr-varm (a), våt-varm (B), torr-kall (L) och våt-kall (C) och användbar för att identifiera LoHF-patienter . LoHF-patienter har klassificerats i Profiler (L) och (C) baserat på närvaro/frånvaro av trängsel och/eller otillräcklig perifer perfusion . Dessa två hemodynamiska profiler har legat till grund för att välja patienter med LoHF i kliniska prövningar samt ge enkel sängbedömning för att hjälpa till att klassificera patienter vid presentationen och för att styra valet av initiala terapier . Målet med den nuvarande metaanalysen är att samla publicerade bevis på vanliga diagnostiska funktioner och behandlingsresultat för patienter med LoHF.
sökstrategi
tre stora online-databaser (PubMed, EMBASE och Cochrane) sökte systematiskt sedan starten till December 2018 för studier som undersökte diagnos och klinisk hantering av LoHF. För att undvika att förbise studier som inte nämnde LoHF i titeln eller abstraktet inkluderades de första 200 relevansrankade artiklarna som hämtades med en fulltext Google Scholar-sökning. Ingen publiceringstid eller språkbegränsningar tillämpades. Ytterligare studier identifierades genom en manuell sökning av referenslistan från de inkluderade studierna samt från relevanta granskningsartiklar, som sedan utsattes för inklusionskriterierna. Sökkriterierna inkluderade population av intresse (patienter med LoHF eller LCOS), diagnostiska tester av intresse (ekokardiografi och hemodynamiska profiler) och ingripande av intresse (ventilatorstrategier, volymjustering, farmakologiskt stöd och enhetsterapi). Studier inkluderades om de uppfyllde följande kriterier: (a) inkluderade patienter med LoHF; (B) diagnostiserad med ekokardiografi och hemodynamiska profiler; (c) behandlade patienter för hemodynamisk stabilisering; och (d) rapporterade behandlingsresultat. I fall av studier som rapporterade dubbla data inkluderades endast den studie som gav det största antalet patienter. Konferensabstrakter, fallrapporter och granskningsartiklar uteslöts.
studieval
Figur 4 illustrerar Sök – och screeningprocessen som används för att inkludera kvalificerade studier. Två granskare visade oberoende alla titlar och abstrakter som hämtats från den systematiska onlinesökningen. Sammanfattningar som inkluderade befolkning, intervention och resultat av intresse inkluderades för fulltextsökning. Därefter granskade de två granskarna oberoende artiklar i fulltext mot inkluderingskriterierna. I fall av avvikelse löstes det genom diskussion och konsensus.

Figur 4. Flödesschema för litteratursökning och inkluderingsprocess
datainsamling
två granskare extraherade oberoende data från de inkluderade studierna och eventuella avvikelser löstes genom konsensus. De viktigaste data som extraherades var ekokardiografiska och hemodynamiska profildata och behandling som användes och behandlingsresultat på hemodynamisk (hjärtindex, PCWP) och dödlighet. Utöver dessa huvuddata extraherade de två granskarna också data om studieegenskaper, patienters egenskaper och uppföljningstid (Tabell 4).
statistisk analys
resultat av intresse som rapporterats i mer än en studie är hjärtindex, PCWP och dödlighet. För varje resultat extraherades sammanfattande statistik (genomsnittlig standardavvikelse för standardavvikelse i enlighet med tabellen) före och efter interventionen eller skillnaden mellan baslinjen och efter behandlingen. Denna sammanfattande statistik extraherades separat för behandlings-och kontroll – /placebogrupper. Diagnostiska resultat och behandlingseffekter mättes med skillnad i medel före och efter intervention och associerat 95% konfidensintervall. Skogstomter användes för att visuellt undersöka heterogenitet (I2) över studier. Poolad diagnostisk och behandlingseffekt och tillhörande 95% konfidensintervall uppskattades med fast effekt (I2 < 49%) eller slumpmässig effektmodell (I2 > 50%). P-värde > 0,05 ansågs vara statistisk signifikant.
resultat
studieegenskaper
tolv (12) randomiserade kontrollerade studier (RCT) uppfyllde inklusionskriterierna. Sju (7) studier registrerade LoHF-patienter och de återstående fem (5) registrerade HF-patienter som har genomgått hjärtkirurgi med låg hjärtproduktion. Majoriteten av publicerade kliniska prövningar (10) undersökte medicinering som jämförde effekten av olika typer av inotroper på hemodynamisk och förebyggande av död: endast dobutamin , dobutamin och dopamin ; levosimendan och dobutamin och levosimendan och placebo . Av de återstående två kliniska studierna undersökte var och en vasodilatorn (nitroprussid) och placebo och enhetsbehandling (IABP) och inotrop (levosimendan) ensam eller i kombination med iapb . Sammantaget omfattade de 12 kliniska prövningarna 3 738 patienter, medelålder 64 år (intervall = 55-74 år), varav majoriteten var män (78%).
syntes av resultat
diagnosdata på LoHF var inkonsekvent. Över de tolv kliniska prövningarna framkom ingen gemensam definition av LoHF som skulle ha varit användbar för att styra diagnosen. Hemodynamiska kriterier som användes för inkludering av patienter i studierna inkluderade CI < 2,0 L/min/m2 , CI < 2,2 L/min/m2 eller CI < 2,5 L/min/m2 och PCWP > 15 mmHg eller 18 mmHg . Definitionen varierade också mellan studier – postoperativt tillstånd med hypotension (systolisk BP < 90 mmHg för > 30 minut) eller behovet av inotrop stöd för att upprätthålla systolisk BP > 90 mmHg och end-organ hypoperfusion (kalla periferier, urinproduktion < 30 ml/timme) . Kardiogen chock har beskrivits som ett komplext syndrom som involverar en kaskad av akut LV-dysfunktion, minskad CO, hypotoni och vävnadshypoperfusion .
figurerna 5 och 6 visar skogsplottar för standardiserat medelvärde av hjärtindex vid baslinjen respektive efter inotrop eller vasodilatorbehandling. Baslinjens hjärtindex ökade från ett medelvärde på 1,93 (95% ki: 1,91-1,95) till ett medelvärde efter behandlingen på 2,82 (95% ki: 2,80-2,84). Figur 7 visar en skogsplot för standardmedelskillnad (SMD) av hjärtindex efter behandling med levosimendan och dobutamin. Levosimendan uppnår högre hjärtindex jämfört med dobutamin (SMD: 2,82; 95% CI: 2,54-3,10). Som profylaktisk mot LoHF hos postoperativa patienter uppnådde levosimendan-infusion efter anestesi ett högre hjärtindex (2, 57) jämfört med preoperativ IABP (2, 3) eller med en kombination av levosimendan (2, 4). Figur 8 visar en skogsplot av dödligheten mellan levosimendan och placebo. Levosimendan hade lägre dödlighet jämfört med placebo (oddskvot : 0,83; 95% ki: 0,59-1,18) men skillnaden var inte statistiskt signifikant (p=0,30). Slutlig, Figur 9 visar vidare att Levosimendan har en lägre dödlighet jämfört med dobutamin (eller: 0,65; 95% CI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
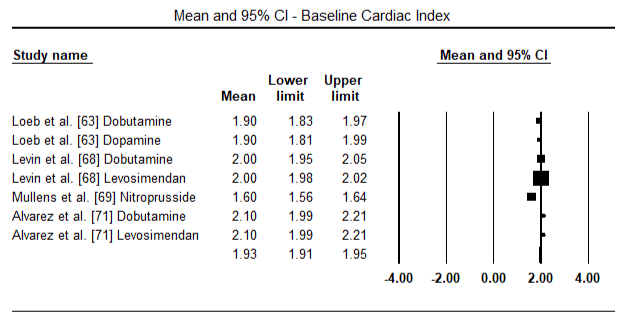
Figure 5. Mean baseline cardiac index
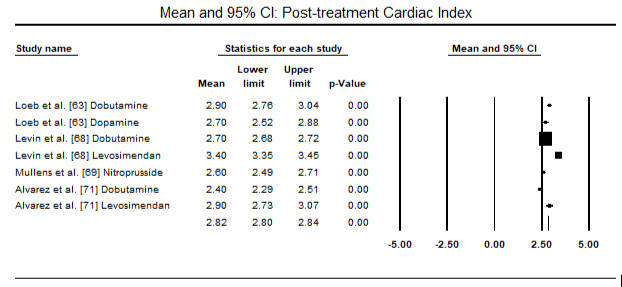
Figure 6. Mean post-treatment cardiac index
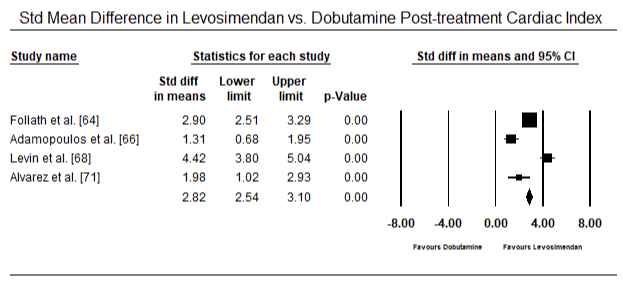
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
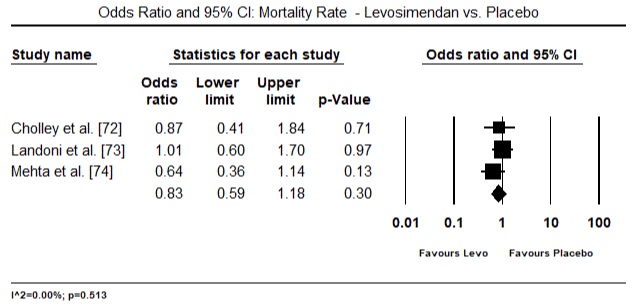
Figure 8. Mortality rate between levosimendan and placebo
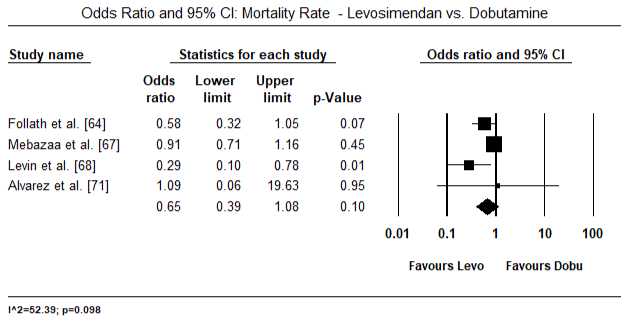
Figure 9. Dödlighet mellan levosimendan och dobutamin
diskussion av fynd
denna systematiska granskning och metaanalys bedömde vanliga diagnostiska funktioner och behandlingsresultat av medicinsk och enhetsterapi (Iabp) på LoHF-patienter. Resultaten indikerar att LoHF-patienter saknar allmänt accepterade eller standardiserade diagnosfunktioner. Även om LoHF-patienter kunde uppvisa flera funktioner inklusive hjärtindex, PCWP, systolisk BP och SvO2 för att föreslå eller stödja klinisk diagnos, har alla dessa funktioner olika avstängningsvärden över studier. Hjärtindex, som är den vanligaste kliniska funktionen som visar lågutgångstillstånd i LoHF, har tre gränsvärden: < 2,0 L/min/m2 , < 2,2 L/min/m2 eller < 2,5 L/min/m2 . Inotropiskt stöd framkom som ett mycket vanligt ingrepp för att förbättra perfusion och normalisera hjärtutgången hos LoHF-patienter.
inotropa läkemedel såsom levosimendan, dobutamin, dopamin, vasodilator (nitroprussid) och IABP förbättrade signifikant CI mellan baslinjen och efterbehandling. När det gäller inotroper är levosimendan effektivare för att förbättra hemodynamisk stabilitet och en bättre profylaktisk mot kortvarig död (30-dagars dödlighet) än dobutamin. Dessutom kan inotroper fungera som profylaktiska mot utvecklingen av postoperativ LoHF. Å andra sidan, medan inotroper förbättrar hemodynamisk och normaliserar hjärtutgången, ger de inte något signifikant bättre skydd mot dödlighet oavsett vilken typ av inotrop som används.
inotropernas roll vid behandling av LoHF har stödts av en tidigare granskning av inotropa medel och vasodilatorstrategier för behandling av kardiogen chock och LCOS . Granskningen rapporterade inotroper förbättra hemodynamiska, biverkningar i postoperativa LCOS och minskad dödlighet. Nyare inotroper som levosimendan (en kalciumsensibiliserare och inodilator) är en positiv inotrop har vissa vasodilaterande egenskaper . Det kan också betraktas som en selektiv lever vasodilator, som kan förbättra portal venöst flöde via leverartär och portal venöst flöde jämfört med dobutamin som bara kan förbättra portal venöst flöde utan att vasodilatera leverartären . Levosimendan ökar inte heller myokardiell syrebehov och rekommenderas över dobutamin hos LoHF-patienter med akut myokardiell ischemisk eller efter hjärtkirurgi . För postoperativ LoHF förblir den skyddande effekten av inotroper mot kortvarig dödlighet (30-dagars dödlighet) obetydlig jämfört med placebo .
den nuvarande systematiska översynen och metaanalysen har några viktiga begränsningar. LoHF kan förekomma i sekundär till underliggande hjärtsjukdom såsom akut hjärtinfarkt eller postoperativ. De flesta av studierna inkluderade undersökt postoperativ LoHF med färre presentation av LoHF från andra orsaker. De flesta studierna fokuserade på två inotroper (Levosimendan och dobutamin), vilket begränsade förståelsen för andra inotroper såväl som andra terapier såsom enhetsterapier. I vissa studier var analysen i riskzonen för felklassificering bias på grund av ett betydande antal patienter förlorade för uppföljning. Eftersom de flesta av försöken inte rapporterar parvis skillnad före och efter intervention med tillhörande standardavvikelse, skillnad före och efter intervention med standardavvikelse, före och efter intervention resultat åtgärder som oberoende, detta erhåller sider-konfidensintervall för behandlingseffekt med tillhörande standardavvikelse.
slutsats
hjärtsvikt med låg effekt (LoHF) är ett kliniskt syndrom som kännetecknas av minskad hjärtproduktion åtföljd av hypoperfusion i slutorganet. Det är en ovanlig form av hjärtsvikt i den allmänna befolkningen men förekommer hos HF-patienter efter operationen. Dess etiologi är heterogen, bestående av olika tillstånd som orsakar lågutgångstillstånd och hjärtkirurgi. De huvudsakliga patofysiologiska mekanismerna är LV systolisk och/eller diastolisk dysfunktion och RV-dysfunktion orsakad av förändringar i hjärtfrekvens, förspänning, efterbelastning och / eller kontraktilitet. Allmänna riskfaktorer för LoHF inkluderar Chagas sjukdom, deprimerad ejektionsfraktion och nedsatt njurfunktion medan hos postoperativa patienter inkluderar nedsatt LV-funktion, ofullständig revaskularisering, äldre ålder och närvaro av diabetes och nedsatt njurfunktion. Diagnos saknar standardiserade riktlinjer och är beroende av accepterad insamling av hemodynamiska och fysiologiska avvikelser inklusive tillstånd som orsakar lågt utgångsläge. Patienthistoria och fysisk undersökning hjälper till att bedöma hemodynamisk status och känna igen lågutgångstillstånd medan ekokardiografi bekräftar ventrikulär dysfunktion (HF) och låg hjärtutgång. Andra tester för att stödja diagnos eller fastställa orsaken till lågutgångstillstånd inkluderar elektrokardiogram och grundläggande laboratorietester (blod, serumelektrolyt, urea och kreatinin, levertest, sköldkörtelfunktion och serumnatriuretiska peptider) och hjärtavbildning (bröströntgen eller koronarangiografi). Behandlingen saknar fastställda riktlinjer men beror på bedömningen av individuell patofysiologi för att välja den lämpligaste behandlingsstrategin. Behandlingen inkluderar ventilatorstrategier för att förbättra hjärtfrekvens och rytm; volymjustering för att optimera förspänning; farmakologiskt stöd (inotroper och vasodilatatorer) för att manipulera efterbelastning och förbättra kontraktilitet; och enhetsterapi (intra-aorta ballongpump eller ventrikulär assistansenhet) när dessa strategier inte återställer hjärtutgången. Hos utvalda patienter kan terapier för att vända underliggande sjukdom återställa hjärtutgången.
- Inamdar a, Inamdar A (2016) diagnos av hjärtsvikt, hantering och användning. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) den senaste utvecklingen av hjärtsvikt. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) riktlinjer för diagnos och behandling av akut och kronisk hjärtsvikt 2012: arbetsgruppen för diagnos och behandling av akut och kronisk hjärtsvikt 2012 av European Society of Cardiology. Utvecklad i samarbete med Heart Failure Association (HFA) av ESC. Eur J Hjärta Misslyckas 14: 803-869.det är en av de mest populära och mest populära. (2013) 2013 ACCF/aha-riktlinje för hantering av hjärtsvikt: en rapport från American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 62: e147-239.Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 Esc riktlinjer för diagnos och behandling av akut och kronisk hjärtsvikt: Arbetsgruppen för diagnos och behandling av akut och kronisk hjärtsvikt hos European Society of Cardiology (ESC) utvecklades med det särskilda bidraget från Heart Failure Association (HFA) från ESC. Eur Hjärta J 37: 2129-2200.
- Masse L, Antonacci M (2005) syndrom med låg hjärtutgång: identifiering och hantering. Crit Vård Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) hjärtsvikt. Am J Respir Crit Vård Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) sammanfattning av riktlinjerna för diagnos och behandling av akut hjärtsvikt: arbetsgruppen för akut hjärtsvikt vid European Society of Cardiology. Eur Hjärta J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) hjärtprestanda och dödlighet tidigt efter intrakardiell operation hos spädbarn och småbarn. Cirkulation 51: 867-874.det finns många olika typer av produkter. (1995) postoperativ kurs och hemodynamisk profil efter artäromkopplingsoperationen hos nyfödda och spädbarn: en jämförelse av lågflödes kardiopulmonal bypass och cirkulationsstopp. Cirkulation 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, D 2001 (2001) hjärt-och neurologiska komplikationer identifierar risker för dödlighet för både män och kvinnor som genomgår kranskärlskirurgi. Anestesiologi 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) prediktorer för låg hjärtutgångssyndrom efter bypass av kranskärl. J Thorac Cardiovasc Surg 112: 38-51. det finns många olika typer av produkter. (2010) epidemiologi och nya prediktorer för låg hjärtutgångssyndrom efter isolerad bypass-ympning av kranskärl. Eur Hjärta J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo EGT, Cavalcante WC, et al. (2012) riskfaktorer för låg hjärtutgångssyndrom efter koronar bypass-ympning. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) prediktorer för låg hjärtutgångssyndrom efter isolerad bypassoperation i kranskärl: trender över 20 år. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) hantering av det låga hjärtutgångssyndromet efter operation för medfödd hjärtsjukdom. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) syndrom med låg hjärtutgång efter hjärtkirurgi. J Cardiothorac Vasc Anesthes31: 291-308.
- Tibby SM., Murdoch IA (2003) övervakning av hjärtfunktion i intensivvård. Arch Detta Barn 88: 46-52.
- Carcillo JA, Field AI (2002) kliniska praxisparametrar för hemodynamiskt stöd för pediatriska och neonatala patienter i septisk chock. Crit Vård Med 30: 1365-1378. det är en av de mest populära och mest populära spelen i världen. (2011) Kardiomyocytdöd: mekanismer och translationella konsekvenser. Celldöd & sjukdom 2: e244.
- Tavernarakis N (2007) Kardiomyocytnekros: alternativa mekanismer, effektiva ingrepp. Biochimica et Biophysica Acta (BBA)-Molekylär cellforskning 1773: 480-482.
- Dorn GW (2008) Apoptotisk och icke-apoptotisk programmerad kardiomyocytdöd vid ventrikulär ombyggnad. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) det bedövade och vilande myokardiet: en kort recension. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) diastoliskt hjärtsvikt efter hjärtkirurgi. I kranskärlssjukdom – aktuella begrepp inom epidemiologi, patofysiologi, diagnostik och behandling 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) vilka mekanismer ligger till grund för diastolisk dysfunktion vid hjärtsvikt? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) hjärtsvikt med bevarad utstötningsfraktion: patofysiologi, diagnos och behandling. Eur Hjärta J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) är Phospholamban eller Troponin I ”prima Donna” i AUC-adrenerg inducerad Lusitropi? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) Akuta effekter av kväveoxid på vänster ventrikulär Avslappning och diastolisk distensibilitet hos människor. Bedömning av bikoronär natriumnitroprussidinfusion. Circ 89: 2070-2078.
- Lappas GD, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) förekomst av diastolisk fyllning av vänster ventrikulär Abnorrnaliteter hos vuxna hjärtkirurgiska patienter: en intraoperativ ekokardiografisk studie. Semin Thorac Cardiovasc Surg 11: 125-133.det finns en mängd olika typer av produkter som är tillgängliga för dig. (2006) Biventrikulära diastoliska fyllningsmönster efter kranskärlskirurgi. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) pulmonell arteriell hypertoni: nyckelrollen för ekkokardiografi. Bröst 127: 1836-1843.
- Zochios V, Jones N (2014) akut högerhjärtssyndrom hos den kritiskt sjuka patienten. Hjärta lungkärl 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Initial klinisk erfarenhet av en miniatyriserad transesofageal ekokardiografisond i en hjärtintensivvårdsavdelning. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) prestanda för höger kammare under stress: förhållande till höger koronarflöde. J Clin Investera 50: 2176-2183.
- pris LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) pulmonell vaskulär och höger ventrikulär dysfunktion i vuxen kritisk vård: nuvarande och framväxande alternativ för hantering: En systematisk litteraturöversikt. Crit Vård 14: R169.
- Pfisterer M (2003) höger ventrikulär involvering i hjärtinfarkt och kardiogen chock. Lancet 362: 392-394.jag är en av de mest populära i världen. (2011) prediktorer för låg hjärtproduktion vid dekompenserat allvarligt hjärtsvikt. Kliniker 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) kliniskt resultat av akut koronar bypass-ympning. J Koreanska Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) prediktorer för låg hjärtutgångssyndrom efter isolerad aortaklaffoperation. Cirkulation 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) utvärdering av näringsmässiga screeningverktyg för patienter som planeras för hjärtkirurgi. Näring 29: 436-442.
- Hern U,lndez-Leiva e, Dennis R, Isaza D, Uma Uhlba jp (2013) Hemoglobin och B-typ natriuretisk peptid preoperativa värden men inte inflammatoriska markörer, är associerade med postoperativ sjuklighet i hjärtkirurgi: en prospektiv kohort analytisk studie. J Cardiothorac Surg 8: 170. lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) preoperativt totalt lymfocytantal i perifert blod som en prediktor för dåligt resultat vid vuxen hjärtkirurgi. J Cardiothorac Vasc Anesth 25: 975-980.det finns många olika typer av produkter att välja mellan. (2009) n-terminal Pro-B-typ natriuretiska peptidnivåer och tidigt resultat efter hjärtkirurgi: en prospektiv kohortstudie. Br J Anaesth 103: 647-653.det finns en mängd olika typer av produkter som är tillgängliga för dig. (2004) nytta av B-typ natriuretisk peptid för att förutsäga postoperativa komplikationer och resultat hos patienter som genomgår hjärtkirurgi. J Am Coll Cardiol 43: 1873-1879.det är en av de mest populära och mest populära spelen i världen. (2007) förhållandet mellan upptagningsserumnatriumkoncentration och kliniska resultat hos patienter på sjukhus för hjärtsvikt: en analys från OPTIMIZE-HF-registret. Eur Hjärta J 28: 980-988.det finns många olika typer av produkter. (2005) dödlighet på sjukhus hos patienter med akut dekompenserat hjärtsvikt som kräver intravenösa vasoaktiva läkemedel: en analys från det nationella registret för akut dekompenserat hjärtsvikt (vidhäfta). J Am Coll Cardiol 46: 57-64.det finns många olika typer av musik och musik. (2000) teamhantering av patienter med hjärtsvikt: ett uttalande för vårdpersonal från Cardiovascular Nursing Council of American Heart Association. Cirkulation 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) den begränsade tillförlitligheten hos fysiska tecken för att uppskatta hemodynamik vid kroniskt hjärtsvikt. Jama 261: 884-888.det finns en mängd olika typer av produkter som är tillgängliga för dig. (2003) klinisk bedömning identifierar hemodynamiska profiler som förutsäger resultat hos patienter med hjärtsvikt. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) medicinsk behandling av akut hjärtinfarkt genom tillämpning av hemodynamiska delmängder. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) medicinsk hantering av avancerad hjärtsvikt. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) ekokardiografi vid hjärtsvikt: applikationer, verktyg och nya horisonter. J Am Coll Cardiol 50: 381-396. det finns många olika typer av produkter. (2011) ekokardiografisk utvärdering av hemodynamik hos patienter med dekompenserat systoliskt hjärtsvikt. Circ Cardiovasc Avbildning 4: 220-227.lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) rekommendationer för kvantifiering av hjärtkammare genom ekokardiografi hos vuxna: en uppdatering från American Society of Echocardiography och European Association of Cardiovascular Imaging. Eur Hjärta J Cardiovasc Imaging 16: 233-271.det finns många olika typer av produkter att välja mellan. (2014) Lämplighetskriterier för användning av kardiovaskulär bildbehandling vid hjärtsvikt: rapport från litteraturöversikt. Eur Hjärta J Cardiovasc Imaging 16: 147-153.det finns en mängd olika typer av produkter som kan användas för att förbättra din hälsa och din hälsa. (2014) icke-invasiv hjärtavbildning utvärdering av patienter med kronisk systolisk hjärtsvikt: en rapport från European Association of Cardiovascular Imaging (EACVI). Eur Hjärta J 35: 3417-3425.
- Vazir a, Cowie MR (2012) bedömning av akut dekompenserat hjärtsvikt: strategier och verktyg. Eur Cardiol 8: 128-133.
- grå A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) icke-invasiv ventilation vid akut kardiogent lungödem. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) hemodynamisk övervakning vid akut hjärtsvikt. Crit Vård Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) den intra-aorta ballongpumpen i hjärtsviktshantering: konsekvenser för omvårdnadspraxis. Aust Crit Vård 22: 125-131.
- Slaughter MS, Singh R (2012) rollen av ventrikulära assistansenheter vid avancerad hjärtsvikt. Revista Espa 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) hemodynamiska profiler av avancerat hjärtsvikt: förening med kliniska egenskaper och långsiktiga resultat. J-Kort Misslyckas 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) överlägsenhet av dobutamin över dopamin för förstärkning av hjärtproduktionen hos patienter med kronisk hjärtsvikt med låg effekt. Cirkulation 55: 375-378.det är en av de mest populära och mest populära. (2002) effekt och säkerhet för intravenös levosimendan jämfört med dobutamin vid svår hjärtsvikt med låg effekt (LIDO-studien): en randomiserad dubbelblind studie. Lancet 360: 196-202.det finns många olika typer av produkter. (2002) lågproduktion, låggradient aortastenos hos patienter med deprimerad systolisk funktion i vänster ventrikel: den kliniska nyttan av dobutaminutmaningen i kateteriseringslaboratoriet. Cirkulation 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromit EK, Paraskevaidis I, Tsiapras D, et al. (2006) effekter av levosimendan kontra dobutamin på inflammatoriska och apoptotiska vägar vid akut dekompenserat kroniskt hjärtsvikt. Am J Cardiol 98: 102-106.det finns många olika typer av produkter. (2007) Överleva Utredare. Levosimendan vs dobutamin för patienter med akut dekompenserat hjärtsvikt: SURVIVE Randomized Trial. Jama 297: 1883-1891.Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) kalciumsensibiliseraren levosimendan ger överlägsna resultat till dobutamin i postoperativt syndrom med låg hjärtutgång. Revista Espa Portugola de cardiologist (engelska upplagan) 61: 471-479. det finns många olika typer av produkter. (2008) natriumnitroprussid för avancerad hjärtsvikt med låg effekt. J Am Coll Cardiol 52: 200-207. lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan kontra en intra-aorta ballongpump hos högriskhjärtpatienter. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) en jämförelse av doubutamin och levosimendan n leverblodflöde hos patienter med lågt hjärtutgångstillstånd efter hjärtkirurgi: en randomiserad kontrollerad studie. Anaesth Intensivvård 41: 719-727.det finns många olika typer av produkter. (2017) effekt av levosimendan på låg hjärtutgångssyndrom hos patienter med låg utstötningsfraktion som genomgår koronar bypass-ympning med hjärt-lungomgång: LICORN randomiserad klinisk studie. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan för hemodynamiskt stöd efter hjärtkirurgi. N Engl J Med 376: 2021-2031. det finns många olika typer av produkter. (2017) Levosimendan hos patienter med vänster ventrikulär dysfunktion som genomgår hjärtkirurgi. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) inotropa medel och vasodilatorstrategier för behandling av kardiogen chock eller låg hjärtutgångssyndrom. Cochrane-Biblioteket. 2 : 1-10.