Úvodní Chemie – 1. Kanadské Vydání
Cíle Vzdělávání
- Definovat tlak par kapaliny.
- vysvětlete původ povrchového napětí i kapilárního působení.
existují některé vlastnosti, které mají všechny kapaliny. Kapalina, se kterou jsme nejvíce obeznámeni, je pravděpodobně voda a má tyto vlastnosti. Mají je i jiné kapaliny, což je třeba mít na paměti.
všechny kapaliny mají určitou část svých částic, která má dostatek energie pro vstup do plynné fáze, a pokud jsou tyto částice na povrchu kapaliny, činí tak (obrázek 10.6 „vykašlávání“). Tvorba plynu z kapaliny při teplotách pod bodem varu se nazývá evapurace. Při těchto teplotách se materiál v plynné fázi nazývá pára, spíše než plyn; termín plyn je vyhrazen, když je plynná fáze stabilní fází.
obrázek 10.6 Evapouration

Některé částice kapaliny mají dostatek energie k úniku kapalné fáze, aby se stal par.
Pokud je dostupný objem dostatečně velký, nakonec se veškerá kapalina stane párou. Pokud však dostupný objem nestačí, nakonec některé částice páry znovu vstoupí do kapalné fáze (obrázek 10.7 „rovnováha“). V určitém okamžiku se počet částic vstupujících do fáze par rovná počtu částic opouštějících fázi par, takže nedochází k žádné čisté změně množství páry v systému. Říkáme, že systém je v rovnováze. Parciální tlak páry v rovnováze se nazývá tlak páry kapaliny.
Obrázek 10.7 Rovnováhy

Na nějakém místě, počet částic do plynné fáze bude dáno počtem částic návratu do kapaliny. Tento bod se nazývá rovnováha.
pochopte, že tekutina nepřestala vykašlávat. Reverzní proces-kondenzace – probíhá stejně rychle jako odpařování, takže nedochází k žádné čisté změně množství páry v systému. Termín dynamická rovnováha představuje situaci, ve které se proces stále vyskytuje,ale opačný proces také probíhá stejnou rychlostí, takže v systému nedochází k žádné čisté změně.
tlak par pro látku závisí na teplotě látky; se zvyšující se teplotou se zvyšuje i tlak par. Obrázek 10.8 „grafy tlaku par versus teplota pro několik kapalin“ je graf tlaku par versus teplota pro několik kapalin. Po definování tlaku par můžeme také předefinovat bod varu kapaliny: teplotu, při které se tlak par kapaliny rovná tlaku okolního prostředí. Normální tlak par, pak, je teplota, při které je tlak par 760 torr, nebo přesně 1 atm. Body varu se tedy liší podle okolního tlaku, což může mít velký dopad na vaření potravin v nižších nebo vyšších nadmořských výškách. Atmosférický tlak se výrazně mění s nadmořskou výškou.
Obrázek 10.8 Pozemky Par Tlaku v závislosti na Teplotě pro Několik Kapaliny
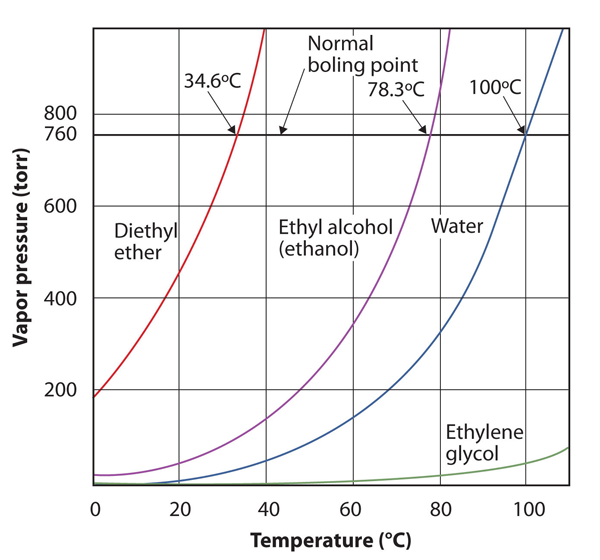
tlak par kapaliny závisí na identitu kapaliny a teploty, jak je tento graf ukazuje.
Příklad 4
Použití Obrázek 10.8 „Pozemky Par Tlaku v závislosti na Teplotě pro Několik Kapalin“ pro odhad varu vody na 500 torr, což je přibližně atmosférický tlak na vrcholu Mount Everestu.
řešení
viz přiložený obrázek. Pět set torr je mezi 400 a 600, tak jsme se prodloužit čáru od tohoto bodu na ose y celé křivky pro vodu a pak pokles je dolů na x-ose, číst spojená teplota. Vypadá to, že bod na tlak vodních par křivka odpovídá teplotě asi 90°C, takže jsme k závěru, že bod varu vody při 500 kpa je 90°C.
Obrázek 10.9 Pomocí Obrázku 10.8 „Pozemky Par Tlaku v závislosti na Teplotě pro Několik Kapaliny“ Odpovědět Příklad 4
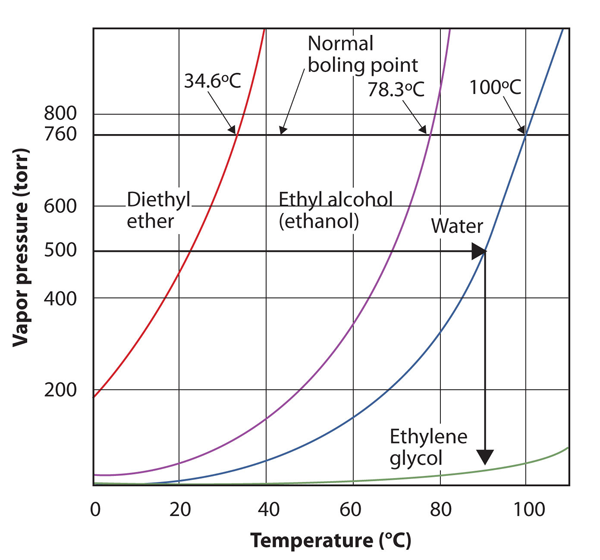
při čtení grafu správně, můžete odhadnout bod varu kapaliny při různých teplotách.
Otestujte se
použijte obrázek 10.8 „grafy tlaku par versus teploty pro několik kapalin“ k odhadu bodu varu ethanolu při 400 torr.
odpověď
asi 65°C
křivka tlaku par pro vodu není v bodě tání přesně nulová-0°C. I led má tlak par; proto se časem sublimuje. Tlaky par pevných látek jsou však obvykle mnohem nižší než tlaky kapalin. Při -1°C je tlak páry ledu 4,2 torr. V mrazáku teplota 0°F (-17°C), tlak par led je pouze 1.0 torr; tzv. hluboké mrazničky může dostat do -23°C, kde tlak par led je pouze 0,6 torr.
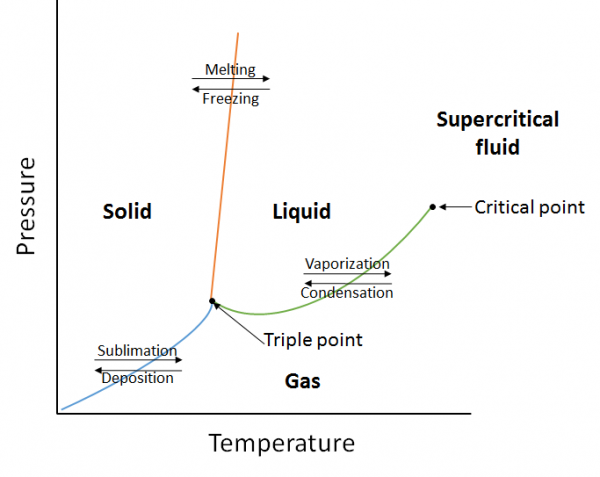
Fázové diagramy
fázový diagram je grafické znázornění rovnovážné vztahy, které existují mezi fázemi látky podle uvedené tlaky a teploty (Obrázek 10.10). Fázový diagram je kombinací tří křivek: křivky tlaku par, křivky tavení a křivky sublimace. Již dříve jsme viděli, že tlak par křivky představují rovnováhu mezi kapalné a plynné fáze, a bod, ve kterém se rovnal tlaku 1 atm je normální bod varu. Dalším rysem této křivky ve fázovém diagramu (zelená) je to, že končí v kritickém bodě. Kritickým bodem je bod při nejvyšší teplotě a tlaku, při kterém zůstávají kapaliny a plyny rozlišitelné. Při teplotách a tlaku za tímto bodem existuje hmota ve fázi s vlastnostmi kapalin i plynů známých jako nadkritická tekutina.
křivka tání (oranžová) představuje rovnováhu mezi pevnou látkou a kapalinou a bod, ve kterém se tlak rovná 1 atm, je normální teplota tání. Sublimační křivka (modrá) představuje rovnováhu, která existuje mezi pevnou látkou a plynem. Konečně, bod, kde se všechny tři křivky setkávají, je známý jako trojitý bod. V tomto okamžiku existují v rovnováze tři fáze (pevná, kapalná a plynná).
Příklad:
Pomocí následujícího fázového diagramu, určit, co by se stalo, pokud:
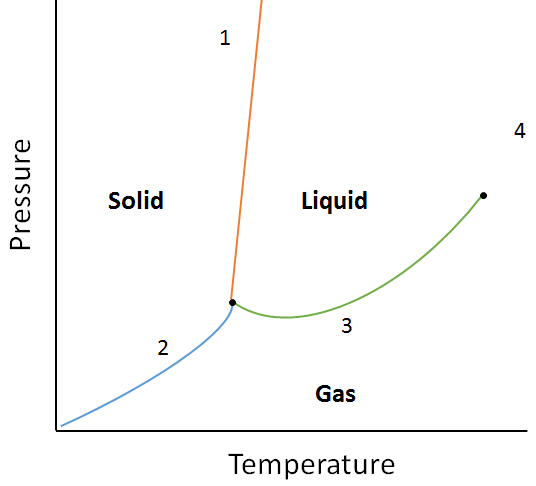
. Teplota je zvýšena ohledu na bod 1.
b. tlak se zvyšuje pro hmotu v bodě 3.
roztok:
a. hmota v bodě 1 se roztaví (změní fázi z pevné látky na kapalinu), pokud se zvýší teplota.
b. Hmota v bodě 3 kondenzuje (změní fázi z plynu na kapalinu), pokud se zvýší teplota.
povrchové napětí a kapilární působení
všechny kapaliny mají také některé další vlastnosti. Povrchové napětí je účinek způsobený nerovnováhou sil na atomy na povrchu kapaliny, jak je znázorněno na obrázku 10.11 „povrchové napětí“. Modrá částice v objemu kapaliny zkušenosti mezimolekulárních sil od všech kolem, jak je znázorněno šipkami. Žlutá částice na povrchu však nezažívá nad ní žádné síly, protože nad ní nejsou žádné částice. To vede k nerovnováze sil, které nazýváme povrchové napětí.
Obrázek 10.11 Povrchové Napětí

Povrchové napětí vychází ze skutečnosti, že částice na povrchu kapaliny nemají zkušenosti interakce ze všech směrů, což vede k nerovnováze sil na povrchu.
Obrázek 10.12 Účinky Povrchového Napětí.

zdroj:“ wet apple “ od Cristiana rubertiho je licencován pod Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic.