Úvodní Chemie – 1. Kanadské Vydání
Cíle Vzdělávání
- Definovat buffer.
- správně identifikujte dvě složky vyrovnávací paměti.
Jak je uvedeno v Oddíle 12.4 „Silné a Slabé Kyseliny a zásady a Jejich Soli“, slabé kyseliny jsou relativně časté, a to i v potravinách, které jíme. Občas se však setkáváme se silnou kyselinou nebo zásadou, jako je žaludeční kyselina, která má silně kyselé pH 1,7. Podle definice mohou silné kyseliny a zásady produkovat relativně velké množství iontů H+ nebo OH a v důsledku toho mají výrazné chemické aktivity. Navíc velmi malé množství silných kyselin a zásad může velmi rychle změnit pH roztoku. Pokud 1 mL žaludeční kyseliny byly přidány do krevního oběhu, a ne oprava mechanismus byl přítomen, pH krve sníží z o 7.4 o 4.7—pH, který není příznivé pro pokračující život. Naštěstí má tělo mechanismus pro minimalizaci takových dramatických změn pH.
tento mechanismus zahrnuje vyrovnávací paměť, řešení, které odolává dramatické změny v pH. Nárazníky tak učinit tím, že se skládá z určité dvojice rozpuštěných látek: buď slabé kyseliny plus sůl odvozená od slabé kyseliny nebo slabé báze plus sůl, že slabá báze. Například pufr může být složen z rozpuštěného HC2H3O2 (slabá kyselina) a NaC2H3O2 (sůl odvozená od této slabé kyseliny). Dalším příkladem pufru je roztok obsahující NH3 (slabá báze) a NH4Cl (sůl odvozená od této slabé báze).
použijme pufr HC2H3O2 / NaC2H3O2, abychom ukázali, jak pufry fungují. Pokud silná základna—zdroj OH−(aq) ionty—je přidán do roztoku pufru, ty, OH− iontů bude reagovat s HC2H3O2 v acidobazické reakce:
HC2H3O2(aq) + OH−(aq) → H2O(ℓ) + C2H3O2−(aq)
Spíše než změna pH výrazně tím, že řešení základní, přidány ionty OH− reagují na to, aby H2O, takže pH příliš nemění.
Pokud se do pufrového roztoku přidá silná kyselina—zdroj iontů H+, ionty H + reagují s aniontem ze soli. Protože HC2H3O2 je slabá kyselina, není příliš ionizována. To znamená, že pokud se spousta z H+ ionty a C2H3O2− ionty jsou přítomny ve stejném roztoku, přijdou dohromady, aby HC2H3O2:
H+(aq) + C2H3O2−(aq) → HC2H3O2(aq)
Spíše než změna pH výrazně a tvorba řešení kyselé, přidané ionty H+ reagovat, aby se molekul slabé kyseliny. Obrázek 12.2 „akce vyrovnávacích pamětí“ ilustruje obě akce vyrovnávací paměti.
obrázek 12.2 akce pufrů
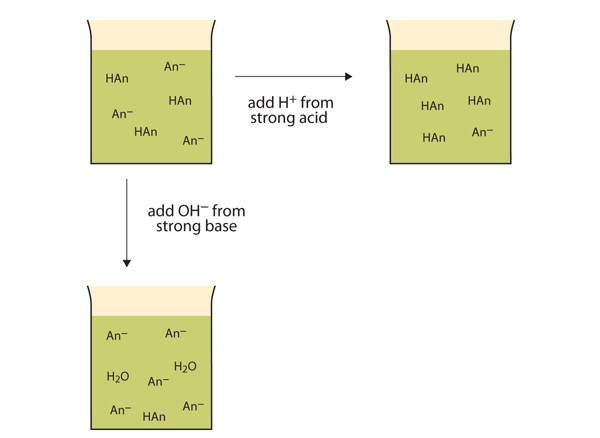
ufry mohou reagovat jak se silnými kyselinami (horní), tak se silnými bázemi (boční), aby se minimalizovaly velké změny pH.
pufry vyrobené ze slabých bází a solí slabých bází působí podobně. Například, v pufru obsahující NH3 a NH4Cl, NH3 molekuly mohou reagovat s přebytečné H+ ionty zavedené silné kyseliny:
NH3(aq) + H+(aq) → NH4+(aq)
zatímco NH4+(aq) iont může reagovat s jakýmkoliv ionty OH− zavedená silná báze.
NH4+(aq) + OH−(aq) → NH3(aq) + H2O(ℓ)
Příklad 15
jaké kombinace sloučenin může mít tlumivý roztok?
- HCHO2 a NaCHO2
- HCl a NaCl
- CH3NH2 a CH3NH3Cl
- NH3 a NaOH
Řešení
- HCHO2 je kyselina mravenčí, kyseliny, slabé kyseliny, zatímco NaCHO2 je sůl vyrobena z anion slabé kyseliny (formát ion ). Kombinace těchto dvou rozpuštěných látek by pufr.
- HCl je silná kyselina, nikoli slabá kyselina, takže kombinace těchto dvou rozpuštěných látek by nevytvářela pufrový roztok.
- CH3NH2 je methylamin, který je jako NH3 s jedním z jeho atomů H substituovaných skupinou CH3. Protože není uveden v tabulce 12.2 „silné kyseliny a zásady“, můžeme předpokládat, že je to slabá báze. Sloučenina CH3NH3Cl je sůl vyrobená z této slabé báze, takže kombinace těchto dvou rozpuštěných látek by vytvořila pufrový roztok.
- NH3 je slabá báze, ale NaOH je silná báze. Kombinace těchto dvou rozpuštěných látek by nevytvářela pufrovací roztok.
vyzkoušejte si
které kombinace sloučenin mohou vytvořit pufrový roztok?
- NaHCO3 a NaCl
- H3PO4 a NaH2PO4
- NH3 a (NH4)3PO4
- NaOH a NaCl
Odpovědi
- žádná
- ano
- ano
- žádná
Nárazníky fungují dobře pouze pro omezené množství přidané silné kyseliny nebo báze. Jakmile jedna rozpuštěná látka zcela zareaguje, roztok již není pufrem a mohou nastat rychlé změny pH. Říkáme, že vyrovnávací paměť má určitou kapacitu. Pufry, které mají více rozpuštěné látky rozpuštěné v nich začít s mají větší kapacity, jak by se dalo očekávat.
lidská krev má pufrovací systém, který minimalizuje extrémní změny pH. jeden pufr v krvi je založen na přítomnosti HCO3 – a H2CO3 . S tímto pufrem, i když by nějaká žaludeční kyselina našla cestu přímo do krevního řečiště, by změna pH krve byla minimální. Uvnitř mnoha buněk těla je pufrovací systém založený na fosfátových iontech.
jídlo a pití App: Kyselina, Která Zmírňuje Bolest
i když léky nejsou přesně „jídlo a pití“ my jsme jim potravu, takže pojďme se podívat na kyselinu, která je pravděpodobně nejčastější léky: kyselina acetylsalicylová, známý také jako aspirin. Aspirin je dobře známý jako lék proti bolesti a antipyretikum (redukce horečky).
struktura aspirinu je znázorněna na přiloženém obrázku. Kyselá část je zakroužkována; je to atom H v této části, který může být darován, protože aspirin působí jako kyselina Brønsted-Lowry. Protože není uvedena v tabulce 12.2 „silné kyseliny a Zásady“, kyselina acetylsalicylová je slabá kyselina. Je to však stále kyselina a vzhledem k tomu, že někteří lidé konzumují relativně velké množství aspirinu denně, může jeho kyselá povaha způsobit problémy v žaludeční výstelce, navzdory obraně žaludku proti vlastní žaludeční kyselině.
Obrázek 12.3 Molekulární Struktura Aspirin
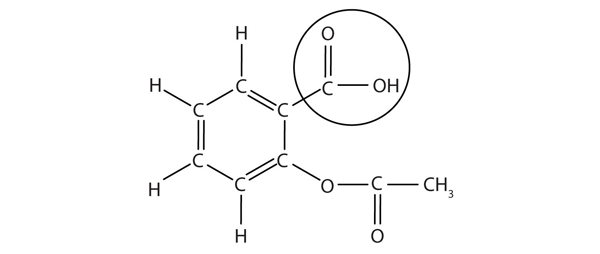
kroužil atomy jsou kyselina část molekuly.
protože kyselé vlastnosti aspirinu mohou být problematické, mnoho značek aspirinu nabízí“ pufrovanou aspirinovou “ formu léku. V těchto případech obsahuje aspirin také pufrovací činidlo-obvykle MgO -, které reguluje kyselost aspirinu, aby se minimalizovaly jeho kyselé vedlejší účinky.
jak užitečný a běžný jako aspirin je, byl formálně uváděn na trh jako lék od roku 1899. US Food and Drug Administration (FDA), vládní agentura pověřená dohledem a schvalováním drog ve Spojených státech, vznikla až v roce 1906. Někteří tvrdí, že pokud FDA byl vytvořen dříve, než aspirin byl představen, aspirin může nedostal schválení vzhledem k jeho potenciálu pro vedlejší účinky—gastrointestinální krvácení, zvonění v uších, Reyův syndrom (potíže s játry), a některé alergické reakce. Nicméně, v poslední době aspirin byl nabízen pro jeho účinky při snižování infarktu a mrtvice, takže je pravděpodobné, že aspirin je tady zůstat.
Klíčové cesty
- pufr je řešení, které odolává náhlým změnám pH.
cvičení
-
Definujte vyrovnávací paměť. Jaké dvě související chemické složky jsou potřebné k vytvoření pufru?
-
lze vytvořit pufr kombinací silné kyseliny se silnou bází? Proč nebo proč ne?
-
které kombinace sloučenin mohou vytvořit pufr? Předpokládejme vodné roztoky.
a) HCl a NaCl
b) HNO2 a NaNO2
c) NH4NO3 a HNO3
d) NH4NO3 a NH3
4. Které kombinace sloučenin mohou vytvořit pufr? Předpokládejme vodné roztoky.
a) H3PO4 a Na3PO4
b) NaHCO3 a Na2CO3
c) NaNO3 a Ca(NO3)2,
d) HN3 a NH3
5. Pro každou kombinaci v cvičení 3, která je pufrem, napište chemické rovnice pro reakce složek pufru, když se přidá silná kyselina a silná báze.
6. Pro každou kombinaci v cvičení 4, která je pufrem, napište chemické rovnice pro reakce složek pufru, když se přidá silná kyselina a silná báze.
7. Kompletní fosfátový pufrový systém je založen na čtyřech látkách: H3PO4, H2PO4−, HPO42− a PO43−. Jaké různé pufrové roztoky lze z těchto látek vyrobit?
8. Vysvětlete, proč NaBr nemůže být složkou kyselého ani zásaditého pufru.
9. Jsou vyrobeny dva roztoky obsahující stejné koncentrace rozpuštěných látek. Jeden roztok se skládá z H3PO4 a Na3PO4, zatímco druhý je složen z HCN a NaCN. Které řešení by mělo mít větší kapacitu jako pufr?
10. Jsou vyrobeny dva roztoky obsahující stejné koncentrace rozpuštěných látek. Jedno řešení se skládá z NH3 a NH4NO3, zatímco druhé se skládá z H2SO4 a Na2SO4. Které řešení by mělo mít větší kapacitu jako pufr?
odpovědi
pufr je kombinací slabé kyseliny nebo báze a soli této slabé kyseliny nebo báze.
) žádný
b) ano,
c)
d) ano,
3b: silná kyselina: NO2− + H+ → HNO2; silná základna: HNO2 + OH− → NO2− + H2O; 3d: silná základna: NH4+ + OH− → NH3 + H2O; silná kyselina: NH3 + H+ → NH4+7.
vyrovnávací paměti mohou být vyrobeny ze tří kombinací: (1) H3PO4 a H2PO4−, (2) H2PO4− a HPO42−, a (3) HPO42− a PO43−. (Technicky může být vyrovnávací paměť vyrobena z libovolných dvou složek.)
fosfátový pufr by měl mít větší kapacitu.