2.1: Vývoj Atomové Teorie
Atomové Teorie po Devatenáctého Století
ohledu na to, Jestli byly složeny z atomů, co byly atomy se skládají z? Byly to nejmenší částice, nebo bylo něco menšího? V pozdních 1800s, řada vědců se zajímá o otázky, jako jsou tyto zkoumal elektrické výboje, které by mohly být vyráběny v low-tlak plynů, s nejvýznamnější objev učinil anglický fyzik j. J. Thomson pomocí katodové trubice. Toto zařízení sestávalo z uzavřené skleněné trubice, ze které byl odstraněn téměř veškerý vzduch; trubka obsahovala dvě kovové elektrody. Když bylo na elektrody aplikováno vysoké napětí, objevil se mezi nimi viditelný paprsek zvaný katodový paprsek. Tento paprsek byl vychýlen směrem k kladnému náboji a od záporného náboje a byl vyroben stejným způsobem se stejnými vlastnostmi, když byly pro elektrody použity různé kovy. V podobné experimenty, ray byl současně vychýlen aplikovaného magnetického pole a měření míry deformace a síly magnetického pole povoleno Thomson k výpočtu poplatku,-k-hmotnostní poměr katodové částice. Výsledky těchto měření ukázaly, že tyto částice byly mnohem lehčí než atomy (obrázek \(\PageIndex{1}\)).
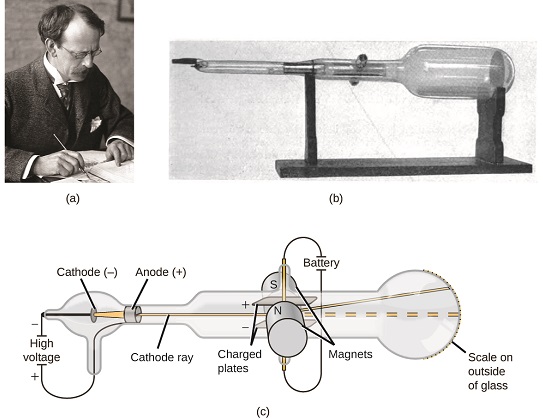
Obrázek \(\PageIndex{5}\): (a) j. J. Thomson produkoval viditelné paprsku v katodové trubice. b) jedná se o ranou katodovou trubici, vynalezenou v roce 1897 Ferdinandem Braunem. (c) V katodové, paprsek (zobrazeny žlutě) pochází z katody a urychlené minulosti anoda směrem fluorescenční měřítku na konci trubice. Současné výchylky aplikovanými elektrickými a magnetickými poli umožnily Thomsonovi vypočítat poměr hmotnosti k náboji částic tvořících katodový paprsek. (kredit: úprava práce tím, že Nobelova Nadace; credit b: změna práce Eugen Nesper; kreditní c: změna práce „Kurzon“/Wikimedia Commons).
na Základě svého pozorování, zde je to, co Thomson navrhl a proč: částice jsou přitahovány kladné (+) poplatky a odrazil tím, negativní (−) poplatky, a proto musí být negativně nabité (jako náboje odpuzují a opačné náboje se přitahují); jsou méně masivní než atomy a k nerozeznání, bez ohledu na zdroj materiálu, a proto musí být zásadní, subatomární složek všech atomů. I když kontroverzní v době, Thomson nápad byl postupně přijat, a jeho katodové částice, je to, co dnes nazýváme elektron, záporně nabitá, subatomové částice s hmotností více než jeden tisíc krát méně, že z atomu. Termín „elektron“ byl vytvořen v roce 1891 irským fyzikem Georgem Stoneym z „elektrického iontu“.“
V roce 1909, více informací o elektron byl odkryt Americký fyzik Robert a. Millikanův přes jeho „kapku oleje“ experimenty. Millikanův vytvořené mikroskopické kapičky oleje, které by mohly být elektricky nabité třením, jak se tvoří nebo pomocí X-paprsky. Tyto kapičky zpočátku padaly kvůli gravitaci, ale jejich postup směrem dolů mohl být zpomalen nebo dokonce obrácen elektrickým polem nižším v aparátu. Úpravou síly elektrického pole a pečlivým měřením a vhodnými výpočty byl Millikan schopen určit náboj na jednotlivých kapkách (obrázek \(\PageIndex{2}\)).
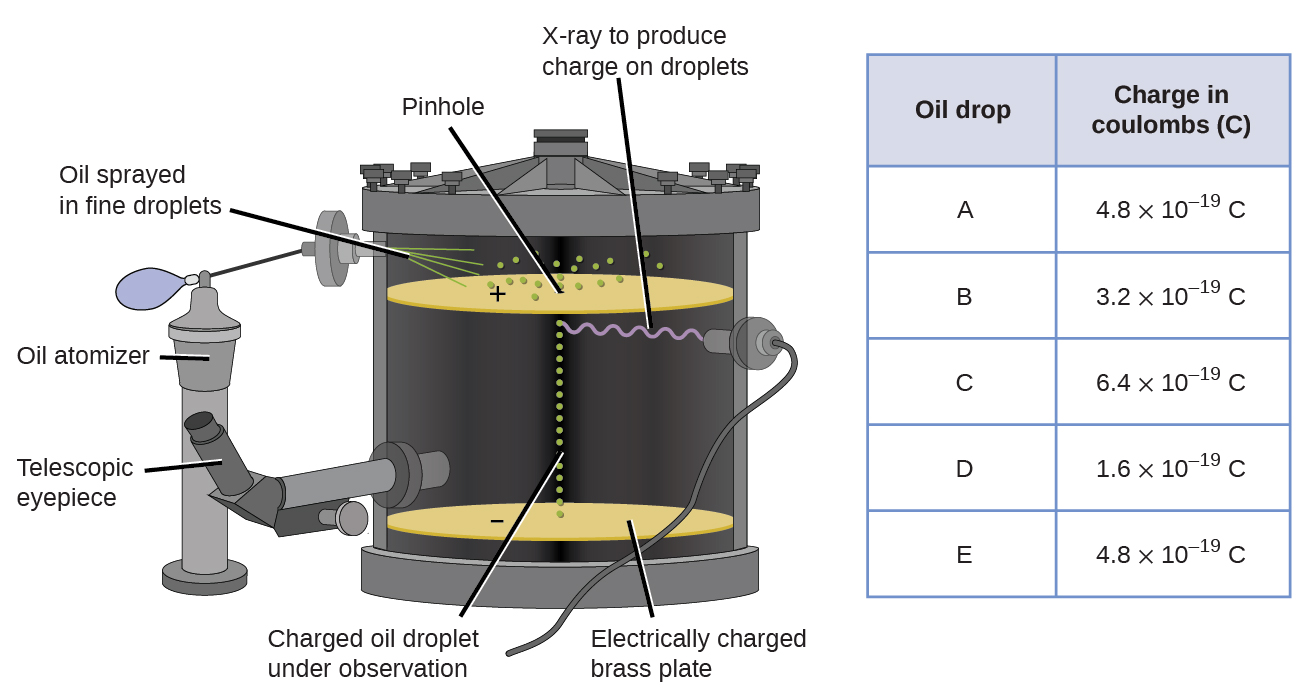
Obrázek \(\PageIndex{6}\): Millikanův experiment měří náboj jednotlivých kapek oleje. Tabulková data jsou příklady několika možných hodnot.
při Pohledu na náboj data, která Millikanův shromáždili, můžete si uvědomili, že náboj olejové kapky je vždy násobkem konkrétní obvinění, 1.6 \(\times\) 10-19 C. Millikanův k závěru, že tato hodnota musí být proto základní náboj—náboj elektronu—s jeho měřené poplatků v důsledku nadměrné jeden elektron (1 krát 1.6 \(\krát\) 10-19 C), dva elektrony (2 krát 1,6 \(\krát\) 10-19 C), tři elektrony (3 krát 1,6 \(\krát\) 10-19 C) a tak dále, na dané kapce oleje. Protože náboj elektronu byl nyní známý díky Millikanův výzkumu a poplatku,-k-hmotnostní poměr byl již známý díky Thomson výzkumu (1.759 \(\times\) 1011 C/kg), je nutné pouze jednoduchým výpočtem určit hmotnost elektronu jako no.
\
Vědci se nyní zjištěno, že atom není nedělitelný, jak Dalton věřil, a vzhledem k práci Thomson, Millikanův, a další, náboj a hmotnost negativní, subatomární částice—elektrony—jsou známé. Kladně nabitá část atomu však ještě nebyla dobře pochopena. V roce 1904, Thomson navrhl „vánoční pudink“ model atomů, které popsal kladně nabité hmoty s stejné množství negativního náboje ve formě elektronů v něm obsažen, protože všechny atomy jsou elektricky neutrální. Konkurenční model byl navržen v roce 1903 Hantaro Nagaoka, který postuloval Saturn-jako atom, skládající se z kladně nabité koule obklopené svatozáří elektronů (Obrázek \(\PageIndex{3}\)).
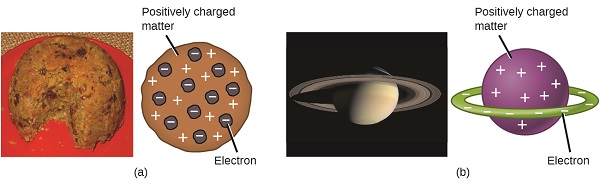
Obrázek \(\PageIndex{7}\): (a) Thomson navrhl, že atomy se podobal švestkový pudink, anglický dezert se skládá z vlhké dort s vloženými rozinky („švestky“). (b) Nagaoka navrhl, že atomy se podobaly planetě Saturn, s kruhem elektronů obklopujícím pozitivní „planetu“.“(kredit a: modifikace práce „Man vyi“ / Wikimedia Commons; kredit b: modifikace práce „NASA“ / Wikimedia Commons).
další významný vývoj v porozumění atomu přišel od Ernesta Rutherforda, fyzika z Nového Zélandu, který z velké části strávil svou vědeckou kariéru v Kanadě a Anglii. Provedl sérii experimentů za použití paprsku o vysoké rychlosti, kladně nabité alfa částice (α částice), které byly produkované radioaktivním rozpadem radia; α částice se skládají ze dvou protonů a dvou neutronů (dozvíte se více o radioaktivní rozpad v kapitole o jaderné chemie). Rutherford a jeho kolegové Hans Geiger (později známý Geigerův počítač) a Ernest Marsden zaměřený paprsek α částice, zdroj, který byl vložen do olověného bloku, aby absorbovat většinu záření, na velmi tenký kus zlaté fólie a zkoumal výsledný rozptyl α částic pomocí luminiscenční obrazovce, která zářila krátce, kde zasáhla α částic.
co objevili? Většina částic prošla přímo fólií, aniž by byla vůbec vychýlena. Některé však byly mírně odkloněny a velmi malé číslo bylo odkloněno téměř přímo zpět ke zdroji (obrázek \(\PageIndex{4}\)). Rutherford popsal zjištění těchto výsledků: „byla to naprosto nejneuvěřitelnější událost, která se mi v životě stala. Bylo to skoro stejně neuvěřitelné, jako kdybyste vystřelili 15palcovou skořápku na kus hedvábného papíru a vrátil se a zasáhl vás “ 1 (s. 68).
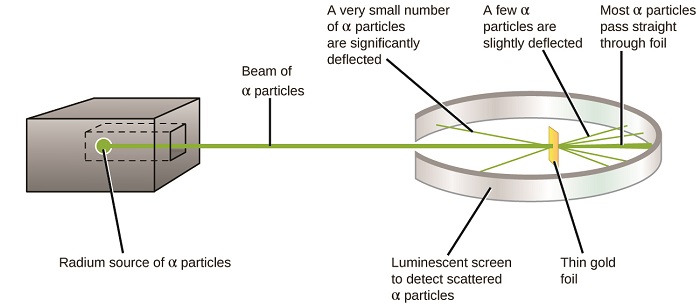
Obrázek \(\PageIndex{8}\): Rutherford, Geiger a vystřelil α částic na kus zlaté fólie a zjistil, kde se tyto částice šel, jak je znázorněno v tomto schématu jejich experimentu. Většina částic prošla přímo fólií, ale několik z nich bylo mírně vychýleno a velmi malé množství bylo významně vychýleno.
zde je to, co Rutherford odvodil: protože většina rychle se pohybujících α částic prošla atomy zlata nepozorovaně, musely cestovat v podstatě prázdným prostorem uvnitř atomu. Alfa částice jsou kladně nabité, takže výchylky vznikly, když se setkaly s jiným kladným nábojem(jako náboje se navzájem odpuzují). Od náboje odpuzují jeden na druhého, na pár kladně nabité α částice, které změnily cesty náhle musí mít hit, nebo úzce se přiblížil, jiný orgán, který měl také vysoce koncentrovaný, kladný náboj. Vzhledem k tomu, že výchylky nastaly malý zlomek času, tento náboj zabíral pouze malé množství prostoru ve zlaté fólii. Při podrobné analýze řady takových experimentů Rutherford vyvodil dva závěry:
- objem obsazený atomem musí sestávat z velkého množství prázdného prostoru.
- malé, relativně těžké, kladně nabité tělo, jádro, musí být ve středu každého atomu.
Tato analýza vedla Rutherford navrhl model, ve kterém atom se skládá z velmi malého, kladně nabitého jádra, ve kterém je většina hmoty atomu je soustředěna, obklopena záporně nabité elektrony, a to tak, že atom je elektricky neutrální (viz Obrázek \(\PageIndex{5}\)).
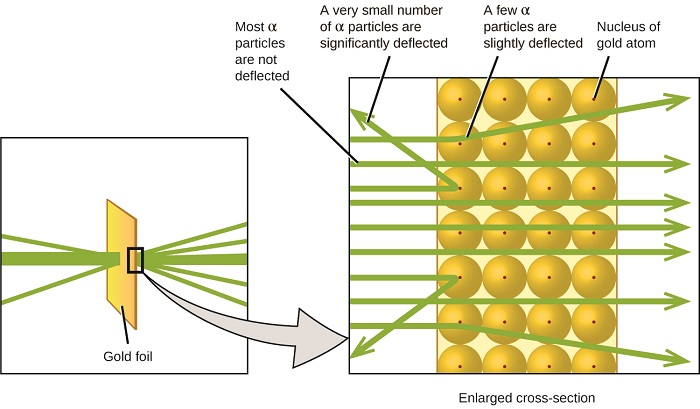
Obrázek \(\PageIndex{9}\): α částice jsou odraženy pouze, když se srazí s nebo projít blízko k mnohem těžší, kladně nabité jádro zlata. Vzhledem k tomu, že jádro je ve srovnání s velikostí atomu velmi malé,je vychýleno jen velmi málo částic α. Většina projít poměrně velké oblasti obsazené elektrony, které jsou příliš lehké odvrátit rychle se pohybující částice.
Po mnoho dalších experimentů, Rutherford také zjistili, že jádra jiných prvků obsahují jádro vodíku jako „stavební blok“, a on jmenoval to více základních částic, protonu, kladně nabité, subatomární částice, která se nachází v jádře. S jedním přírůstkem, který se dozvíte dále, se tento jaderný model atomu, navržený před více než stoletím, používá dodnes.
dalším důležitým zjištěním byl objev izotopů. Během počátku roku 1900 vědci identifikovali několik látek, které se zdály být novými prvky a izolovaly je od radioaktivních rud. Například „nový prvek“ produkovaný radioaktivním rozpadem thoria byl zpočátku pojmenován mesothorium. Podrobnější analýza však ukázala, že mezotorium bylo chemicky identické s radiem (dalším produktem rozpadu), přestože mělo jinou atomovou hmotnost. Tento výsledek, spolu s podobnými závěry pro další prvky, led anglický chemik Frederick Soddy si uvědomit, že prvek mohl typy atomů s různou hmotností, které byly chemicky nerozlišitelné. Tyto různé typy se nazývají izotopy-atomy stejného prvku, které se liší hmotností. Soddy získal Nobelovu cenu za chemii v roce 1921 za tento objev.
zůstala jedna hádanka: bylo známo, že jádro obsahuje téměř veškerou hmotnost atomu, přičemž počet protonů poskytuje pouze polovinu nebo méně této hmotnosti. Byly předloženy různé návrhy, které vysvětlují, co představuje zbývající hmotu, včetně existence neutrálních částic v jádru. Jak se dalo očekávat, odhalování nenabité částice je velmi náročné, a to bylo až v roce 1932 James Chadwick našel důkazy, neutronů, nenabité, subatomární částice s hmotností přibližně stejnou jako protony. Existence neutronu také vysvětlila izotopy: liší se hmotností, protože mají různé počty neutronů, ale jsou chemicky identické, protože mají stejný počet protonů. To bude podrobněji vysvětleno později v této jednotce.