5.3: Lewis Diagramy
Lewis používá jednoduché diagramy (dnes nazývané Lewis diagramy) sledovat, kolik elektronů byly přítomny v nejvzdálenějších, nebo valence shell daného atomu. Jádro atomu, tj. jádro spolu s vnitřními elektrony, je reprezentováno chemickým symbolem a pouze valenční elektrony jsou kresleny jako tečky obklopující chemický symbol. Takže tři atomy znázorněné na obrázku 1 z elektronů a Valence mohou být reprezentovány následujícími Lewisovými diagramy:
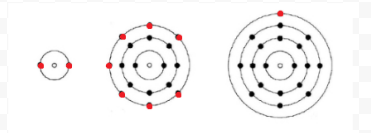

Pokud je atom atomem vzácného plynu, jsou možné dva alternativní postupy. Buď můžeme považovat atom za nulové valenční elektrony, nebo můžeme považovat nejvzdálenější vyplněnou skořápku za valenční skořápku. První tři vzácné plyny lze tedy zapsat jako:
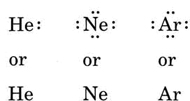
Například \(\PageIndex{1}\): Lewis Struktury
Nakreslit Lewis diagramy pro atom každého z následujících prvků: Li, N, F, na
řešení
z periodické tabulky uvnitř předního krytu zjistíme, že Li má atomové číslo 3. Obsahuje tedy tři elektrony, o jeden více než vzácný plyn He. To znamená, že vnější nebo valenční skořápka obsahuje pouze jeden elektron a Lewisův diagram je
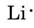
Po stejné uvažování, N má sedm elektronů, o pět víc než On, zatímco F má devět elektronů, sedm více než On, což
![]()
Na má o devět elektronů více než on, ale osm z nich je v jádře, což odpovídá osmi elektronům v nejvzdálenější skořápce Ne. Protože Na má pouze 1 více elektronů než Ne, jeho Lewis diagram je
![]()
Všimněte si z předchozího příkladu, že Lewisovy diagramy alkalických kovů jsou identické s výjimkou jejich chemických symbolů. To pěkně souhlasí s velmi podobným chemickým chováním alkalických kovů. Podobně, Lewis diagramy pro všechny prvky v jiných skupinách, jako jsou alkalické zeminy nebo halogeny, vypadají stejně.
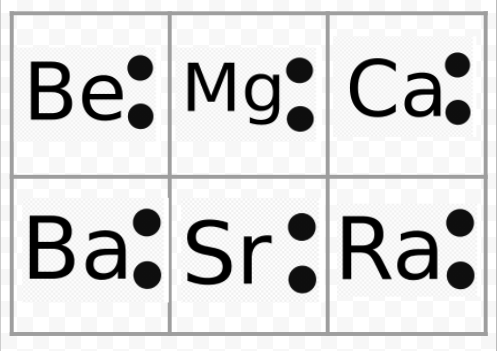
Lewis diagramy může být také použit k předpovědět valence prvků. Lewis navrhl, že počet valence atomu se rovná počtu elektronů ve valenční nebo počet elektronů které by měly být přidány do valence shell k dosažení elektronické shell struktury vedle vzácných plynů. Jako příklad této myšlenky, zvažte prvky a O Jejich Lewis diagramy a ty vzácné plyny He a Ne,

ve srovnání s he vidíme, že první má další dva elektrony,a proto by měl mít valenci 2. Lze očekávat, že prvek O bude mít valenci 6 nebo valenci 2, protože má šest valenčních elektronů-dva menší než Ne. Pomocí pravidel valence vyvinutých tímto způsobem byl Lewis schopen vysvětlit pravidelné zvyšování a snižování indexů sloučenin v tabulce nalezené v sekci Valence a zde reprodukovány. Kromě toho byl schopen odpovídat za více než 50 procent vzorců v tabulce. (Ti, kteří souhlasí s jeho nápady, jsou v tabulce barevně zastíněni. Možná budete chtít odkazovat na tuto tabulku a ověřit, že některé z uvedených vzorců se řídí Lewisovými pravidly.) Lewisův úspěch v této souvislosti jasně naznačil, že elektrony byly nejdůležitějším faktorem při držení atomů pohromadě, když se molekuly tvořily.
navzdory těmto úspěchům existují v Lewisových teoriích také potíže, zejména pro prvky mimo vápník v periodické tabulce. Prvek Br (Z = 35) má například 17 více elektronů než ar ušlechtilého plynu (Z = 18). To nás vede k závěru, že Br má 17 valenčních elektronů, což je nepříjemné vysvětlovat, proč Br podobá Cl a F tak úzce, i když tyto dva atomy mají pouze sedm valenčních elektronů.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, a Adam Hahn.