chemie pro Non-Majors
jak se mění energie tohoto pracovníka, když stoupá nahoru a dolů po žebříku?
lezení po žebříku vyžaduje energii. Na každém kroku se tlačíte proti gravitaci a hromadíte potenciální energii. Návrat dolů uvolňuje tuto potenciální energii, když sestupujete krok za krokem. Pokud si nejste opatrní, můžete uvolnit tuto potenciální energii najednou, když spadnete ze žebříku(nikdy dobrý nápad). Kromě toho budete mít stoupání nebo sestup v krocích. Na žebříku není žádná pozice“ mezi “ -vaše noha buď zasáhne příčku, nebo zasáhne prázdné místo a máte potíže, dokud nenajdete příčku, na které byste mohli stát.

v Návaznosti na objevy vodíku emisní spektra a fotoelektrického jevu, dánský fyzik Niels Bohr (1885-1962) navrhl nový model atomu, v roce 1915. Bohr navrhl, že elektrony nevyzařují energii, když obíhají kolem jádra, ale existují ve stavech konstantní energie, které nazval stacionární stavy. To znamená, že elektrony obíhají v pevné vzdálenosti od jádra(viz obrázek níže). Bohrova práce byla primárně založena na emisních spektrech vodíku. Toto je také označováno jako planetární model atomu. Vysvětlila vnitřní fungování atomu vodíku. Bohr získal Nobelovu cenu za fyziku v roce 1922 za svou práci.
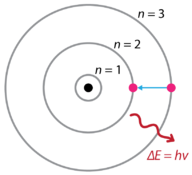
Obrázek 1. Bohrův atomový model spektra emisí vodíku.
Bohr vysvětlil, že elektrony mohou být přesunuty do různých oběžných drah s přídavkem energie. Když je energie odstraněna, elektrony se vracejí zpět do svého základního stavu a emitují odpovídající množství energie-kvantum světla nebo foton. To byl základ pro to, co se později stalo známým jako kvantová teorie . Jedná se o teorii založenou na principu, že hmota a energie mají vlastnosti částic i vln. Představuje širokou škálu fyzikálních jevů, včetně existence diskrétních paketů energie a hmoty, principu nejistoty a principu vyloučení.
Podle Bohrova modelu, často označován jako planetární model, elektrony obíhají jádro atomu v určitých přípustných cest zvané oběžné dráhy. Když je elektron v jedné z těchto oběžných drah, jeho energie je pevná. Základní stav atomu vodíku, kde je jeho energie nejnižší, je, když je elektron na oběžné dráze, která je nejblíže k jádru. Oběžné dráhy, které jsou dále od jádra, mají postupně větší energii. Elektron nesmí zabírat žádný z prostorů mezi oběžnými drahami. Každodenní analogií k modelu Bohr jsou příčky žebříku. Jak se pohybujete nahoru nebo dolů po žebříku, můžete zabírat pouze určité příčky a nemůžete být v mezerách mezi příčkami. Pohyb po žebříku zvyšuje vaši potenciální energii, zatímco pohyb po žebříku snižuje vaši energii.
Bohrova práce měla silný vliv na naše moderní chápání vnitřního fungování atomu. Jeho model však dobře fungoval pro vysvětlení emisí atomu vodíku, ale byl vážně omezen, když byl aplikován na jiné atomy. Krátce poté, co Bohr zveřejnil svůj planetární model atomu, bylo učiněno několik nových objevů, což mělo za následek, opět, revidovaný pohled na atom.
shrnutí
- Bohrův model předpokládá, že elektrony obíhají kolem jádra na pevných úrovních energie.
- oběžné dráhy dále od jádra existují při vyšších energetických hladinách.
- když se elektrony vrátí na nižší energetickou úroveň, emitují energii ve formě světla.
Cvičení
Použijte níže uvedený odkaz a odpovězte na následující otázky:
- Jak se elektron změna oběžné dráhy?
- na čem byl založen Bohrův model?
- co Bohr věřil o oběžných drahách?
- funguje Bohrův model pro všechny atomy?
recenze
- kdy Bohr navrhl svůj model atomu?
- co je stacionární stav?
- jaký je základní stav?
- může elektron zabírat nějaký prostor mezi oběžnými dráhami?
Glosář
- planetární model: způsob, jak popsat Bohrův model atomu.
- kvantová teorie: hmota a energie mají vlastnosti částic i vln.
- stacionární stav: elektrony obíhají v pevné vzdálenosti od jádra.