Entalpie a chemické reakce
7.3 entalpie a chemické reakce
cíle učení
- definují entalpii.
- správně vyjadřuje změnu entalpie chemických reakcí.
- vysvětlete, jak se experimentálně měří změny entalpie.
Nyní, když jsme ukázali, jak souvisí energie, práce a teplo, jsme připraveni zvážit energetické změny v chemických reakcích. Základní koncept je, že každá chemická reakce nastává se současnou změnou energie. Nyní se musíme naučit, jak správně vyjádřit tyto energetické změny.
Naše studie plynů v Kapitole 6 „Plyny“ a naše definice práce v kapitole 7.2 „Práce a Teplo“, ukazují, že podmínky, jako je tlak, objem a teplota ovlivňují obsah energie systému. Potřebujeme definici energie, která platí, když jsou některé z těchto podmínek specifikovány(poněkud podobné naší definici standardní teploty a tlaku v naší studii plynů). Definujeme změnu entalpieteplo procesu při konstantním tlaku; označeno ΔH. (ΔH) jako teplo procesu, když je tlak udržován konstantní:
ΔH≡QAT konstantní tlak
písmeno H znamená „entalpie“, druh energie, zatímco Δ znamená změnu množství. Vždy nás bude zajímat změna H, spíše než absolutní hodnota samotného H.
když dojde k chemické reakci, dochází k charakteristické změně entalpie. Změna entalpie pro reakci se obvykle zapisuje po vyvážené chemické rovnici a na stejném řádku. Například, když dva mol vodíku reagují s jedním molem kyslíku za vzniku dvou mol vody, charakteristická změna entalpie je 570 kJ. Napíšeme rovnice,
2H2(g) + O2(g) → 2H2O(ℓ) ΔH = -570 kJ
chemická rovnice, která zahrnuje změnu entalpie je tzv. termochemických equationA chemické rovnice, která zahrnuje změnu entalpie.. Předpokládá se, že termochemická rovnice odkazuje na rovnici v molárních množstvích, což znamená, že musí být interpretována z hlediska molů, nikoli jednotlivých molekul.
Příklad 5
zapište termochemické rovnice pro reakce PCl3(g) Cl2(g) PCl5(g), který má entalpie změna -88 kJ.
Řešení
termochemická rovnice je
PCl3(g) + Cl2(g) → PCl5(g) ΔH = -88 kJ
Otestujte Sami sebe,
zapište termochemické rovnice pro reakci N2(g) O2(g) 2NO(g), který má změnu entalpie 181 kJ.
odpověď
N2(g) + O2 (g) → 2NO (g) ΔH = 181 kj
možná jste si všimli, že ΔH pro chemickou reakci může být pozitivní nebo negativní. Předpokládá se, že číslo je kladné, pokud nemá žádné znaménko; znaménko + lze přidat explicitně, aby nedošlo k záměně. Chemická reakce, která má pozitivní ΔH, se říká, že je endotermickáchemická reakce, která má pozitivní změnu entalpie., zatímco chemická reakce, která má negativní ΔH, je považována za exotermickouchemická reakce, která má negativní změnu entalpie..
Co to znamená, pokud je ΔH procesu pozitivní? To znamená, že systém, ve kterém dochází k chemické reakci, získává energii. Pokud uvážíme, že energie systému, jako je reprezentován jako výšky na vertikální energie pozemku, změnu entalpie, která doprovází reakce může být diagrammed jako v části (a) na Obrázku 7.3 „Reakční Energie“: energie reaktantů má nějakou energii, a systém zvyšuje jeho energii, jak to chodí na výrobky. Produkty jsou ve svislém měřítku vyšší než reaktanty. Endotermické pak znamená, že systém získává nebo absorbuje energii.
pro exotermický proces existuje opačná situace, jak je znázorněno v části b) na obrázku 7.3 „reakční energie“. Pokud je změna entalpie reakce negativní, systém ztrácí energii, takže produkty mají méně energie než reaktanty a produkty jsou na vertikální energetické stupnici nižší než reaktanty. Exotermní pak znamená, že systém ztrácí nebo vydává energii.
Obrázek 7.3 Reakci Energii,
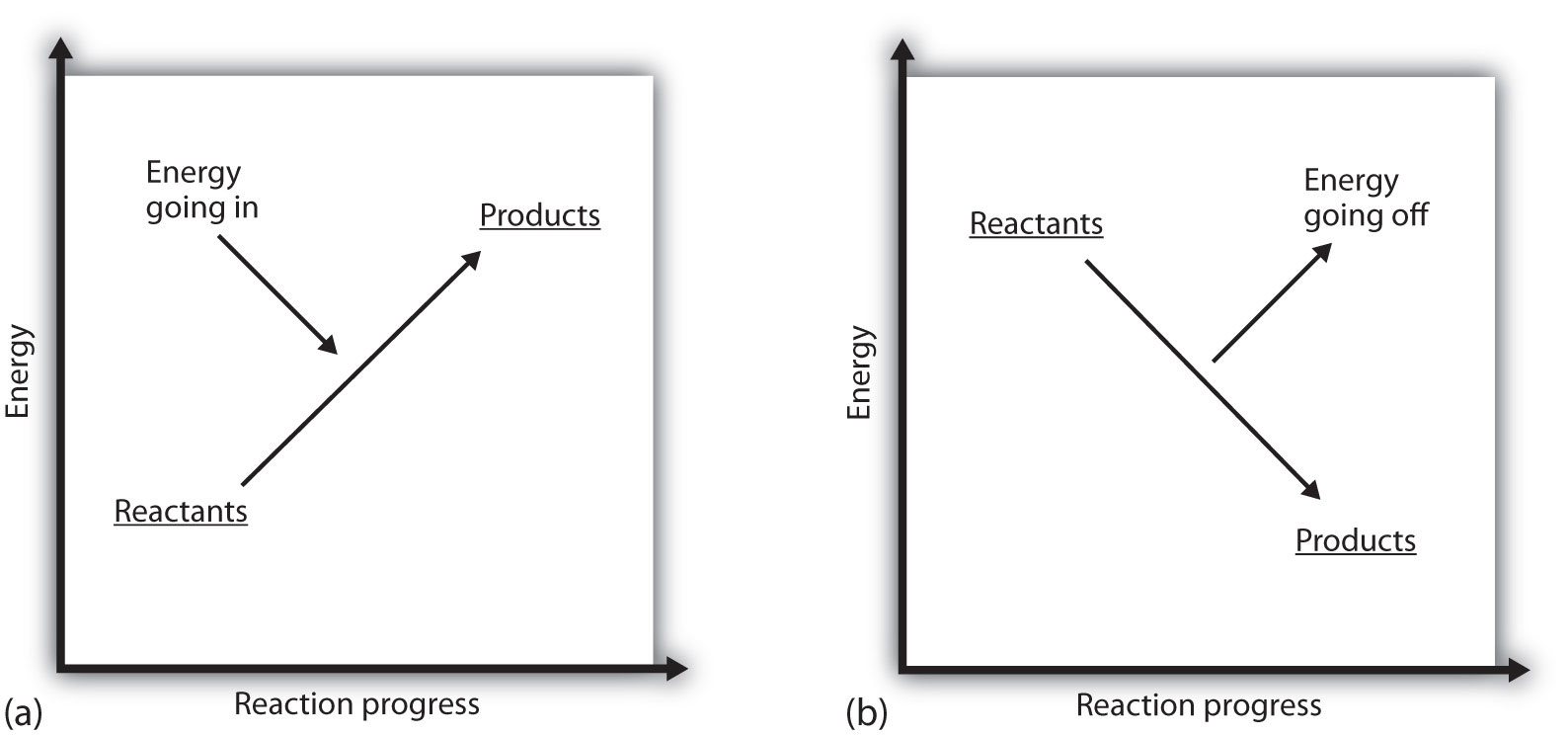
(a) endotermická reakce, energie systému se zvyšuje (tj. pohybuje vyšší, na svislé stupnici energie). (b) při exotermní reakci se energie systému snižuje (tj. pohybuje se níže ve svislém měřítku energie).
příklad 6
zvažte tuto termochemickou rovnici.
2CO(g) + O2(g) → 2CO2 (g) ΔH = -565 kj
je to exotermické nebo endotermické? Kolik energie se vydává nebo absorbuje?
Řešení
Podle definice, chemické reakce, která má negativní ΔH je exotermní, což znamená, že tolik energie—v tomto případě, 565 kJ—je dána reakce.
Otestujte se
zvažte tuto termochemickou rovnici.
CO2 (g) + H2 (g) → CO (g) + H2O (g) ΔH = 42 kj
je to exotermické nebo endotermické? Kolik energie se vydává nebo absorbuje?
odpověď
endotermické; 42 kJ jsou absorbovány.
Jak se experimentálně měří hodnoty ΔH? Ve skutečnosti se ΔH neměří; q se měří. Měření se však provádějí za podmínek konstantního tlaku, takže ΔH se rovná měřené q.
experimentálně se q měří pomocí rovnice
q = mcΔT
předem změříme hmotnost chemických látek v systému. Pak necháme chemickou reakci a změříme změnu teploty (ΔT) systému. Pokud víme, že specifické teplo materiálu v systému (obvykle děláme), můžeme vypočítat q. Že hodnota q je číselně rovna ΔH procesu, který můžeme škálovat až na molární měřítku. Kontejner, ve kterém je systém umístěn, je obvykle izolován, takže jakákoli změna energie jde do změny teploty systému, spíše než unikání ze systému. Nádoba je označována jako kalorimetrická nádobakontejner používaný k měření tepla chemické reakce., a proces měření změn entalpie se nazývá kalorimetrieproces měření změn entalpie pro chemické reakce..
Obrázek 7.4 Kalorimetry
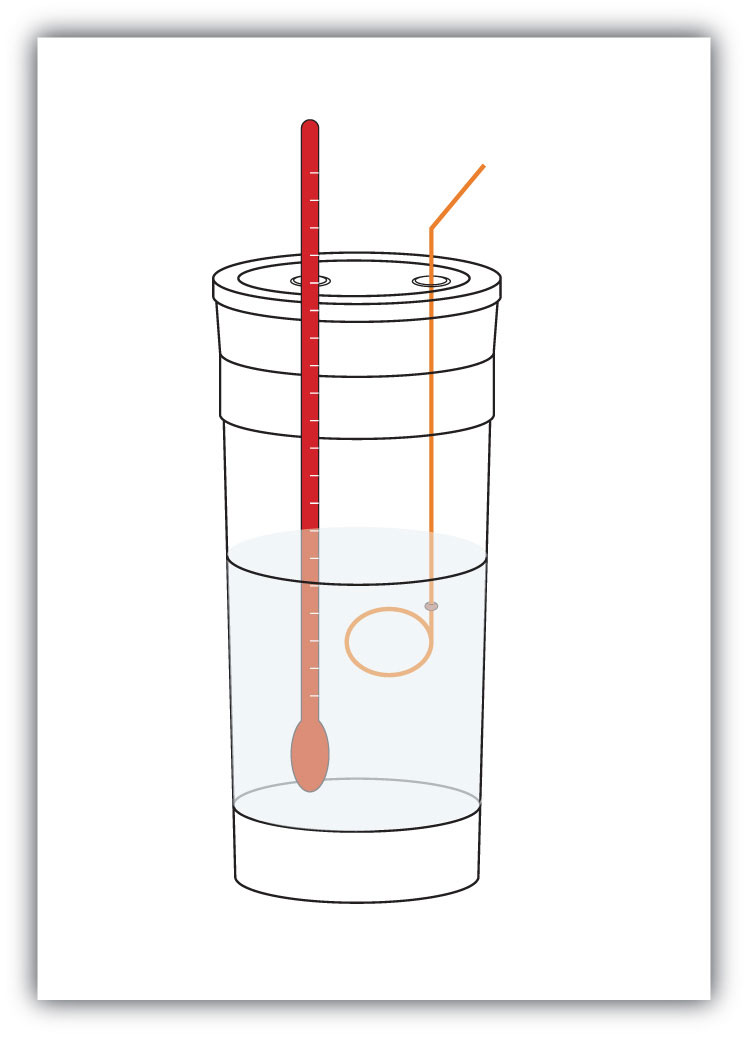
jednoduchý kalorimetr může být vyrobeno z nějaké vnořené pěny šálků kávy, kryt, teploměr a míchadlo.
například, předpokládejme, 4,0 g NaOH, nebo 0,10 mol NaOH, se rozpustí, aby se 100.0 mL vodného roztoku, zatímco 3.65 g HCl, nebo 0,10 mol HCl, se rozpustí, aby se další 100,0 mL vodného roztoku. Oba roztoky se smíchají v izolovaném kalorimetru, vloží se teploměr a kalorimetr se zakryje (viz obrázek 7.4 „kalorimetry“ pro příklad nastavení). Teploměr měří teplotu změnit následující chemické reakce:
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ)
pozorovatel konstatuje, že zvýšení teploty z 22,4°C 29,1°C. za Předpokladu, že tepelné kapacity a hustoty roztoků jsou stejné jako ty, čisté vody, nyní máme informace, které potřebujeme určit změnu entalpie chemické reakce. Celkové množství roztoku je 200,0 mL a při hustotě 1,00 g / mL máme tedy 200,0 g roztoku. Pomocí rovnice pro q, dosadíme pro naše experimentální měření a specifické teplo vody (Tabulka 7.1 „Konkrétní Ohřívá Různých Látek“):
q=(200.0 g)(4.184 J g⋅°C)(6.7°C)
Řešení pro q, dostaneme
q=5,600 J≡ΔH pro reakci
teplo q je rovno ΔH pro reakci, protože chemická reakce probíhá za konstantního tlaku. Reakce však vydává toto množství energie, takže skutečné znaménko na ΔH je záporné:
ΔH = -5,600 J pro reakci
Tak, máme následující termochemická rovnice pro chemické reakce, která nastala v kalorimetru:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(aq)+110 H2O(ℓ)ΔH=-5,600 J
1/10 koeficienty jsou přítomny, aby nám připomněl, že jsme začali s desetinu krtek každý reaktant, tak jsme se jednu desetinu krtek každého produktu. Typicky však uvádíme termochemické rovnice, pokud jde o krtky, ne jednu desetinu molu. Pro měřítko až molárních veličin musíme koeficienty vynásobit 10. Když to však uděláme, dostaneme 10krát tolik energie. Tak, máme
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
ΔH lze převést do kJ jednotky, takže naše konečná termochemická rovnice je
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Máme jen vzít naše experimentální data z kalorimetrie a určuje změnu entalpie chemické reakce. Podobná měření jiných chemických reakcí mohou určit hodnoty ΔH jakékoli chemické reakce, kterou chcete studovat.
příklad 7
100 mL roztoku 0.25 mol Ca2+(aq) byl smíchán s 0.50 mol F−(aq) ionty, a CaF2 se vysráží:
Ca2+(aq) + 2F−(aq) → CaF2(s)
teplota roztoku se zvýšil o 10,5°C. Jaký byl entalpie pro chemické reakce? Jaká byla změna entalpie pro výrobu 1 mol CaF2? Předpokládejme, že roztok má stejnou hustotu a specifické teplo jako voda.
roztok
protože jsme dostali ΔT přímo, můžeme určit teplo reakce, které se rovná ΔH:
q=(100 g)(4.184 J g⋅°C) (10.5°C)
Řešení pro q, dostaneme
q = 4,400 J
Proto, ΔH = -4,400 J.
Podle stechiometrie reakce, přesně o 0,25 mol CaF2 bude tvořit, takže toto množství tepla je pro 0.25 mol. Pro 1 mol CaF2, musíme měřítku se teplo o faktor čtyři:
q = 4,400 J × 4 = 17,600 J k 1 mol CaF2
Na molární bázi, změna entalpie je
ΔH = -17,600 J = -17.6 kJ
Otestujte Sami sebe,
V kalorimetru na konstantní tlak, 0.10 mol CH4(g) a 0,20 mol O2(g) jsou reagoval.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (ℓ)
reakce se zahřeje 750.0 g H2O při 28,4°C. Co je ΔH pro reakci na molární stupnici?
odpověď
-891 kj
Klíčové cesty s sebou
- každá chemická reakce nastává se souběžnou změnou energie.
- změna entalpie se rovná teplu při konstantním tlaku.
- změny entalpie lze vyjádřit pomocí termochemických rovnic.
- změny entalpie se měří pomocí kalorimetrie.
Cvičení
-
Za jakých okolností jsou q a ΔH stejné?
-
za jakých okolností se q A ΔH liší?
-
plynný vodík a plynný chlor reagují za vzniku plynného chlorovodíku s doprovodnou změnou entalpie -184 kJ. Pro tento proces napište správně vyváženou termochemickou rovnici.
-
Propan (C3H8) reaguje s elementární kyslík plyn k produkci oxidu uhličitého a kapalné vody s doprovodným entalpie změna -2,220 kJ. Pro tento proces napište správně vyváženou termochemickou rovnici.
-
dusíkatý plyn reaguje s kyslíkovým plynem za vzniku NO (g) při absorpci 180 kJ. Pro tento proces napište správně vyváženou termochemickou rovnici.
-
Pevný chlorid reaguje s chlorem, aby se pevný chlorid sodný, přičemž z 772 kJ. Pro tento proces napište správně vyváženou termochemickou rovnici.
-
plynný vodík a plynný chlor reagují za vzniku plynného chlorovodíku s doprovodnou změnou entalpie -184 kJ. Je tento proces endotermický nebo exotermický?
-
Propan (C3H8) reaguje s elementární kyslík plyn produkují oxid uhličitý, přičemž se z 2,220 kJ energie. Je tento proces endotermický nebo exotermický?
-
dusíkatý plyn reaguje s kyslíkovým plynem za vzniku NO (g) při absorpci 180 kJ. Je tento proces exotermický nebo endotermický?
-
kovový Sodík, který může reagovat s dusíkem, aby se azid sodný (NaN3) s ΔH 21,72 kJ. Je tento proces exotermický nebo endotermický?
-
nakreslete diagram energetické hladiny pro chemickou reakci v cvičení 8. (Viz obrázek 7.3 „reakční energie“ pro příklad.)
-
nakreslete diagram energetické hladiny pro chemickou reakci v cvičení 9. (Viz obrázek 7.3 „reakční energie“ pro příklad.
-
ve 250 mL roztoku se kombinuje 0,25 mol KOH(aq) a 0,25 mol HNO3(aq). Teplota roztoku se zvyšuje z 22,5°C na 35,9°C. Předpokládejme, že roztok má stejnou hustotu a tepelnou kapacitu vody. Jaké je teplo reakce a jaká je ΔH reakce na molárním základě?
-
v 600 mL roztoku, 0.50 mol Ca(OH)2(aq) a 0,50 mol H2SO4(aq) jsou kombinovány. Teplota roztoku se zvyšuje o 22,3°C. jaké je teplo reakce a jaká je ΔH reakce na molární bázi? Předpokládejme, že roztok má stejnou hustotu a tepelnou kapacitu vody.
-
pro zahřátí 400,0 g H2O se spálí 0,050 mol ethanolu (C2H5OH). Voda se zahřeje z 24,6°C na 65,6°C. jaké je teplo reakce a jaká je ΔH reakce na molárním základě?
-
pro zahřátí 100,0 g H2O se spálí 0,066 mol včelího vosku. Voda se ohřívá od 21,4°C do 25,5°C. jaké je teplo reakce a jaká je ΔH reakce na molárním základě?
Odpovědi
-
za podmínek konstantního tlaku
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exotermní
-
endotermické
-
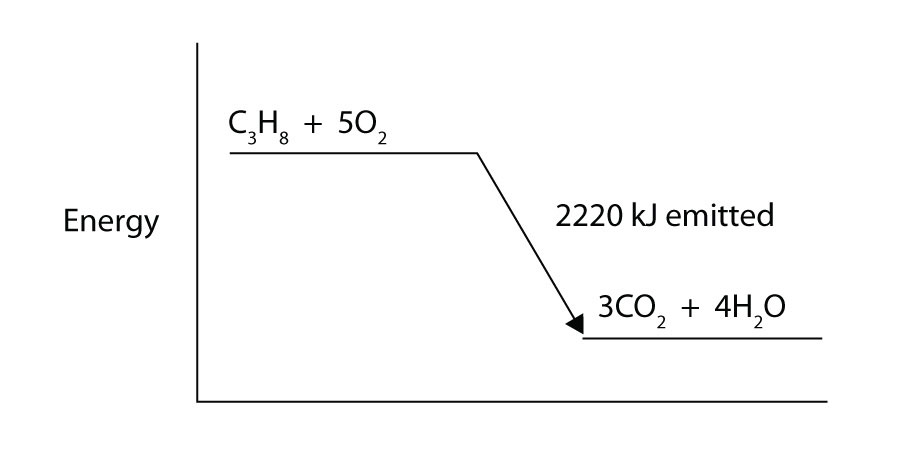
-
reakční teplo = -14.0 kJ; ΔH = -56.0 kJ/mol z reaktantů,
-
reakční teplo = -68.6 kJ; ΔH = -1,370 kJ/mol ethanolu,