podívejte se na Nejnovější články
Abstrakt
Low-output srdeční selhání (LoHF) je častou formou srdečního selhání (HF), ale ten, který signály velmi pokročilé HF. Je spojena s zlověstnou prognózou, stejně jako s podstatnou morbiditou a úmrtností. Lohf však zůstává do značné míry nedostatečně prozkoumán. Tradiční popis HF se zaměřil na městnavé srdeční selhání (CHF) označené nízkým srdečním výdejem a doprovázené plicní/periferní kongescí. Toto zaměření přispělo k nedostatečnému zhodnocení pacientů s LoHF, kteří mají malý nebo žádný důkaz o přetížení. Pacienti s LoHF navíc nemají prokázanou léčbu a výběr vhodné léčby závisí na individuální patofyziologii a základní etiologii. LoHF pacienti mají heterogenní etiologie a patofyziologie zdůrazňující význam in-hloubka pochopení z jeho klinických příznaků, diagnózy a klinické řízení, která tvoří základ tohoto přezkumu.
Klíčová slova
low-output srdeční syndrom, low-output srdeční selhání, nízký stav výstupu
Úvod
i Přes pozoruhodné pokroky v lékařské a chirurgické terapie, efektivní řízení srdeční selhání (HF) i nadále představuje významné výzvy pro poskytovatele zdravotní péče. Výzva se odráží ve vysoké míře hospitalizací souvisejících s HF spolu se zvýšenou úmrtností a morbiditou . Součástí výzvy je velmi heterogenní etiologie, patofyziologie, a klinické prezentace různých forem HF, ve kterých některé formy HF mají nedostatek údajů z klinických studií a následně omezené porozumění. Zejména tradiční popis HF byla téměř synonymem pro městnavé srdeční selhání (CHF), ale termín CHF vylučuje menšina HF pacientů, kteří mají malé nebo žádné prokazatelné příznaky plicní a/nebo periferní přetížení . Nízký výkon HF (LoHF) byl také spojen se zlověstnou prognózou a signalizuje velmi pokročilé HF. Navíc symptomatické a patofyziologické rozdíly v CHF a LoHF podporují potřebu různých přístupů klinického řízení . Navzdory těmto rozdílům byly tradiční terapie HF zobecněny na všechny formy HF včetně CHF a LoHF, což vytváří klinickou potřebu porozumět patofyziologii, diagnostice a klinickému řízení LoHF. V tomto článku, agregujeme publikované důkazy o LoHF z hlediska epidemiologie, etiologie, patofyziologie, diagnostika a klinické řízení. Záměrem je přepracovat znalosti o klinickém stavu LoHF a zlepšit klinické řízení HF obecně.
Definice
Srdeční selhání je komplexní klinický syndrom se vyznačuje strukturní a/nebo funkční infarktu vady vedoucí ke zhoršení ventrikulární plnění nebo vyhození . Složitost syndrom je evidentní v jeho heterogenní klasifikace: vpravo-vlevo – nebo bi-ventrikulární na základě vada místě; akutní nebo chronické závislosti na čase nástupu; konzervované, hraniční nebo sníženou ejekční frakce, založená na funkční stav; nízký nebo vysoký výkon na základě srdečního výdeje (CO) a dopředné nebo zpětné selhání na základě směru průtoku krve. Každá z těchto klasifikací je významná pro diagnostiku a léčbu HF . Přes několik klasifikací, termín CHF se tradičně používá zaměnitelně s HF, ale který dostatečně nepopisuje LoHF kvůli několika symptomatickým a patofyziologickým rozdílům.
LoHF, také známý jako low CO v akutní dekompenzované HF, popisuje vysokou ostrost podobě HF vyznačuje sníženou dopředu CO (srdeční index < 2.0 L / min / m2 a systolický krevní tlak < 90 mmHg) a hypoperfúze koncových orgánů s malým nebo žádným důkazem plicní kongesce . Lohf se liší od CHF, který popisuje HF charakterizovaný sníženým CO způsobujícím plicní a periferní kongesci vedoucí k dušnosti a perifernímu edému. Pokyny Evropské kardiologické společnosti (ESC) z roku 2005 pro diagnostiku a léčbu HF naznačují kontinuum od syndromu nízkého srdečního výdeje (LCOS) po LoHF až po kardiogenní šok. ESC pokyny definovat kardiogenní šok jako důkaz prokrvení tkání vyvolané HF po korekci na pre-zatížení, vyznačující se tím, že systolický TK < 90 mmHg nebo pokles střední arteriální tlak > 30 mmHg; moči < 0,5 ml/kg/h; tepová frekvence > 60 tepů za minutu (bpm), s nebo bez známek přetížení . LCOS na druhou stranu je běžné v post-operativní HF pacientů a definované jako nutnost pooperační intra-aortální balónková pumpa nebo inotropní podpora pro více než 30 minut v akutní péči .
epidemiologie
přesná prevalence a incidence LoHF v obecné populaci není zcela známa. V současné době neexistují žádné epidemiologické údaje založené na populaci specifické pro LoHF. K dispozici pouze údaje z jednoho centra klinických hodnoceních a vyberte obyvatel HF pacientů, kteří podstoupili srdeční operaci. V roce 1975 Parr et al. udělal semenné popis klinických subjekt LCOS a hlášen výskyt 25% u dětí, kteří podstoupili srdeční operaci na základě snížené CO definován jako CI < 2.0 L/min/m2. O dvě desetiletí později, Wernovsky et al. prokázaly stejný výskyt pooperační LCOS u pacientů, kteří podstoupili arteriální switch operace vyskytující se v 6-18 hodin po operaci. Mnoho nedávných klinických studiích, zprávy o velké rozdíly v prevalenci, z 3,6% (muži) a 5,9% (ženy) na 9,1% a 41% a výskyt 14.7% . V nedávné dlouhodobé (dvacetileté: 1990-2009) prospektivní klinická studie zahrnující 25 176 po sobě jdoucích pacientů po operaci by-pass štěpu koronární arterie (CABG), Algarni et al. hlášená prevalence pooperačních LCO se významně snížila z 9,1% (1990-1994) na 2,4% (2005-2009).
etiologie
etiologie LoHF je multifaktoriální. Obecně je to důsledek dysfunkce levé komory (LV), pravé komory (RV) nebo systémové Komory (anatomie jedné komory) a může zahrnovat buď systolickou nebo diastolickou dysfunkci . Odchylky v plnění komor nebo vysunutí vést k LoHF, která je častou komplikací u pacientů, kteří podstoupili srdeční operaci nebo v kardiogenním šoku . To může se projevovat jako akutní zhoršení u pacientů s chronickým HF, nebo to může být přechodné a reverzibilní epizoda s rozlišením akutní spoušť. Jedná se o klinický syndrom považovaný za konečnou cestu mnoha nemocí ovlivňujících srdeční funkce. Nestačí stanovit diagnózu LoHF, musí být také stanovena základní příčina nebo spoušť a pokud možno léčena . Tabulka 1 uvádí souhrn stavů způsobujících stav s nízkým výkonem u pacientů s HF.
Tabulka 1. Etiologie low-výstup státu patofyziologie
|
Mechanismy |
Kauzální Podmínky, |
|
Ztráta kontraktility myokardu, |
Ischemická choroba srdeční, kardiomyopatie, myokarditida, dekompenzované chronické HF, post-srdeční chirurgie, toxiny, výživa (obezita)m infiltrativní onemocnění, v konečném stádiu selhání ledvin, Chagasova nemoc nebo infekce HIV, |
|
Porucha plnění komor nebo vysunutí |
Perikarditida, perikardiální výpotek, srdeční tamponáda, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
současné chápání patofyziologie LoHF se do značné míry opírá o důkazy z klinických studií na pooperačních pacientech s CABG . Patologickým znakem je nadměrně depresivní CO doprovázená hypoperfuzí koncových orgánů. Fyziologicky funguje srdce jako pumpa, která distribuuje okysličenou krev v dostatečném množství, aby uspokojila metabolické potřeby tkání. Protože metabolické potřeby se liší za normálních a stresových situací, CO se také liší, aby uspokojila tuto dynamickou poptávku . Diastolická fáze srdečního cyklu je kritická u pacientů s LoHF, protože během ventrikulární relaxace dochází k koronární výplni, která zajišťuje okysličení myokardu . Srdeční frekvence (HR) je také významná u diastoly, protože příliš rychlý HR brání srdci v dosažení úplné relaxace a perfúze myokardu. Tak, srdeční dysfunkce výsledky ze strukturálních (reziduální srdeční anomálie) nebo funkční srdeční poruchy (poruchy ventrikulární plnění nebo vyprazdňování, nebo zvýšená systémová vaskulární rezistence ).
Patofyziologicky závisí CO na HR a objemu zdvihu (SV) (CO = HR * SV). Objem zdvihu je zase čistým produktem tří vzájemně souvisejících oběhových proměnných: předpětí, afterload a kontraktilita. Pokud je narušena jedna nebo více z těchto složek, může se vyvinout stav nízkého srdečního výdeje . Kromě toho tyto složky ovlivňují jak systolickou, tak diastolickou fázi srdečního cyklu, což způsobuje systolickou dysfunkci LV/RV a / nebo diastolickou dysfunkci známou také jako HF se zachovanou ejekční frakcí (Obrázek 1). Další podmínky, jako je onemocnění srdečních chlopní, plicní hypertenze (PH), mechanický ventil dysfunkce, a respirační selhání může vyvolat nebo zhoršit vývoj LoHF .
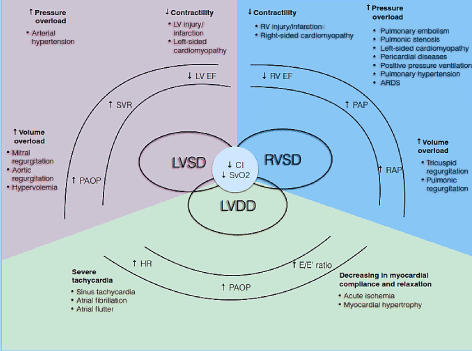
Obrázek 1. Patofyziologické mechanismy srdečního selhání s nízkým výkonem
běžné příčiny a typické; symptomy LoHF jsou zahrnuty. Hlavními patofyziologickými mechanismy LoHF je ventrikulární dysfunkce: Systolická a / nebo diastolická dysfunkce LV a systolická dysfunkce RV, které sdílejí společné patologické rysy sníženého srdečního indexu (CI) a snížené smíšené žilní saturace kyslíkem (SvO2). LV a RV systolickou dysfunkcí výsledky od zvýšený tlak přetížení, zvýšení objemu přetížení a snížení kontraktility, zatímco LV diastolické dysfunkce výsledky z těžké tachykardie a snížení infarktu dodržování a relaxaci. Převzato z Lomivorotov et al. 2017, str. 293
LV ystolic dysfunkce
Levé komory (LV) systolickou dysfunkcí (nebo v depresi LV ejekční frakce ) je nejčastější patofyziologický mechanismus viděl v LoHF pacientů. Proměnné cirkulace ovlivňující systolickou funkci LV jsou předpětí, po zatížení a kontraktilita . Obecně platí, LV systolická dysfunkce je důsledkem ztráty nebo snížení funkčních kardiomyocytů vyplývající z nekrózy způsobené poruchou koronární oběh a ischemie, reperfuzní poškození nebo méně zřejmé, přírodního jevu cardiomyocyte apoptózy . Ztráta funkčních kardiomyocytů může být přechodné, jak je vidět v průběhu infarktu ohromující definována jako životaschopného myokardu zachráněn koronární reperfuze, který vykazuje dlouhodobé post-ischemické dysfunkce následující reperfuze . Ztráta funkční cardiomyocyte může také být refrakterní na zvrat v podmínkách, jako je například infekce; tachykardie; chlopenní onemocnění; metabolické poruchy, jako jsou acidóza, hypoglykémie, hypokalcémie; expozice životního srdeční toxiny a chemické látky; idiopatická dilatační kardiomyopatie (DCM); a genetické poruchy, jako je familiární DCM, hypertrofická kardiomyopatie a svalové dystrofie . Zhoršená srdeční odpověď na předpětí způsobuje dramatický pokles co a dodávky kyslíku do dalších klíčových tělesných orgánů, zvýšený síňový tlak, kapilární klínový tlak a kardiogenní plicní edém. Ačkoli kompenzační změny v LV se přizpůsobují relativně vysokému systémovému arteriálnímu tlaku, významné zvýšení afterload může vyvolat systolickou dysfunkci LV .
LV diastolická dysfunkce
i když méně časté, LoHF se může vyvinout u pacientů s LV diastolickou dysfunkcí se zachovaným LVEF. Tento stav je důsledkem neschopnosti komorové komory naplnit dostatečný objem krve navzdory normálnímu předpětí, které se projevuje jako diastolická dysfunkce . Základní podmínky, jako je těžká tachykardie, snížení infarktu souladu, nebo abnormální komorové relaxace narušuje odpočinek a naplnění LV během diastoly fáze srdečního cyklu. Na cardiomyocyte úrovni, tyto podmínky jsou spojeny s odstranění vápníku z cytosolu a homeostáze vápníku, přiměřenost cross-bridge oddělení a vnitřní funkční cytoskeletální prvek poruchu . Cross-bridge oddělení může přispět k opožděné izovolumická relaxační čas, což má za následek snížení LV zdvihový objem zejména při vyšších HR . Relaxace LV také závisí na opětovném vychytávání sarkoplazmatických retikulárních iontů vápníku a signalizaci oxidu dusnatého, což také usnadňuje oddělení křížového mostu. Vzhledem k tomu, že proces oddělení křížového mostu je energeticky náročný, může způsobit deficit energie myokardu a následně zpomalit relaxaci myokardu LV.
Navzdory diastolické dysfunkce je rozšířeným jevem viděl až v 70% pooperační srdeční u pacientů , diastolický dysfunkce sama o sobě není dostačující k vysvětlení vývoje akutní HF. V nastavení jiných klinických stavů, jako je fibrilace síní (AF), poruchy koronární cirkulace, arteriální hypertenze, diastolická dysfunkce může mít za následek dekompenzované státu, a proto věřil být časné známky ischemie myokardu . Dynamický vztah mezi DIASTOLICKÝMI a systolickými funkcemi LV také přispívá k diastolické dysfunkci u pacientů s LoHF. Stimulace inotropního katecholaminu ovlivňuje jak diastolu, tak systolu a může zvýšit diastolickou dysfunkci. Depresivní LVEF vede ke zvýšení koncového systolického objemu a prodlužuje diastolickou fázi srdečního cyklu .
RV dysfunkce
V LoHF, zejména po koronárním arteriálním chirurgii, zásady patofyziologických mechanismů RV dysfunkce zahrnují zvýšené předpětí, zvýšení afterloadu, postižené pravé koronární perfuze a snížení kontraktility . Na rozdíl od levé koronární tepny dochází k perfuzi pravé koronární tepny během diastoly i systoly. Přítomnost PH způsobuje zvýšení tlaku RV, což vede ke snížení perfuze pravé koronární arterie, což vysvětluje význam pro zajištění optimálního levého a pravého koronárního oběhu . U pacientů, kteří podstoupili operaci koronární arterie, se dysfunkce RV může vyvinout v důsledku kombinace mechanismů. Perioperační RV ischemie a infarkt jsou hlavními příčinami zhoršené kontraktility RV. Trikuspidální nebo pulmonic regurgitace re běžné příčiny zvýšení objemu předpětí, zatímco na levé straně chlopenní onemocnění nebo kardiomyopatie, PH nebo plicní embolie (PE), syndrom akutní respirační tísně a vysoké pozitivní tlak větrání jsou společné příčiny tlak přetížení . Protože RV normálně umožňuje nízkotlakou perfuzi plicní vaskulatury, je vysoce citlivý i na mírné zvýšení tlaku v plicní tepně (PAP). Selhání RV se může vyvinout v nastavení PH nebo zhoršené kontraktility spojené s rychlou progresí dilatace RV vedoucí ke zvýšenému koncovému diastolickému tlaku RV . Tyto fyziologické změny mohou způsobit inter-komorové septum posun směrem k již pod-naplněné LV komory a následně způsobit snížení LV předpětí a snížení CO .
rizikové faktory
rizikové faktory pro LoHF zůstávají nedostatečně prozkoumanou oblastí. Nicméně málo údajů dostupných z klinických studií na HF a od pooperačních pacientů s LCOS poskytuje cenné poznatky o rizikových faktorech a prediktorech LoHF. V analýze 452 pacientů hospitalizován s dekompenzovaným HF a nízký srdeční výdej, významné rizikové faktory pro LoHF byly Chagasova nemoc (Relativní riziko : 3.66), depresivní ejekční frakce (RR: 2.41), hyponatrémie (RR: 1.62) a renální dysfunkce (RR: 1.92) . Rizikové faktory pro pooperační LoHF patří poruchou funkce LV (< 50%), on-pump CABG, nouzové nebo mimotělního oběhu (CPB) chirurgie, neúplná revaskularizace, věk > 65 let, a v kombinaci přítomnost diabetes mellitus a předoperační renální dysfunkce . Kromě pacienta a operace, rizikové faktory, biochemickými prediktory LoHF v pooperační pacientů jsou nízké hladiny hemoglobinu , celkový počet lymfocytů < 2000 buněk/µL , a předoperační sérové hladiny natriuretických peptidů . Během posledních dvou desetiletí došlo ke změnám v trendech některých uznávaných rizikových faktorů. Faktory jako je hypertenze, ženské pohlaví, třílůžkový onemocnění cév a levé hlavní onemocnění jsou již statisticky významný, zatímco riziko spojené s depresivní předoperační ejekční frakce zdvojnásobil .
diagnóza
u pacientů s LoHF neexistují žádné konsensuální pokyny ani prokázaná diagnostická kritéria. Kromě toho jsou klinické příznaky a symptomy nespecifické. Při absenci standardizovaných pokynů se diagnóza obvykle spoléhá na přijatý sběr hemodynamických a fyziologických aberací užitečných pro zvýšení klinického podezření na LoHF . Diagnóza samotného LoHF často nestačí. Musí být také stanovena příčina stavu s nízkým výkonem. V některých příčinách stavu s nízkým výkonem, jako je PE nebo MI, je nejdůležitějším hlediskem léčba základní příčiny, a proto je nezbytné provést diagnózu. Vzhledem k tomu, že pacienti s LoHF jsou často nestabilní, je také běžné, že klinické hodnocení, diagnostika a léčba se vyskytují souběžně více v prostředí akutní péče .
příznaky
Nízký srdeční výdej jako prezentaci rysem akutní dekompenzované HF je méně časté, postihují pouze 8,9 9,6% hospitalizovaných HF pacientů . LoHF může sdílet mnoho klinických příznaků s CHF, ale existují značné rozdíly, které mohou podporovat nebo vést následná diagnostická rozhodnutí. Nadměrná únava a zvýšená intolerance cvičení jsou důležitými počátečními příznaky, které si pacienti s LoHF všimli ještě před diagnózou . Kromě toho, LoHF pacientů běžně přítomné s neklid, zmatenost a/nebo snížené úrovně vědomí; zima/vasoconstricted periferie, nebo opožděný kapilární návrat v čase; hypotenze; tachykardie nebo bradykardie; nitkovitý puls, zvýšil jugulární žilní tlak, dušnost a hypoxie; a oligurie/anurie . Tyto příznaky a symptomy se mohou u pacientů s HF lišit mezi nízkou perfuzí a kongescí (Tabulka 2).
Tabulka 2. Příznaky a příznaky nízké perfúze vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Pokyny ESC pro diagnostiku a léčbu HF z roku 2016 zdůrazňují důležitost získání podrobné anamnézy pacienta a fyzického vyšetření u všech pacientů s podezřením na HF . Detailní historie od pacienta, nebo relativní a přáteli, pokud pacient je příliš nemocný, by se měly zaměřit na získávání informací o příznaky, předchozí, a aktuální srdeční a extra-srdeční podmínek schopné urychlovat nebo přitěžující HF, expozice rizikovým faktorům HF nebo low-výstup stavu, a léky historie pro aktuální a předchozí zdravotní stav . Kromě anamnézy pacienta se všem pacientům s LoHF doporučuje fyzikální vyšetření k posouzení klinických indikátorů hemodynamické, periferní perfúze, kongesce, základní etiologie a chlopňové patologie. Hemodynamické parametry zájmu patří krevní tlak, HR a srdeční rytmus, cval rytmus, saturace kyslíku a dechová frekvence . Testy na periferní perfúzi by měly zahrnovat hladiny vědomí, periferní kůži / centrální teplotu, dobu doplňování kapilár a výdej moči. Testy na kongesci zahrnují zvýšený jugulární žilní tlak, periferní / plicní edém, hepatomegalii, ascites a pleurální výpotky. Testy na základní etiologii by měly zahrnovat kardiovaskulární vyšetření a srdeční zvuk a šelesty. Konečně, důkazy o chlopňové dysfunkci by měly zahrnovat perikardiální rub a důkaz perikardiálního výpotku se srdeční tamponádou nebo bez ní .
kombinace anamnézy pacienta a fyzického vyšetření se ukázala jako neocenitelná při hodnocení hemodynamického stavu a rozpoznávání LoHF . V roce 1976 Forrester et al. provádí fyzikální vyšetření pacientů s akutním infarktem myokardu a identifikovány čtyři hemodynamické profily (A, B, L a C), jak je znázorněno na Obrázku 2. Hemodynamické profily jsou založeny na přítomnosti nebo nepřítomnosti plicní kongesce (plicní kapilární tlak v zaklínění > nebo ≤ 18 mmHg) a přiměřenost perfuze (CI > 2.2 L/min/m2). Profil a nepředstavuje žádné přetížení / hypoperfúzi; profil B přetížení bez hypoperfúze; profil C hypoperfúze bez přetížení; a profil L přetížení a hypoperfúze. Pacienti s LoHF spadají pod profily L A C (hypoperfuze ± kongesce na základě Nohria et al. prokázání, že profil L A C mají průměrný CI 1,6 L / min / m2 a 1,9 L/min/m2.
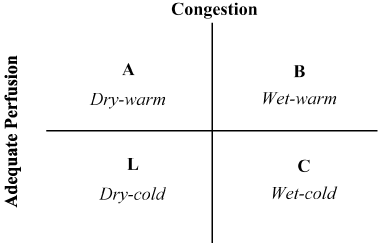
Obrázek 2. Schéma prezentace klinických profil akutní dekompenzované srdeční selhání
Přetížení je hodnocena přítomnost orthopnoea, jugulární žilní tlak, plicní šelesty, hepatojugular reflux, ascites, periferní edémy, bolesti břicha, reflux a Valsalva náměstí vlna. Nízká perfúze byla hodnocena přítomností úzkého pulsního tlaku, změn pulsu, studených končetin, možná ospalosti, klesajících hladin sodíku v séru a zhoršení funkce ledvin. Převzato z Nohria, et al.
elektrokardiogram (EKG): pokyny AHA I ESC pro HF doporučují, aby byl elektrokardiogram (EKG) proveden co nejdříve u všech pacientů s podezřením na HF. EKG může prokázat různé abnormality a je velmi nepravděpodobné, že by bylo normální u pacientů s HF. Může také poskytnout důkaz základní etiologie srdeční dysfunkce včetně bradykardie, atrioventrikulárního bloku, sinusové tachykardie, síňové nebo komorové tachyarytmie, ischémie, hypertrofie LV a komplexů nízkého napětí .
Základní laboratorní testy: AHA a ESC HF pokyny také doporučují, základní laboratorní testy v počátečních klinických hodnocení, které podporují diagnózu HF nebo příčinou nízkého výstupního stavu. U všech pacientů s podezřením na HF by měly být provedeny krevní testy. Hemoglobin (Hb > 10 g/dL) udává optimální dodávku kyslíku do tkání), chronická anémie je běžná u chronické HF a výrazně zvýšený počet bílých krvinek zvýšit podezření na alternativní diagnózu. Testy sérového elektrolytu pro stanovení hladin draslíku, hořčíku a vápníku. Testy močoviny a kreatininu k posouzení renální hypoperfuze a dysfunkce běžné u HF. Testy na zhoršenou funkci jater, které naznačují zhoršenou RV a / nebo jaterní kongesci. Glukózový test k posouzení hypoglykémie, která může zhoršit srdeční funkce. Testy funkce štítné žlázy na hypo – nebo hyper-tyreoidismus, které mohou způsobit vnitřní infarkt myokardu. Konečně, testy na sérové natriuretické peptidy, jejichž zvýšené hladiny naznačují zvýšené napětí komorové stěny, ale které nezjistí náhlé změny komorových plnicích tlaků kvůli jejich dlouhému poločasu .
srdeční zobrazovací testy: srdeční zobrazování hraje ústřední roli v diagnostice HF, stejně jako v monitorování a vedení terapie. Echokardiografie je preferovanou modalitou z důvodů přesnosti, dostupnosti, bezpečnosti a efektivity nákladů . Může být doplněna dalšími zobrazovacími modalitami vybranými na základě schopnosti Odpovědět na konkrétní klinické otázky při zvažování kontraindikací a rizik .
Echokardiografie: Echokardiografie je důrazně doporučená pro všechny podezření pacientů, protože jeho schopnost potvrdit nebo vyloučit klinickou diagnózou LoHF, posoudit, SV a jeho variace, a určit příčinu nízkého výstupního stavu . Transthorakální echokardiografie by měla být provedena co nejdříve po klinické diagnóze nízkého srdečního výdeje. Nejen, že měření rozsah systolického a diastolické dysfunkce, ale také poskytuje cenné informace o ventrikulární morfologie, chlopenní dysfunkce, myokardiální a perikardiální nemoc a regionální abnormality v pohybu stěny . Echokardiografie hodnotí systolickou funkci měřením LEVF, kde > 45-50% je považováno za normální. Na druhé straně, diastolické funkce je hodnocena pomocí mitrální průtok vzory, plicní žilní tok a tkáňový Doppler na mitrální prstenec, zatímco CO a SV jsou hodnoceny pomocí Dopplerova principu. Tlak v plicní tepně (PAP) lze odhadnout měřením rychlosti regurgitačního paprsku. Vysoké PAP v přítomnosti rozšířené RV s septa zploštění nebo vyklenutí do LV, což naznačuje, akutní zvýšení RV tlak na zvyšování klinické podezření na PE jako příčinu nízké výstupní stav .
rentgen hrudníku: u pacientů s podezřením na lohf lze zvážit rentgen hrudníku. Důležité ukazatele, které by mělo vzít v úvahu pro posouzení, patří zvětšené srdce, což naznačuje, kardiomegalie nebo LV hypertrofie; plicní žilní přetížení, což naznačuje zvýšené LV plnicí tlak; a pleurální výpotek indikující zvýšený tlak LV, plicní embolii nebo post-srdeční chirurgii( .
Koronární angiografie: Indikace pro koronární angiografii v LoHF pacienti by měli být v souladu s doporučením příslušných konsensus pokyny pro HF . V HF pacientů na bolest v hrudi a důkazy ST-elevace infarktu myokardu (STEMI) na EKG, revaskularizace pomocí primární perkutánní koronární intervence by měla být provedena co nejdříve. Koronární angiografie by měla být také zvážena u pacientů s post-srdeční zástava ischemické etiologie, kdy existují důkazy, HF a u pacientů, kteří se zotavili z low-výstupní stav, kdy příčina nebyla stanovena .
klinická léčba
přítomnost LoHF představuje velmi vysoce rizikový stav vyžadující okamžitou léčbu, ale postrádá standardizované pokyny pro klinickou léčbu . V důsledku toho lékaři obvykle zvažují individuální patofyziologii, aby zvolili nejvhodnější léčebnou strategii . U akutních pacientů s LoHF doporučují pokyny ESC HF z roku 2016 použití hemodynamických profilů (na základě přítomnosti nebo nepřítomnosti kongesce a přiměřenosti perfúze) pro vedení klinického řízení . Pro LoHF pacientů v Profilu L (bez přetížení, ale hypoperfused) a Profil C (oba přetížení a hypoperfused), kteří jsou v akutní dekompenzace stavu, nouzové ošetření cíle mohou zahrnovat resuscitaci pacientů, obnovení okysličení, zlepšení orgánové perfuze a optimalizaci hemodynamických (stroke volume a CO), a řešení příznaků. Mezi další následné cíle patří optimální sledování a stanovení základní příčiny nízkého srdečního výdeje a léčba příčiny, pokud je reverzibilní . V současné době jsou dostupnými terapeutickými cíli pro LoHF optimalizace okysličení tkáně, stabilizace cirkulace a léčba reverzibilních příčin stavu s nízkým výkonem (obrázek 3).
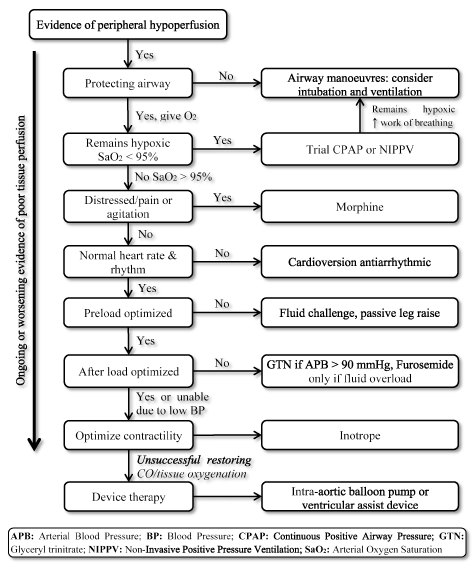
obrázek 3. Léčba algoritmus pro low-output srdeční selhání
Léčba LoHF cíle zlepšení okysličení tkání a stabilizaci oběhu na základě probíhající nebo zhoršení příznakem prokrvení tkání. Léčba začíná zlepšením ventilace pomocí dodávky vysoce průtokového kyslíku, kontinuálního pozitivního tlaku v dýchacích cestách (CPAP) nebo neinvazivní přetlakové ventilace (NIPPV). Pokud neúspěšné, kardioverze nebo antiarytmika jsou vzhledem k normalizaci srdeční frekvence, kapalinou výzva k optimalizaci pre-zatížení, a/nebo vazodilatancia a inotropika manipulovat a zlepšit kontraktilitu, resp. Pokud předchozí větrání a léky jsou neúspěšné při obnově srdeční výdej a/nebo okysličení tkání, zařízení, terapie pomocí intra-aortální balónková pumpa nebo ventrikulární pomoci zařízení lze považovat za
Optimalizaci okysličení tkání (ventilační strategie)
Klinické řízení LoHF pacienty často začíná s hodnocením dýchacích cest, dýchání a krevní oběh pro důkaz, periferní hypoperfuze. Ventilátor strategie jako orofaryngeální nebo nosohltanu dýchacích cest jsou běžné doplňky použity k obnovení nebo udržení průchodnosti dýchacích cest v LoHF pacientů se sníženou úrovní vědomí vzhledem k poklesu mozkové perfuze. Pokud pacient zůstává s poškozenými dýchacími cestami, je třeba zvážit další endotracheální intubaci . Pokud pacienti i nadále zůstávají hypoxické (SaO2 < 95%), maximalizace dodávky kyslíku pomocí vysoký průtok kyslíku, kontinuální pozitivní tlak v dýchacích cestách (CPAP) nebo neinvazivní pozitivní tlaková ventilace (NIPPV) lze považovat. U pacientů bez zlepšení lze zvážit intubaci nebo ventilaci .
stabilizujte oběh
srdeční výdej (CO) je funkcí HR a SV. SV zase závisí na čtyřech oběhových proměnných-srdeční frekvenci – předpětí, kontraktilitě a následném zatížení. Optimalizace všech těchto proměnných zlepší CO u pacientů s LoHF . V klinickém prostředí závisí strategie zvýšení CO na základní příčině a postižené cirkulační proměnné . Klinické intervence zahrnují úpravu objemu, farmakologickou podporu a přístrojovou terapii.
srdeční frekvence / rytmus: Jako součást fyziologické odpovědi těla zvyšuje HR CO. Příliš rychlý nebo pomalý HR má škodlivý vliv na CO. V LoHF pacienti s tachykardie (příliš rychlý odpočívá HR > 100 / min), kteří jsou v nouzi, neklidný a dyspnoeic, morfin může být podáván k úlevě od dyspnoe, bolest a neklid, stejně jako je mírné venodilator pro snížení dotížení a to zejména v CPAP nebo NIPPV u pacientů . Pokud HR < 40 bpm s projevy hemodynamické kompromisu a/nebo poruchou CO, léky, které zvyšují HR (atropin a anticholinergika ), nebo zásahy, jako je transkutánní/transvenózní kardiostimulace by měla být provedena. Urgentní elektrická kardioverze by měla být zvážena u vybraného LoHF s ventrikulární / supraventrikulární tachykardií nebo rychlým AF s prokázaným kardiovaskulárním kompromisem .
Optimalizujte předpětí( nastavení hlasitosti): měření předpětí je nezbytné pro jeho optimalizaci. Doporučuje se u pacientů s klinickými důkazy zhoršené periferní perfúze. K posouzení citlivosti na předpětí by měla být provedena tekutá výzva. Rychle infuzuje 250 ml tekutiny (krystaloidní nebo koloidní) po dobu více než pěti minut a objektivně hodnotí účinek na SV. Pokud je efekt zvýšení nebo snížení > 10%, pacient by měl pokračovat v přijímání tekutin bolusy k optimalizaci zatížení, dokud oni jsou už ne tekutina reaguje . U pacientů s příznaky přetížení a plicní edém, kteří nevyžadují tekutiny, pasivní raise noha může být provedeno zvedání pacienta nohu na 45 stupňů, aby se vyloučila potřeba tekutin výzvu. Pokud je odpověď příznivá, může být poskytnuta skutečná tekutá výzva .
Manipulovat dotížení (Farmakologické podpory): Dotížení je odpor, proti kterému komora je vysunutí krve, občas se odhaduje jako SVR. Dotížení by měla být snížena v LoHF pacientů léčících se s vysokým afterload, nízká CO, důkaz špatné periferní perfuze a plicní edém. Farmakologická podpora pomocí vazodilatátorů by měla být podána pacientům s LoHF se systolickým TK ≥110 mmHg. U pacientů se systolickým TK < 90 mmHG a střední arteriální tlak < 65 mmHg, vazodilatancia se nedoporučuje vzhledem k riziku hypotenze, což může komplikovat orgánové perfuze. U těchto pacientů se inotropy doporučují jako první linie léčby .
zlepšení kontraktility (farmakologická podpora): Pokud pacient přetrvávají důkazy o tkáňové hypoperfúze nebo snižuje dodávku kyslíku i přes intervence pro srdeční frekvence, preload a afterload, léčba ke zlepšení kontraktility by měly být považovány za. Mezitím by měla pokračovat optimalizace dodávání kyslíku s cílem koncentrace hemoglobinu ≥10 g / dl a zajištění optimální saturace kyslíkem (SaO2). Faktory nepříznivě ovlivňující kontraktilitu myokardu jsou hyperkalemie, hypomagnezémie, hypokalcemie, těžká acidóza, hypoxie a hypoglykémie, které musí být korigovány. Inotropy se doporučují ke zlepšení kontraktility a následně CO u pacientů s LoHF s nízkým TK a / nebo nízkým CI v přítomnosti příznaků špatné periferní perfúze nebo kongesce . Farmakologická podpora s použitím dobutaminu (inotropu) by však měla být používána s opatrností u pacientů s tachykardií nebo AF, protože zvyšuje vedení AV uzlu a může vyvolat rychlé komorové rytmy . Na druhé straně se levosimendan doporučuje u pacientů s LoHF s akutní ischemickou chorobou myokardu nebo po operaci srdce, protože nezvyšuje potřebu kyslíku v myokardu . Dlouhodobý účinek inotropů by mohl být škodlivý, a proto by jejich použití mělo být zastaveno, jakmile bude dosaženo stability. Vazopresory by neměly být léky první linie ve stavech s nízkým výkonem, protože zvyšují SVR a následně zhoršují CO. U pacientů, kteří mají sepse jako základní příčinu stavu s nízkým výkonem, se však doporučuje duální terapie vazopresorů a inotropů .
přístrojová terapie: u pacientů s LoHF je třeba zvážit léčbu pomocí přístroje, pokud optimální léčba nebyla úspěšná při obnově CO a okysličení tkáně. Mezi běžné terapie zařízení patří intraaortální balónková pumpa (IABP) a komorové pomocné zařízení (VAD). Použití IABP je časté u pacientů s LoHF s ischemickou chorobou srdeční, před nebo po perkutánní intervenci nebo po srdeční operaci. IABP se skládá z balónu vloženého do aorty femorální tepnou. Balónek nafoukne během diastoly a vyfoukne během systoly ke zvýšení diastolického krevního tlaku a v důsledku toho koronární perfuze, a snižuje afterload čímž se zvyšuje CO . Na druhé straně je použití VAD neobvyklé. Může být použit pouze ve specializovaných centrech. To je běžně používané jako most k transplantaci srdce u pacientů s příznivým kvality života nebo k zotavení u pacientů s akutní myokarditida .
léčba základních příčin
některé příčiny stavu s nízkým výkonem u pacientů s LoHF lze zvrátit specifickými terapiemi. Reverzibilní příčiny by měly být identifikovány brzy během počátečního klinického hodnocení. Mezi tyto příčiny patří akutní infarkt myokardu, srdeční tamponáda, tenzní pneumotorax, plicní embolie a akutní selhání chlopně . (Tabulka 3).
Meta-analýzy, diagnózy a klinické řízení
základem klinické diagnostiky LoHF byla echokardiograficky prokázanou LV/RV systolickou dysfunkcí a/nebo LV diastolické dysfunkce doprovázena důkazy o snížení CO a SvO2 . Hemodynamické profily na základě opatření z dopravní zácpy a perfuze byly použity pro klasifikaci akutní HF pacientů do čtyř profilů: suché teplo (), mokré-teplé (B), suché-za studena (L), mokré a studené (C) a užitečné při identifikaci LoHF pacientů . LoHF pacientů byly klasifikovány do Profilů (L) a (C) na základě přítomnosti/nepřítomnosti přetížení a/nebo nedostatečné periferní prokrvení . Tyto dva hemodynamické profily tvoří základ pro výběr pacientů s LoHF v klinických studiích, stejně jako poskytnout jednoduchý noční posouzení pomoci klasifikovat pacienty v době prezentace a průvodce výběrem počáteční terapie . Cílem této metaanalýzy je shromáždit publikované důkazy o společných diagnostických rysech a výsledcích léčby u pacientů s LoHF.
Hledat strategie
Tři hlavní on-line databází (PubMed, EMBASE a Cochrane) byly systematicky prohledávány od svého vzniku do prosince 2018 pro studie zkoumající diagnózy a klinické řízení LoHF. Aby se zabránilo výhledem studie, které nezmínil LoHF v názvu nebo abstraktu, prvních 200 ohodnoceného články načíst s full-textové vyhledávání služby Google Scholar byly zahrnuty. Nebyla použita žádná publikační doba ani jazyková omezení. Další studie byly identifikovány ručním vyhledáváním seznamu odkazů z zahrnutých studií i z příslušných recenzních článků, které byly poté podrobeny kritériím pro zařazení. Vyhledávací kritéria zahrnuty populace z úroků (pacienti s LoHF nebo LCOS), diagnostické testy zájmu (echokardiografii a hemodynamické profily), a intervence zájmu (ventilační strategie, nastavení hlasitosti, farmakologické podpory a zařízení, terapie). Studie byly zahrnuty, pokud splňovaly následující kritéria: a) zahrnuti pacienti s LoHF; (b) diagnostikována pomocí echokardiografie a hemodynamických profilů; (c) léčených pacientů pro hemodynamickou stabilizaci; a (d) hlášené výsledky léčby. V případech studií vykazujících duplicitní údaje byla zahrnuta pouze studie, která poskytla největší počet pacientů. Abstrakt z konference, kazuistiky a recenzní články byly vyloučeny.
výběr studie
obrázek 4 ilustruje proces vyhledávání a screeningu použitý k zahrnutí vhodných studií. Dva recenzenti nezávisle prověřili všechny tituly a abstrakty získané ze systematického online vyhledávání. Abstrakty, které zahrnovaly populaci, intervence a výsledky zájmu byly zahrnuty do fulltextového vyhledávání. Poté oba recenzenti také nezávisle přezkoumali fulltextové články proti kritériím pro zařazení. V případě nesrovnalostí byla vyřešena diskusí a konsenzem.

obrázek 4. Schéma rešerše odborné literatury a začlenění procesu
sběr Dat
Dva recenzenti nezávisle extrahuje data ze zahrnutých studií a jakýkoli rozpor byl vyřešen prostřednictvím konsensu. Hlavní údaje byly echokardiografické a hemodynamické údaje v profilu, a léčba používá a výsledek léčby na hemodynamické (srdeční index, PCWP) a úmrtnosti. Kromě těchto hlavních údajů oba recenzenti také získali údaje o charakteristikách studie, charakteristikách pacientů a délce sledování (Tabulka 4).
Statistická analýza
výsledky zájmu hlášené ve více než jedné studii jsou srdeční index, PCWP a mortalita. Pro každý výsledek byla extrahována Souhrnná statistika (průměr ± směrodatná odchylka) před a po intervenci nebo rozdíl mezi výchozí hodnotou a po léčbě. Tyto souhrnné statistiky byly získány odděleně pro léčebné a kontrolní skupiny / skupiny s placebem. Diagnostické výsledky a účinky léčby byly měřeny rozdílem v prostředcích před a po intervenci a souvisejícím 95% intervalem spolehlivosti. Lesní pozemky byly použity k vizuálnímu zkoumání heterogenity (I2) napříč studiemi. Směsné diagnostické a léčebné účinky a přidružené 95% interval spolehlivosti byly odhadnuty pomocí fixní efekt (I2 < 49%) nebo random effect model (I2 > 50%). P-hodnota > 0,05 byla považována za statisticky významnou.
výsledky
charakteristika studie
dvanáct (12) randomizovaných kontrolovaných studií (RCT) splnilo kritéria pro zařazení. Sedm (7) studium předmětu LoHF pacientů a zbývajících pět (5) se zapsal HF pacientů, kteří podstoupili srdeční operaci s low-srdeční výdej. Většina publikovaných klinických studiích (10) zkoumali léky porovnávající vliv různých typů inotropika na hemodynamické a prevence úmrtí: dobutamin pouze , dobutamin a dopamin ; levosimendan a dobutamin , levosimendan s placebem . Ze zbývajících dvou klinických studiích, každý zkoumány vazodilatační (nitroprusside) a placebem , a zařízení, terapie (IABP) a inotrope (levosimendan) samostatně nebo v kombinaci s IAPB . Celkem 12 klinických studiích se zapsal 3,738 pacientů, průměrný věk byl 64 let (rozmezí = 55-74 let), většinou muž (78%).
syntéza výsledků
diagnostická data na LoHF byla nekonzistentní. Ve dvanácti klinických studiích se neobjevila žádná společná definice LoHF, která by byla užitečná pro vedení diagnózy. Hemodynamická kritéria pro zařazení pacientů do studie zahrnuty CI < 2.0 L/min/m2 , CI < 2.2 L/min/m2 nebo CI < 2.5 L/min/m2 a PCWP > 15 mm hg nebo ≥18 mm hg . Definice rovněž liší napříč studiemi – pooperační stav s hypotenzí (systolický TK < 90 mmHg > 30 minut) nebo nutnost inotropní podpory udržet systolický TK > 90 mmHg a end-orgánové hypoperfuze (chladná periferie, moči < 30 ml/hodinu) . Kardiogenní šok byl popsán jako komplexní syndrom zahrnující kaskádu akutní dysfunkce LV, sníženou CO, hypotenzi a tkáňovou hypoperfuzi .
Obrázky 5 a 6 ukazují lesní grafy pro standardizovaný průměr srdečního indexu na začátku a po inotropní nebo vazodilatační terapii. Výchozí srdeční index se zvýšil z průměru 1,93 (95% CI: 1,91-1,95) na průměr 2,82 (95% CI: 2,80-2,84). Obrázek 7 ukazuje lesní graf pro standardní střední rozdíl (SMD) srdečního indexu po léčbě levosimendanem a dobutaminem. Levosimendan dosáhnout vyšší srdeční index v porovnání s dobutaminem (SMD: 2.82; 95% CI: 2.54-3.10). Jako profylaktické proti LoHF v pooperačních pacientů, levosimendan infusion po anestezii dosaženo vyšší srdeční index (2.57), ve srovnání s pre-operativní IABP (2.3) nebo s kombinací levosimendan (2.4). Obrázek 8 ukazuje lesní graf úmrtnosti mezi levosimendanem a placebem. Levosimendan měl nižší úmrtnost ve srovnání s placebem (Poměr šancí : 0.83; 95% CI: 0.59-1.18), ale rozdíl nebyl statisticky významný (p=0.30). Poslední Obrázek 9 dále ukazuje, Levosimendan má nižší úmrtnost ve srovnání s dobutaminem (NEBO: 0.65; 95% CI: 0.39-1.08) but the difference was not statistically significant (p=0.10).
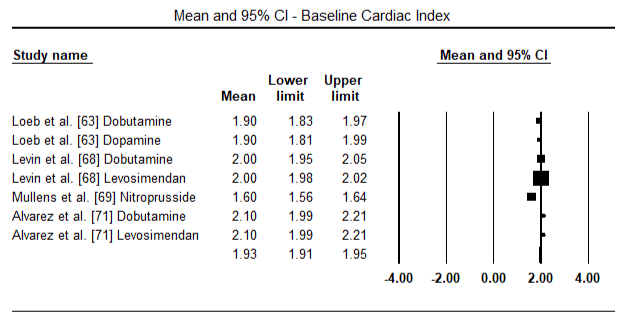
Figure 5. Mean baseline cardiac index
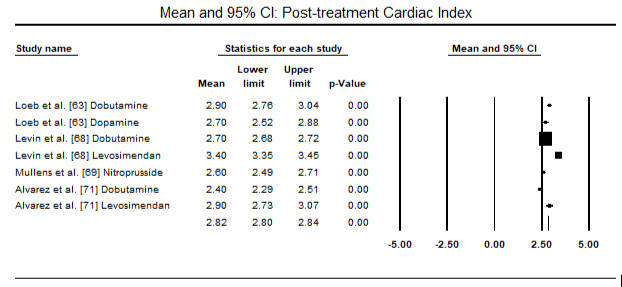
Figure 6. Mean post-treatment cardiac index
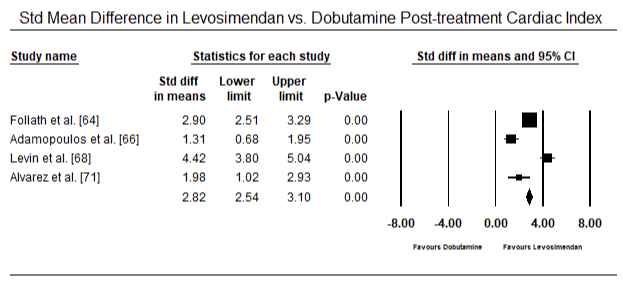
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
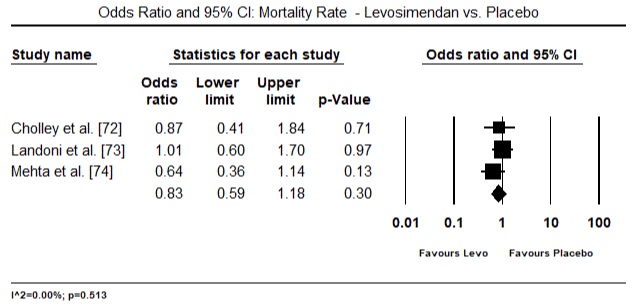
Figure 8. Mortality rate between levosimendan and placebo
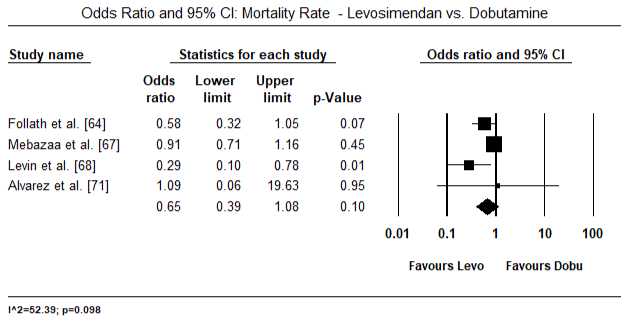
Figure 9. Úmrtnost mezi levosimendan a dobutamin
Diskuse o zjištění
Tento systematický přehled a meta-analýza zhodnotila společné diagnostické funkce, a výsledky léčby lékařských a zařízení, terapie (IABP) na LoHF pacientů. Výsledky ukazují, že pacienti s LoHF postrádají široce přijímané nebo standardizované diagnostické funkce. I když LoHF pacientů může vykazovat několik funkcí, včetně srdeční index, PCWP, systolický TK a SvO2 navrhnout nebo podporu klinické diagnózy, všechny tyto funkce mají rozdílné cut-off hodnoty v rámci celé studie. Srdeční index, který je nejčastější klinické funkce prokazující nízkou výstupní státu v LoHF, má tři cut-off hodnoty: < 2.0 L/min/m2 , < 2.2 L/min/m2 nebo < 2.5 L/min/m2 . Inotropní podpora se objevila jako velmi častý zásah pro zlepšení perfúze a normalizace srdečního výdeje u pacientů s LoHF.
Inotropní léky, jako je levosimendan, dobutamin, dopamin, vazodilatační (nitroprusside) a IABP výrazně zlepšila CI mezi základní a post-zpracování. Z hlediska inotropika, levosimendan je účinnější ve zlepšení hemodynamické stability a lepší profylaktické proti krátkodobé smrt (30-denní mortality), než dobutamin. Kromě toho mohou inotropy působit jako profylaktické proti vývoji pooperačního LoHF. Na druhou stranu, zatímco inotropika zlepšit hemodynamické a normalizovat srdeční výdej, neposkytují žádné výrazně lepší ochranu proti úmrtnost bez ohledu na typ inotrope používá.
role inotropika při léčbě LoHF byl podpořen předchozí recenze inotropní látky a vazodilatační strategie pro léčbu kardiogenní šok a LCOS . V recenzi uvádí inotropika zlepšit hemodynamické, nepříznivé události v pooperačním LCOS a snížení úmrtnosti. Novější inotropika jako levosimendan (vápník senzibilizátor a inodilator) je pozitivní inotrope má některé vazodilatační vlastnosti . Může být také považován za selektivní jaterní vazodilatátor, který může zlepšit portální žilní tok jaterní tepnou a portální žilní tok ve srovnání s dobutaminem, který může zlepšit pouze portální žilní tok bez vazodilatace jaterní tepny . Levosimendan také nezvyšuje potřebu kyslíku v myokardu a doporučuje se nad dobutaminem u pacientů s LoHF s akutní ischemickou chorobou myokardu nebo po operaci srdce . U pooperačního LoHF zůstává ochranný účinek inotropů proti krátkodobé úmrtnosti (30denní úmrtnost) ve srovnání s placebem nevýznamný .
současný systematický přehled a metaanalýza má některá důležitá omezení. LoHF se může objevit u sekundárního srdečního onemocnění, jako je akutní infarkt myokardu nebo po operaci. Většina studií zahrnovala zkoumaný pooperační LoHF s menším výskytem LoHF z jiných příčin. Většina studií se zaměřila na dvě inotropika (Levosimendan a dobutamin), omezení chápání ostatní inotropika, stejně jako jiné terapie, jako jsou zařízení, terapie. V některých studiích byla analýza vystavena riziku nesprávného zkreslení v důsledku významného počtu pacientů ztracených v následném sledování. Protože většina studií nehlásí pair-wise pre – a post-intervenční rozdíl související s směrodatná odchylka, pre-a post-intervenční rozdíl standardní odchylka, pre – a post-intervenční výsledky opatření jako nezávislý, tato získání sider intervaly spolehlivosti pro účinek léčby s přidruženou standardní odchylka.
Závěr
Low-output srdeční selhání (LoHF) je klinický syndrom charakterizovaný sníženou srdeční výdej doprovodu end-orgánové hypoperfuze. Je to neobvyklá forma srdečního selhání v běžné populaci, ale převládající u pacientů po operaci HF. Jeho etiologie je heterogenní a skládá se z různých stavů způsobujících stav s nízkým výkonem a srdeční chirurgii. Hlavními patofyziologickými mechanismy jsou systolická a / nebo diastolická dysfunkce LV a dysfunkce RV způsobená změnami srdeční frekvence, předpětí, následného zatížení a/nebo kontraktility. Obecné rizikové faktory pro LoHF patří Chagasova nemoc, depresi, ejekční frakce, dysfunkce ledvin, zatímco u pacientů s pooperační patří poruchou funkce LV, neúplná revaskularizace, starší věk, přítomnost diabetes a renální dysfunkce. Diagnóza postrádá standardizované pokyny a závisí na přijatém sběru hemodynamických a fyziologických aberací včetně stavů způsobujících stav s nízkým výkonem. Historie pacienta a fyzikální vyšetření pomáhají posoudit hemodynamický stav a rozpoznat stav s nízkým výkonem, zatímco echokardiografie potvrzuje ventrikulární dysfunkci (HF) a nízký srdeční výdej. Další testy na podporu diagnózy, nebo stanovení příčiny nízké výstupní státu patří ekg a základní laboratorní testy (krevní, sérových elektrolytů, urey a kreatininu, jaterní testy, funkce štítné žlázy a natriuretických peptidů v séru) a zobrazování srdce (hrudníku x-ray nebo koronární angiografie). Léčba postrádá zavedené pokyny, ale závisí na posouzení individuální patofyziologie pro výběr nejvhodnější léčebné strategie. Léčba zahrnuje ventilátor strategie ke zlepšení srdeční frekvence a rytmu; nastavení hlasitosti na optimalizaci předpětí; farmakologické podpory (inotropika a vazodilatancia) manipulovat afterload a zlepšit kontraktilitu; a zařízení, terapie (intra-aortální balónková pumpa nebo ventrikulární assist device), kdy tyto strategie nemají obnovit srdeční výdej. U vybraných pacientů mohou terapie Zvrátit základní onemocnění obnovit srdeční výdej.
- Inamdar a, Inamdar A (2016) diagnostika, léčba a využití srdečního selhání. Jičín 5: 62.
- Dassanayaka S, Jones SP (2015) nedávný vývoj srdečního selhání. Oběžník 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Pokyny pro diagnostiku a léčbu akutního a chronického srdečního selhání 2012: pracovní skupina pro Diagnostiku a Léčbu Akutního a Chronického Srdečního Selhání 2012 Evropské Kardiologické Společnosti. Vyvinuto ve spolupráci s Asociací srdečního selhání (HFA) ESC. Eur J Heart Fail 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, et al. (2013) 2013 ACCF / AHA guideline for the management of heart failure: zpráva pracovní skupiny American College of Cardiology Foundation/American Heart Association o pokynech pro praxi. J Am Sb. 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 pokyny ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání: Pracovní skupina pro diagnostiku a léčbu akutního a chronického srdečního selhání Evropské Kardiologické Společnosti (ESC) Vyvinula zvláštní příspěvek Srdeční Selhání Association (HFA) z ESC. Eur Srdce J 37: 2129-2200.
- Masse L, Antonacci M (2005) syndrom nízkého srdečního výdeje: identifikace a řízení. Crit Péče Nurs Clin 17: 375-383.
- Poppas a, Rounds S (2002) městnavé srdeční selhání. Am J Respir Crit Péče Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) shrnutí pokynů pro diagnostiku a léčbu akutního srdečního selhání: pracovní skupina pro akutní srdeční selhání Evropské kardiologické společnosti. Eur Srdce J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) srdeční výkon a úmrtnost brzy po intrakardiální operaci u kojenců a malých dětí. Oběh 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) pooperační průběh a hemodynamický profil po operaci arteriálního spínače u novorozenců a kojenců: srovnání kardiopulmonálního bypassu s nízkým průtokem a zástavy oběhu. Oběh 92: 2226-2235.
- Hogue CW Jr, Sundt T 3, Barzilai B, Schectman KB, Dávila-Román VG (2001) Srdeční a neurologické komplikace identifikovat rizika úmrtnosti pro muže a ženy podstupují bypass koronární artérie chirurgie. Anesteziologie 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) prediktory syndromu nízkého srdečního výdeje po bypassu koronární arterie. Jirásková 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) epidemiologie a nové prediktory syndromu nízkého srdečního výdeje po izolovaném roubování koronárních tepen. Eur Srdce J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo, Cavalcante a kol. (2012) rizikové faktory pro syndrom nízkého srdečního výdeje po operaci bypassu koronární arterie. Brazilec 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) prediktory syndromu nízkého srdečního výdeje po izolované operaci bypassu koronární arterie: trendy za 20 let. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) řízení syndromu nízkého srdečního výdeje po operaci vrozené srdeční choroby. Curr Cardiol Rev 12: 107-111.
- Lomivorotov vv, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) syndrom nízkého srdečního výdeje po operaci srdce. J Cardiothorac Vasc Anesth31: 291-308.
- Tibby SM., Murdoch IA (2003) Monitorování srdeční funkce v intenzivní péči. Archa 88: 46-52.
- Carcillo JA, Field AI (2002) parametry klinické praxe pro hemodynamickou podporu pediatrických a novorozeneckých pacientů v septickém šoku. Crit Péče Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) smrt kardiomyocytů: mechanismy a translační důsledky. Buněčná smrt & nemoc 2: e244.
- Tavernarakis N (2007) Kardiomyocytární nekróza: alternativní mechanismy, účinné intervence. Biochimica et Biophysica Acta (BBA)-výzkum molekulárních buněk 1773: 480-482.
- Dorn GW (2008) apoptotická a neapoptotická programovaná smrt kardiomyocytů při remodelaci komor. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) omráčený a hibernační myokard: stručný přehled. Clintonová 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) diastolické srdeční selhání po operaci srdce. In ischemická choroba srdeční-současné koncepty v epidemiologii, patofyziologii, diagnostice a léčbě 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) jaké mechanismy jsou základem diastolické dysfunkce při srdečním selhání? Obvod 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) srdeční selhání se zachovanou ejekční frakcí: patofyziologie, diagnostika a léčba. Eur Srdce J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) je Fosfolamban nebo Troponin je „prima Donna“ v β-adrenergní indukované Lusitropii? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) akutní účinky oxidu dusnatého na relaxaci levé komory a diastolickou distenzibilitu u lidí. Posouzení pomocí bikoronární infuze nitroprusidu sodného. Oběžník 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prevalence Abnorrnalit diastolické výplně levé komory u dospělých srdečních chirurgických pacientů: intraoperační Echo kardiografická studie. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) biventrikulární diastolické výplňové vzory po operaci bypassu koronární arterie. Jirásková 131: 1080-1086.
- Bossone E, Bodini BD, Mazza a, Allegra L (2005) plicní arteriální hypertenze: klíčová role echokardiografie. Hrudník 127: 1836-1843.
- Zochios V, Jones N (2014) akutní syndrom pravého srdce u kriticky nemocného pacienta. Srdeční plicní céva 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Sprej, D, Cecconi M (2015) Počáteční klinické zkušenosti s miniaturní sonda jícnová echokardiografie v srdeční jednotka intenzivní péče. Jaromír Jágr 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971), Výkon pravé komory pod stres: Vztah k pravé koronární průtok. J. Clin Invest 50: 2176-2183.
- cena LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) plicní vaskulární a pravá ventrikulární dysfunkce v kritické péči o dospělé: současné a vznikající možnosti řízení: systematický přehled literatury. Krejčí 14: R169.
- Pfisterer M (2003) postižení pravé komory při infarktu myokardu a kardiogenním šoku. Lancet 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) prediktory nízkého srdečního výdeje při dekompenzovaném těžkém srdečním selhání. Kliniky 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) klinický výsledek urgentního bypassu koronárních tepen. Jaromír Jágr 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) prediktory syndromu nízkého srdečního výdeje po izolované operaci aortální chlopně. Oběh 112: I-448.
- Lomivorotov VV, Efremov SM, Boboško VA, Nikolaev DA, Vedernikov PE, et al. (2013) hodnocení nutričních screeningových nástrojů pro pacienty naplánované na srdeční chirurgii. Výživa 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) Hemoglobin a B-typ natriuretický peptid předoperační hodnoty, ale není zánětlivé markery, jsou spojeny s pooperační morbidity v srdeční chirurgie: prospektivní kohortní analytické studie. Jaromír Jágr 8: 170.
- Lomivorotov VV, Efremov SM, Boboško VA, Leyderman v, Lomivorotov VN, et al. (2011) předoperační celkový počet lymfocytů v periferní krvi jako prediktor špatného výsledku v kardiochirurgii dospělých. Jaromír Jágr 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminální hladiny natriuretického peptidu typu pro-B a časný výsledek po operaci srdce: prospektivní kohortová studie. Breznaník 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) užitečnost natriuretického peptidu typu B při předpovídání pooperačních komplikací a výsledků u pacientů podstupujících operaci srdce. J Am Sb Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) vztah mezi přijímací koncentrací sodíku v séru a klinickými výsledky u pacientů hospitalizovaných pro srdeční selhání: analýza z registru OPTIMIZE-HF. Eur Srdce J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) In-hospital mortality u pacientů s akutní dekompenzace srdečního selhání vyžadujících intravenózní vazoaktivní léky: analýza z Akutní Dekompenzované Srdeční Selhání Národního Registru (DODRŽOVAT). J Am Sb. 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) týmové řízení pacientů se srdečním selháním: prohlášení pro zdravotnické pracovníky z Rady pro kardiovaskulární ošetřovatelství Americké asociace srdce. Oběh 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) omezená spolehlivost fyzických příznaků pro odhad hemodynamiky u chronického srdečního selhání. Jamaová 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) klinické hodnocení identifikuje hemodynamické profily, které předpovídají výsledky u pacientů přijatých se srdečním selháním. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) lékařská terapie akutního infarktu myokardu aplikací hemodynamických podmnožin. N Engl J Med 295: 1356-1362.
- Nohria a, Lewis E, Stevenson LW (2002) lékařské řízení pokročilého srdečního selhání. Jamaová 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) echokardiografie při srdečním selhání: aplikace, utility a nové obzory. J Am Sb Cardiol 50: 381-396.
- NAGUEH SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) echokardiografické hodnocení hemodynamiky u pacientů s dekompenzovaným systolickým srdečním selháním. Circ Cardiovasc 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) doporučení pro kvantifikaci srdeční komory echokardiografií u dospělých: aktualizace americké společnosti echokardiografie a Evropské asociace kardiovaskulárního zobrazování. Eur Heart J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) kritéria vhodnosti pro použití kardiovaskulárního zobrazování při srdečním selhání: zpráva o přezkumu literatury. Eur Heart J Cardiovasc Imaging 16: 147-153.
- Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) neinvazivní hodnocení zobrazování srdce u pacientů s chronickým systolickým srdečním selháním: zpráva Evropské asociace kardiovaskulárního zobrazování (EACVI). Eur Srdce J 35: 3417-3425.
- Vazir a, Cowie MR (2012) hodnocení akutního dekompenzovaného srdečního selhání: strategie a nástroje. Eur Cardiol 8: 128-133.
- Gray A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) neinvazivní ventilace při akutním kardiogenním plicním edému. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) hemodynamické monitorování při akutním srdečním selhání. Crit Péče Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009), intra-aortální balónková pumpa v srdeční selhání řízení: důsledky pro ošetřovatelskou praxi. Austria 22: 125-131.
- Slaughter MS, Singh R (2012) role komorových asistenčních zařízení při pokročilém srdečním selhání. Revista Española de Cardiologia 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) hemodynamické profily pokročilého srdečního selhání: souvislost s klinickými charakteristikami a dlouhodobými výsledky. Jarolím 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) nadřazenost dobutaminu nad dopaminem pro zvětšení srdečního výdeje u pacientů s chronickým srdečním selháním s nízkým výkonem. Oběh 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, et al. (2002) Účinnost a bezpečnost intravenózní levosimendan ve srovnání s dobutaminem v těžkých, low-output srdeční selhání (studie LIDO): randomizované dvojitě zaslepené studii. Lancet 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) Low-výkon, nízká-gradient aortální stenózou u pacientů s depresivní levé komory systolická funkce: klinická užitečnost dobutamin výzvu v katetrizační laboratoři. Oběh 106: 809-813.
- Adamopoulos S, Parisis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) účinky levosimendanu versus dobutaminu na zánětlivé a apoptotické dráhy při akutně dekompenzovaném chronickém srdečním selhání. Amoniak 98: 102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007) Přežít Vyšetřovatele. Levosimendan vs dobutamin u pacientů s akutním dekompenzovaným srdečním selháním: randomizovaná studie SURVIVE. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) senzibilizátor vápníku levosimendan poskytuje vynikající výsledky dobutaminu v pooperačním syndromu nízkého srdečního výdeje. Revista Española de Cardiología (anglické vydání) 61: 471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) nitroprusid sodný pro pokročilé srdeční selhání s nízkým výkonem. J Am Sb. 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan versus intra aortální balónková pumpa u vysoce rizikových srdečních pacientů. Jaromír Jágr 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) srovnání doubutaminu a levosimendanu n jaterní průtok krve u pacientů se stavem nízkého srdečního výdeje po operaci srdce: randomizovaná kontrolovaná studie. Anastasia 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Vliv levosimendan na nízký srdeční výdej syndrom u pacientů s nízkou ejekční frakce koronární tepnu obejít, roubování s kardiopulmonální bypass: LICORN randomizované klinické studii. Jamaová 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan pro hemodynamickou podporu po operaci srdce. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang a, et al. (2017) Levosimendan u pacientů s dysfunkcí levé komory podstupujících srdeční chirurgii. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) inotropní činidla a vazodilatační strategie pro léčbu kardiogenního šoku nebo syndromu nízkého srdečního výdeje. Cochraneova Knihovna. 2 : 1-10.