Pojmy z Biologie – 1. Kanadské Vydání
Viry byly poprvé objeveny po vývoji porcelánový filtr, nazvaný Chamberland-Pasteur filtr, který by mohl odstranit všechny bakterie vidět pod mikroskopem z jakéhokoliv kapalného vzorku. V roce 1886 Adolph Meyer prokázal, že onemocnění tabákových rostlin, onemocnění tabákové mozaiky, by mohlo být přeneseno z nemocné rostliny na zdravou rostlinou prostřednictvím tekutých rostlinných extraktů. V roce 1892 Dmitri Ivanowski ukázal, že toto onemocnění může být přenášeno tímto způsobem i poté, co filtr Chamberland-Pasteur odstranil z extraktu všechny životaschopné bakterie. Přesto to bylo mnoho let předtím, než bylo prokázáno, že tyto „filtrovatelné“ infekční agens nebyly jen velmi malé bakterie, ale byly novým typem drobných částic způsobujících onemocnění.
Virionů, dělená virové částice jsou velmi malé, cca 20-250 nanometrů (1 nm = 1/1,000,000 mm). Tyto jednotlivé virové částice jsou infekční formou viru mimo hostitelskou buňku. Na rozdíl od bakterií (které jsou asi 100krát větší) nevidíme viry světelným mikroskopem, s výjimkou některých velkých virionů rodiny poxvirus (obrázek 12.3).
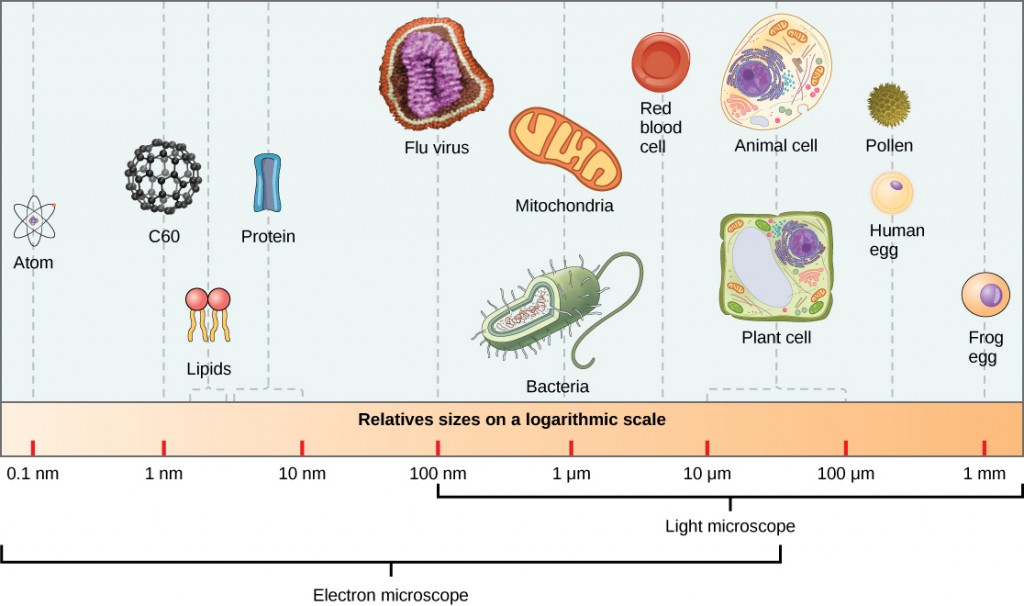
vědci získali první dobrý pohled na strukturu viru tabákové mozaiky (obrázek 12.2) a další. Povrchová struktura virionů může být pozorována jak skenovací, tak transmisní elektronovou mikroskopií, zatímco vnitřní struktury viru lze pozorovat pouze na snímcích z transmisního elektronového mikroskopu (obrázek 12.4).
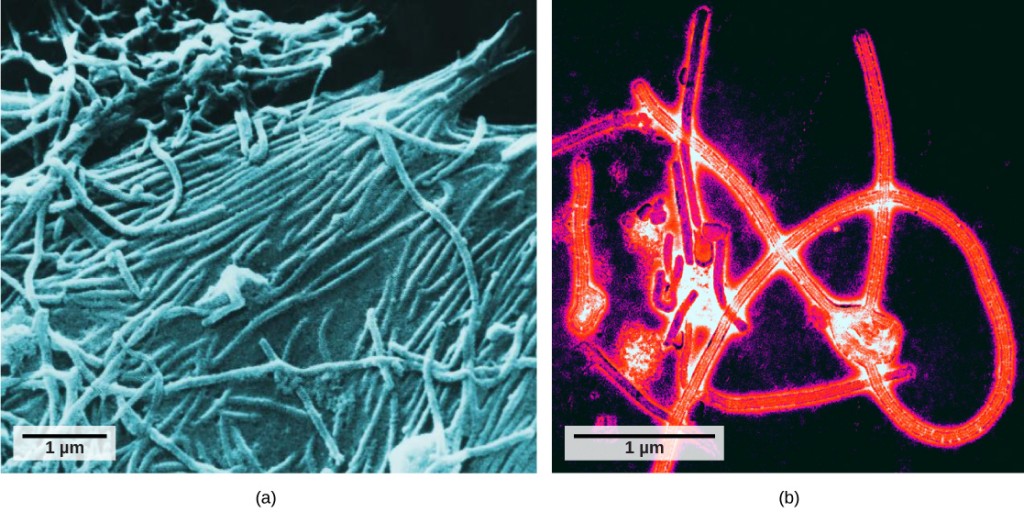
použití této technologie umožnilo objev mnoha viry ze všech typů živých organismů. Zpočátku byly seskupeny podle sdílené morfologie, což znamená jejich velikost, tvar, a rozlišovací struktury. Později byly skupiny virů klasifikovány podle typu nukleové kyseliny, kterou obsahovaly, DNA nebo RNA, a zda byla jejich nukleová kyselina jednovláknová nebo dvouvláknová. Více nedávno, molekulární analýza virových replikačních cyklů dále vylepšila jejich klasifikaci.
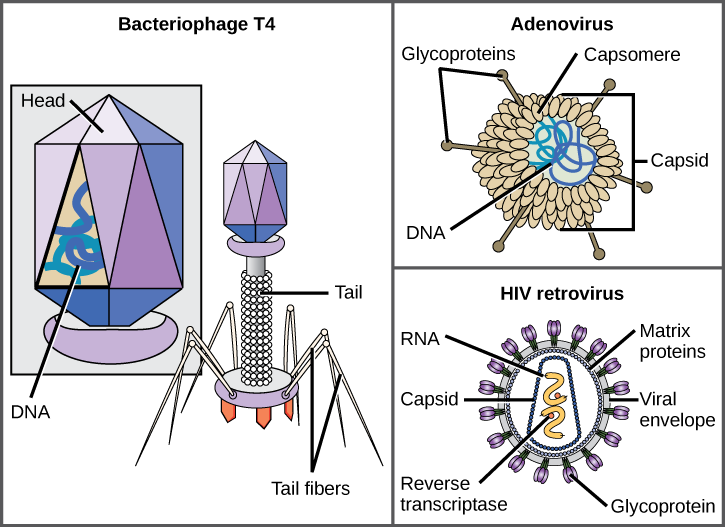
virion se skládá z nukleové kyseliny jádro, vnější proteinový obal, a někdy vnější obal vyrobený z bílkovin a fosfolipidů membrány pocházející z hostitelské buňky. Nejviditelnějším rozdílem mezi členy virových rodin je jejich morfologie, která je poměrně různorodá. Zajímavostí virové složitosti je, že složitost hostitele nekoreluje se složitostí virionu. Některé z nejsložitějších virionových struktur jsou pozorovány u bakteriofágů, virů, které infikují nejjednodušší živé organismy, bakterie.
viry mají mnoho tvarů a velikostí, ale jsou konzistentní a odlišné pro každou virovou rodinu (obrázek 12.5). Všechny viriony mají genom nukleové kyseliny pokrytý ochrannou vrstvou proteinu, nazývanou kapsida. Kapsida je tvořena proteinovými podjednotkami nazývanými kapsomery. Některé virové kapsidy jsou jednoduché polyhedrální „koule“, zatímco jiné mají poměrně složitou strukturu. Vnější struktura obklopující kapsidu některých virů se nazývá virová obálka. Všechny viry používají nějaký druh glykoproteinu k navázání na své hostitelské buňky v molekulách na buňce zvaných virové receptory. Virus využívá tyto molekuly buněčného povrchu, které buňka používá pro nějaký jiný účel, jako způsob, jak rozpoznat a infikovat specifické typy buněk. Například virus spalniček používá u lidí glykoprotein na buněčném povrchu, který normálně funguje v imunitních reakcích a případně v interakci spermie a vajíčka při oplodnění. Připojení je požadavek, aby viry později pronikly buněčnou membránou, vstříkly virový genom a dokončily jejich replikaci uvnitř buňky.
T4 bakteriofág, který infikuje bakterie E. coli, je mezi nejsložitější virion známo; T4 má protein ocas strukturu, že se virus používá se připojit k hostitelské buňky a struktury hlavy, která sídlí v DNA.
Adenovirus, nevelký zvířecí virus, který způsobuje respirační onemocnění u lidí, používá proteinové hroty vyčnívající z jeho kapsomer, aby se připojily k hostitelské buňce. Mezi nevyvinuté viry patří také ty, které způsobují obrnu (poliovirus), plantární bradavice (papilomavirus) a hepatitidu A (virus hepatitidy A). Nevyvinuté viry mají tendenci být robustnější a s větší pravděpodobností přežijí v drsných podmínkách, jako je střevo.
Obalených virionů, jako je HIV (virus lidské imunodeficience), původce AIDS (syndrom získané imunodeficience), skládá se z nukleové kyseliny (RNA, v případě HIV) a proteinů kapsidový obklopen fosfolipidové dvojvrstvy obálky a jeho přidružené proteiny (Obrázek 12.5). Kuřecí neštovice, chřipka a příušnice jsou příklady onemocnění způsobených viry s obálkami. Vzhledem k křehkosti obálky jsou nevelké viry odolnější vůči změnám teploty, pH a některých dezinfekčních prostředků než obalené viry.
Celkově tvar virion, a přítomnost nebo nepřítomnost obálku nám říká něco o tom, co onemocnění viry mohou způsobit nebo co druhy, které by mohly infikovat, ale je stále užitečným prostředkem pro zahájení virové klasifikace.
Který z následujících výroků o virus struktura je pravda?
A) všechny viry jsou uzavřeny ve virové membráně.
B) kapsomery jsou tvořeny malými proteinovými podjednotkami nazývanými kapsidy.
C) DNA je genetický materiál ve všech virech.
D) glykoproteiny pomáhají viru připojit se k hostitelské buňce.
<!–D–>
na Rozdíl od všech živých organismů, které používají DNA jako jejich genetického materiálu, viry mohou využívat buď DNA nebo RNA jako jejich. Jádro viru obsahuje genom nebo celkový genetický obsah viru. Virové genomy bývají ve srovnání s bakteriemi nebo eukaryoty malé a obsahují pouze ty geny, které kódují proteiny, které virus nemůže získat z hostitelské buňky. Tento genetický materiál může být jednovláknový nebo dvouvláknový. Může být také lineární nebo kruhový. Zatímco většina virů obsahuje jeden segment nukleové kyseliny, jiné mají genomy, které se skládají z několika segmentů.
DNA viry mají jádro DNA. Virové DNA řídí hostitelské buňky replikační proteiny syntetizovat nové kopie virového genomu a přepsat a přeložit, že genom do virových proteinů. DNA viry způsobují lidské nemoci, jako jsou plané neštovice, hepatitida B a některé pohlavní nemoci, jako je herpes a genitální bradavice.
RNA viry obsahují ve svých jádrech pouze RNA. Pro replikaci jejich genomů v hostitelské buňce kódují genomy RNA virů enzymy, které se nenacházejí v hostitelských buňkách. Enzymy RNA polymerázy nejsou tak stabilní jako DNA polymerázy a často dělají chyby během transkripce. Z tohoto důvodu se mutace, změny v nukleotidové sekvenci, v RNA virech vyskytují častěji než u DNA virů. To vede k rychlejšímu vývoji a změnám RNA virů. Například skutečnost, že chřipka je RNA virus, je jedním z důvodů, proč je každoročně zapotřebí nová vakcína proti chřipce. Mezi lidská onemocnění způsobená RNA viry patří hepatitida C, spalničky a vzteklina.
viry lze považovat za obligátní intracelulární parazity. Virus se musí připojit k živé buňce, být vzat dovnitř, vyrábět své proteiny a kopírovat svůj genom, a najít způsob, jak uniknout buňce, aby virus mohl infikovat další buňky a nakonec i další jedince. Viry mohou infikovat pouze určité druhy hostitelů a pouze určité buňky v tomto hostiteli. Molekulární základ pro tuto specifičnost je, že konkrétní povrchu molekuly, známé jako virový receptor, musí být nalezen na povrch hostitelské buňky pro virus připojit. Metabolické rozdíly pozorované u různých typů buněk založené na diferenciální genové expresi jsou také pravděpodobným faktorem, ve kterém mohou buňky virus použít k replikaci. Buňka musí vyrábět látky, které virus potřebuje, jako jsou enzymy, pro které samotný genom viru nemá geny, nebo virus nebude schopen replikovat pomocí této buňky.
kroky virových infekcí
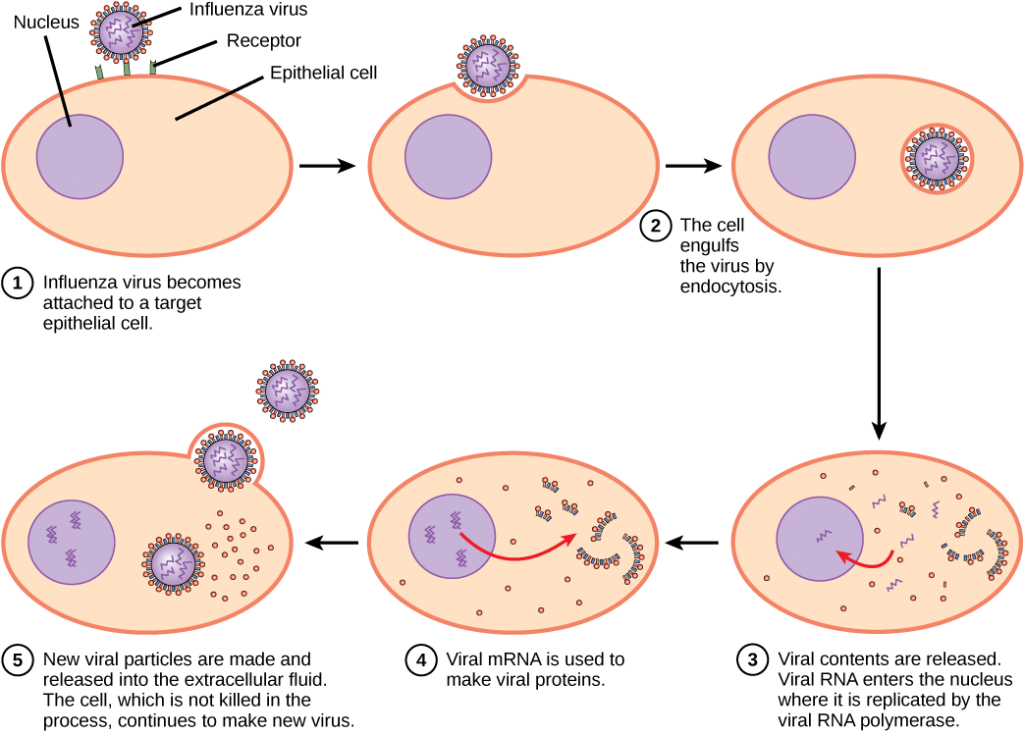
virus musí“ převzít “ buňku, aby se mohl replikovat. Virový replikační cyklus může způsobit dramatické biochemické a strukturální změny v hostitelské buňce, což může způsobit poškození buněk. Tyto změny, nazývané cytopatické účinky, mohou změnit buněčné funkce nebo dokonce zničit buňku. Některé infikované buňky, například infikované virem nachlazení (rhinovirus), umírají lýzou (prasknutím) nebo apoptózou (programovaná buněčná smrt nebo „buněčná sebevražda“) a uvolňují všechny potomky virionů najednou. Příznaky virových onemocnění vyplývají z imunitní odpovědi na virus, který se pokouší kontrolovat a eliminovat virus z těla, a z poškození buněk způsobeného virem. Mnoho živočišných virů, jako je HIV (virus lidské imunodeficience), nechat infikované buňky imunitního systému, proces známý jako nadějné, kde virionů opustit buňku jednotlivě. Během pučícího procesu buňka nepodléhá lýze a není okamžitě zabita. Poškození buněk, které HIV infikuje, však může znemožnit, aby buňky fungovaly jako mediátory imunity, i když buňky zůstávají po určitou dobu naživu. Nejproduktivnější virové infekce sledují podobné kroky v cyklu replikace viru: příloha, penetrace, uncoating, replikace, montáž, a uvolnění.
virus se váže na specifický receptor stránky na hostitelské buněčné membrány prostřednictvím přílohy proteinů kapsidový nebo proteiny, vložený v obálce. Příloha je specifické, a obvykle virus se připojit pouze na buňky jednoho nebo několika druhů a jen některé typy buněk v rámci těchto druhů s příslušnými receptory.
Koncept v Akci

Zobrazení tohoto videa pro vizuální vysvětlení, jak se HIV a chřipky útočí na tělo.
na Rozdíl od živočišných virů, nukleových kyselin bakteriofágů je vstřikován do hostitelské buňky nahý, takže kapsidový vně buňky. Rostlinné a živočišné viry mohou vstoupit do svých buněk endocytózou, ve které buněčná membrána obklopuje a pohltí celý virus. Některé obalené viry vstupují do buňky, když se virová obálka spojí přímo s buněčnou membránou. Jakmile je uvnitř buňky, virová kapsida je degradována a virová nukleová kyselina je uvolněna, která se pak stává dostupnou pro replikaci a transkripci.
replikační mechanismus závisí na virovém genomu. DNA viry se obvykle používají hostitelské buňky, bílkoviny a enzymy, aby se další DNA, který se používá pro kopírování genomu nebo být přepsány do RNA (mRNA), který je pak použit v syntéze proteinů. RNA viry, jako je chřipkový virus, obvykle používají jádro RNA jako šablonu pro syntézu virové genomové RNA a mRNA. Virová mRNA je převedena na virové enzymy a kapsidové proteiny za účelem sestavení nových virionů (obrázek 12.6). Samozřejmě existují výjimky z tohoto vzoru. Pokud hostitelská buňka neposkytuje enzymy nezbytné pro replikaci viru, virové geny dodávají informace k přímé syntéze chybějících proteinů. Retroviry, jako je HIV, mají genom RNA, který musí být reverzní transkribován, aby se vytvořila DNA, která se pak vloží do DNA hostitele. Převést RNA do DNA, retroviry obsahují geny, které kódují virus-specifické enzymu reverzní transkriptázy, která přepisuje RNA templátu DNA. Skutečnost, že HIV produkuje některé ze svých vlastních enzymů, které se nenacházejí v hostiteli, umožnila vědcům vyvinout léky, které tyto enzymy inhibují. Tyto léky, včetně inhibitoru reverzní transkriptázy AZT, inhibují replikaci HIV snížením aktivity enzymu bez ovlivnění metabolismu hostitele.
poslední fázi virové replikace je uvolnění nových virionů do hostitelského organismu, kde jsou schopny infikovat sousední buňky a opakujte cyklus replikace. Některé viry se uvolňují, když hostitelská buňka zemře a jiné viry mohou opustit infikované buňky pučením membránou bez přímého zabití buňky.
virus Chřipky je zabalen do virové obálky, která pojistky s plasmatickou membránu. Tímto způsobem může virus opustit hostitelskou buňku, aniž by ji zabil. Jakou výhodu získá virus udržením hostitelské buňky naživu?
<!- Hostitelská buňka může pokračovat v tvorbě nových virových částic.–>
Koncept v Akci

Klepněte na tlačítko prostřednictvím tohoto tutoriálu na viry identifikovat struktury, způsoby přenosu, replikace, a další.