2.1 : Évolution de la Théorie Atomique
Théorie Atomique après le XIXe siècle
Si la matière était composée d’atomes, de quoi étaient composés les atomes ? S’agissait-il des particules les plus petites ou y avait-il quelque chose de plus petit? À la fin des années 1800, un certain nombre de scientifiques intéressés par de telles questions ont étudié les décharges électriques qui pourraient être produites dans les gaz à basse pression, avec la découverte la plus importante faite par le physicien anglais J. J. Thomson à l’aide d’un tube cathodique. Cet appareil se composait d’un tube de verre scellé dont la quasi-totalité de l’air avait été retirée; le tube contenait deux électrodes métalliques. Lorsque la haute tension était appliquée aux électrodes, un faisceau visible appelé rayon cathodique apparaissait entre elles. Ce faisceau a été dévié vers la charge positive et éloigné de la charge négative, et a été produit de la même manière avec des propriétés identiques lorsque différents métaux ont été utilisés pour les électrodes. Dans des expériences similaires, le rayon était simultanément dévié par un champ magnétique appliqué, et les mesures de l’étendue de la déflexion et de l’intensité du champ magnétique ont permis à Thomson de calculer le rapport charge / masse des particules de rayons cathodiques. Les résultats de ces mesures ont indiqué que ces particules étaient beaucoup plus légères que les atomes (Figure\(\PageIndex{1}\)).
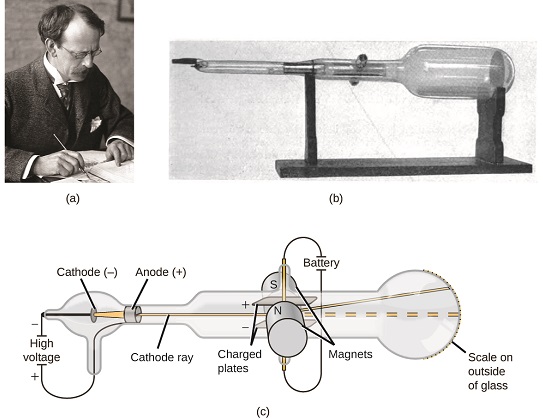
Figure\(\PageIndex{5}\): (a) J. J. Thomson a produit un faisceau visible dans un tube cathodique. (b) Il s’agit d’un tube cathodique ancien, inventé en 1897 par Ferdinand Braun. (c) Dans le rayon cathodique, le faisceau (représenté en jaune) provient de la cathode et est accéléré au-delà de l’anode vers une échelle fluorescente à l’extrémité du tube. Des déviations simultanées par des champs électriques et magnétiques appliqués ont permis à Thomson de calculer le rapport masse/charge des particules composant le rayon cathodique. (crédit a: modification du travail par la Fondation Nobel; crédit b: modification du travail par Eugen Nesper; crédit c: modification du travail par « Kurzon” / Wikimedia Commons).
Sur la base de ses observations, voici ce que Thomson a proposé et pourquoi: Les particules sont attirées par des charges positives (+) et repoussées par des charges négatives (−), elles doivent donc être chargées négativement (comme les charges repoussent et contrairement aux charges attirent); elles sont moins massives que les atomes et indiscernables, quelle que soit la matière source, elles doivent donc être des constituants fondamentaux et subatomiques de tous les atomes. Bien que controversée à l’époque, l’idée de Thomson a été progressivement acceptée, et sa particule cathodique est ce que nous appelons maintenant un électron, une particule subatomique chargée négativement avec une masse plus de mille fois inférieure à celle d’un atome. Le terme ”électron » a été inventé en 1891 par le physicien irlandais George Stoney, de « ion électrique. »
En 1909, plus d’informations sur l’électron ont été découvertes par le physicien américain Robert A. Millikan via ses expériences de « goutte d’huile”. Millikan a créé des gouttelettes d’huile microscopiques, qui pouvaient être chargées électriquement par frottement au fur et à mesure de leur formation ou en utilisant des rayons X. Ces gouttelettes sont initialement tombées sous l’effet de la gravité, mais leur progression vers le bas pourrait être ralentie ou même inversée par un champ électrique plus faible dans l’appareil. En ajustant l’intensité du champ électrique et en effectuant des mesures minutieuses et des calculs appropriés, Millikan a pu déterminer la charge sur des gouttes individuelles (Figure \(\PageIndex{2}\)).
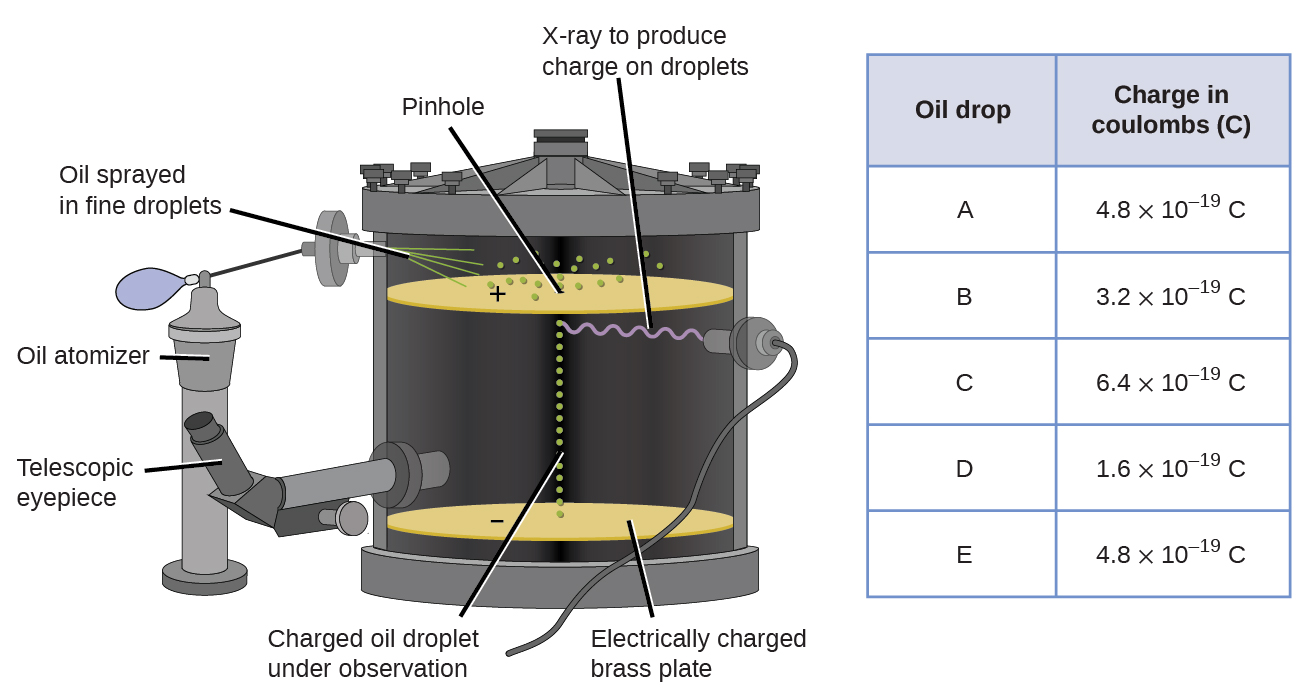
Figure\(\PageIndex{6}\): L’expérience de Millikan a mesuré la charge de gouttes d’huile individuelles. Les données tabulées sont des exemples de quelques valeurs possibles.
En regardant les données de charge recueillies par Millikan, vous avez peut—être reconnu que la charge d’une gouttelette d’huile est toujours un multiple d’une charge spécifique, 1,6 \(\times\) 10-19 C. Millikan a conclu que cette valeur doit donc être une charge fondamentale — la charge d’un seul électron – avec ses charges mesurées dues à un excès d’un électron (1 fois 1.6\(\times\) 10-19 C), deux électrons (2 fois 1,6\(\times\) 10-19 C), trois électrons (3 fois 1,6\(\times\) 10-19 C), et ainsi de suite, sur une gouttelette d’huile donnée. Comme la charge d’un électron était maintenant connue grâce aux recherches de Millikan et que le rapport charge / masse était déjà connu grâce aux recherches de Thomson (1,759 \ (\times\) 1011 C / kg), il suffisait d’un simple calcul pour déterminer également la masse de l’électron.
\
Les scientifiques avaient maintenant établi que l’atome n’était pas indivisible comme Dalton l’avait cru, et grâce aux travaux de Thomson, Millikan et d’autres, la charge et la masse des particules subatomiques négatives — les électrons — étaient connues. Cependant, la partie chargée positivement d’un atome n’était pas encore bien comprise. En 1904, Thomson a proposé le modèle d’atomes ”plum pudding », qui décrivait une masse chargée positivement avec une quantité égale de charge négative sous la forme d’électrons incorporés dans celle-ci, puisque tous les atomes sont électriquement neutres. Un modèle concurrent avait été proposé en 1903 par Hantaro Nagaoka, qui postule un atome de type Saturne, constitué d’une sphère chargée positivement entourée d’un halo d’électrons (Figure\(\PageIndex{3}\)).
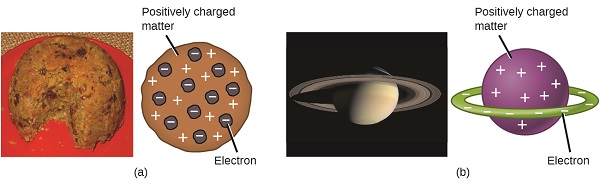
Figure\(\PageIndex{7}\): (a) Thomson a suggéré que les atomes ressemblaient au plum pudding, un dessert anglais composé de gâteau humide avec des raisins secs incorporés (« prunes”). (b) Nagaoka a proposé que les atomes ressemblaient à la planète Saturne, avec un anneau d’électrons entourant une « planète » positive. » (crédit a: modification du travail par « Man vyi » / Wikimedia Commons; crédit b: modification du travail par « NASA” / Wikimedia Commons).
Le prochain développement majeur dans la compréhension de l’atome est venu d’Ernest Rutherford, un physicien de Nouvelle-Zélande qui a largement passé sa carrière scientifique au Canada et en Angleterre. Il a effectué une série d’expériences en utilisant un faisceau de particules alpha chargées positivement à grande vitesse (particules α) produites par la désintégration radioactive du radium; les particules α sont constituées de deux protons et de deux neutrons (vous en apprendrez plus sur la désintégration radioactive dans le chapitre sur la chimie nucléaire). Rutherford et ses collègues Hans Geiger (plus tard célèbre pour le compteur Geiger) et Ernest Marsden ont dirigé un faisceau de particules α, dont la source était intégrée dans un bloc de plomb pour absorber la majeure partie du rayonnement, vers une feuille d’or très mince et ont examiné la diffusion résultante des particules α à l’aide d’un écran luminescent qui brillait brièvement lorsqu’une particule α était touchée.
Qu’ont-ils découvert ? La plupart des particules ont traversé la feuille sans être déviées du tout. Cependant, certains ont été légèrement déviés et un très petit nombre a été dévié presque directement vers la source (Figure \(\PageIndex{4}\)). Rutherford a décrit la découverte de ces résultats: « Ce fut l’événement le plus incroyable qui me soit jamais arrivé dans ma vie. C’était presque aussi incroyable que si vous tiriez un obus de 15 pouces sur un morceau de papier de soie et qu’il revenait et vous frappait ” 1 (p. 68).
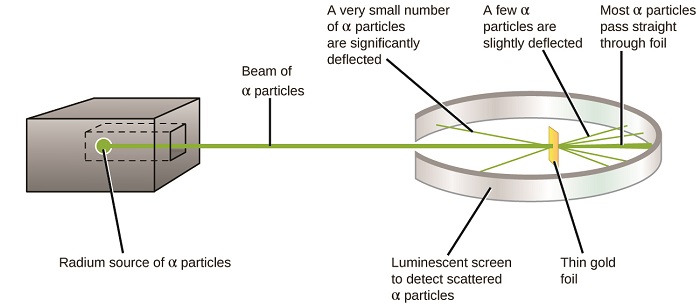
Figure \(\PageIndex{8}\): Geiger et Rutherford ont tiré des particules α sur un morceau de feuille d’or et ont détecté où ces particules allaient, comme le montre ce schéma de leur expérience. La plupart des particules sont passées directement à travers la feuille, mais quelques-unes ont été légèrement déviées et un très petit nombre ont été déviées de manière significative.
Voici ce que Rutherford a déduit: Comme la plupart des particules α se déplaçant rapidement ont traversé les atomes d’or sans être détectées, elles ont dû traverser un espace essentiellement vide à l’intérieur de l’atome. Les particules alpha sont chargées positivement, de sorte que des déviations se produisent lorsqu’elles rencontrent une autre charge positive (comme les charges se repoussent les unes les autres). Étant donné que les charges similaires se repoussent les unes les autres, les quelques particules α chargées positivement qui ont changé de trajectoire brusquement doivent avoir frappé, ou se sont approchées de près, d’un autre corps qui avait également une charge positive hautement concentrée. Comme les déflexions se produisaient une petite fraction du temps, cette charge n’occupait qu’une petite partie de l’espace dans la feuille d’or. Analysant en détail une série de telles expériences, Rutherford a tiré deux conclusions:
- Le volume occupé par un atome doit être constitué d’une grande quantité d’espace vide.
- Un petit corps relativement lourd et chargé positivement, le noyau, doit être au centre de chaque atome.
Cette analyse a conduit Rutherford à proposer un modèle dans lequel un atome est constitué d’un très petit noyau chargé positivement, dans lequel la majeure partie de la masse de l’atome est concentrée, entourée des électrons chargés négativement, de sorte que l’atome est électriquement neutre (Figure \(\PageIndex{5}\)).
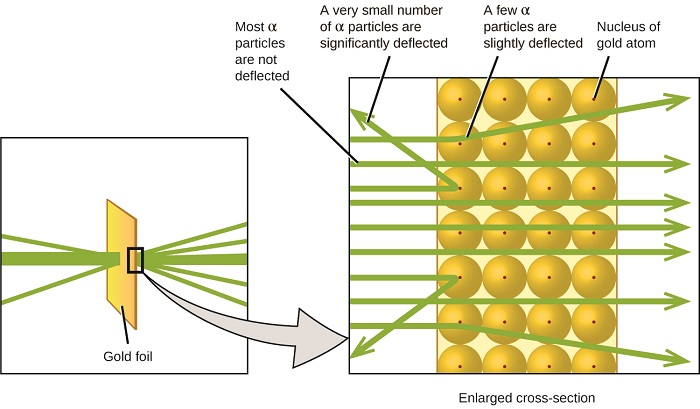
Figure\(\PageIndex{9}\): Les particules α ne sont déviées que lorsqu’elles entrent en collision ou passent près du noyau d’or beaucoup plus lourd et chargé positivement. Comme le noyau est très petit par rapport à la taille d’un atome, très peu de particules α sont déviées. La plupart traversent la région relativement grande occupée par les électrons, qui sont trop légers pour dévier les particules en mouvement rapide.
Après de nombreuses autres expériences, Rutherford a également découvert que les noyaux d’autres éléments contiennent le noyau d’hydrogène comme « bloc de construction”, et il a nommé cette particule plus fondamentale le proton, la particule subatomique chargée positivement trouvée dans le noyau. Avec un ajout, que vous apprendrez ensuite, ce modèle nucléaire de l’atome, proposé il y a plus d’un siècle, est toujours utilisé aujourd’hui.
Une autre découverte importante a été la découverte d’isotopes. Au début des années 1900, les scientifiques ont identifié plusieurs substances qui semblaient être de nouveaux éléments, les isolant des minerais radioactifs. Par exemple, un « nouvel élément” produit par la désintégration radioactive du thorium a initialement reçu le nom de mésothorium. Cependant, une analyse plus détaillée a montré que le mésothorium était chimiquement identique au radium (un autre produit de désintégration), malgré une masse atomique différente. Ce résultat, ainsi que des résultats similaires pour d’autres éléments, ont conduit le chimiste anglais Frederick Soddy à réaliser qu’un élément pouvait avoir des types d’atomes de masses différentes qui étaient chimiquement indiscernables. Ces différents types sont appelés isotopes — atomes du même élément qui diffèrent en masse. Soddy a reçu le prix Nobel de chimie en 1921 pour cette découverte.
Il restait un casse-tête: Le noyau était connu pour contenir presque toute la masse d’un atome, le nombre de protons ne fournissant que la moitié, ou moins, de cette masse. Différentes propositions ont été faites pour expliquer ce qui constituait la masse restante, y compris l’existence de particules neutres dans le noyau. Comme on pouvait s’y attendre, la détection de particules non chargées est très difficile, et ce n’est qu’en 1932 que James Chadwick a trouvé des preuves de neutrons, des particules subatomiques non chargées d’une masse à peu près identique à celle des protons. L’existence du neutron explique également les isotopes: Ils diffèrent en masse car ils ont un nombre différent de neutrons, mais ils sont chimiquement identiques car ils ont le même nombre de protons. Cela sera expliqué plus en détail plus loin dans cette unité.