Chimie d’introduction – 1ère Édition canadienne
Objectifs d’apprentissage
- Définir la pression de vapeur des liquides.
- Expliquer l’origine de la tension superficielle et de l’action capillaire.
Tous les liquides possèdent certaines propriétés. Le liquide que nous connaissons le plus est probablement l’eau, et il a ces propriétés. D’autres liquides en ont aussi, ce qui est quelque chose à garder à l’esprit.
Tous les liquides ont une certaine partie de leurs particules ayant suffisamment d’énergie pour entrer en phase gazeuse, et si ces particules sont à la surface du liquide, elles le font (Figure 10.6 « Évaporation”). La formation d’un gaz à partir d’un liquide à des températures inférieures au point d’ébullition est appelée évaporation. À ces températures, le matériau en phase gazeuse est appelé vapeur, plutôt que gaz ; le terme gaz est réservé lorsque la phase gazeuse est la phase stable.
Figure 10.6Evaporation
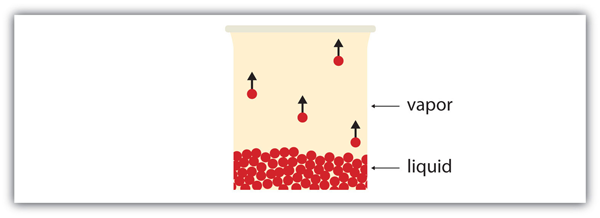
Certaines particules d’un liquide ont suffisamment d’énergie pour s’échapper de la phase liquide pour devenir une vapeur.
Si le volume disponible est suffisamment grand, tout le liquide finira par devenir de la vapeur. Mais si le volume disponible n’est pas suffisant, une partie des particules de vapeur rentrera éventuellement dans la phase liquide (Figure 10.7 « Équilibre”). À un moment donné, le nombre de particules entrant dans la phase vapeur sera égal au nombre de particules sortant de la phase vapeur, de sorte qu’il n’y a pas de changement net de la quantité de vapeur dans le système. Nous disons que le système est à l’équilibre. La pression partielle de la vapeur à l’équilibre est appelée pression de vapeur du liquide.
Figure 10.7 Équilibre

À un moment donné, le nombre de particules entrant dans la phase vapeur sera équilibré par le nombre de particules retournant dans le liquide. Ce point est appelé équilibre.
Comprenez que le liquide n’a pas cessé de s’évaporer. Le processus inverse – la condensation – se produit aussi rapidement que l’évaporation, de sorte qu’il n’y a pas de changement net de la quantité de vapeur dans le système. Le terme équilibre dynamique représente une situation dans laquelle un processus se produit toujours, mais le processus inverse se produit également au même rythme, de sorte qu’il n’y a pas de changement net dans le système.
La pression de vapeur d’une substance dépend de la température de la substance; à mesure que la température augmente, la pression de vapeur augmente également. Figure 10.8 « Graphiques de la pression de vapeur par rapport à la température pour plusieurs liquides » est un graphique de la pression de vapeur par rapport à la température pour plusieurs liquides. Après avoir défini la pression de vapeur, nous pouvons également redéfinir le point d’ébullition d’un liquide: la température à laquelle la pression de vapeur d’un liquide est égale à la pression ambiante environnante. La pression de vapeur normale est donc la température à laquelle la pression de vapeur est de 760 torr, soit exactement 1 atm. Ainsi, les points d’ébullition varient avec la pression environnante, ce qui peut avoir de grandes implications sur la cuisson des aliments à des altitudes inférieures ou supérieures à la normale. La pression atmosphérique varie considérablement avec l’altitude.
Figure 10.8 Graphiques de la Pression de vapeur par rapport à la Température pour Plusieurs liquides
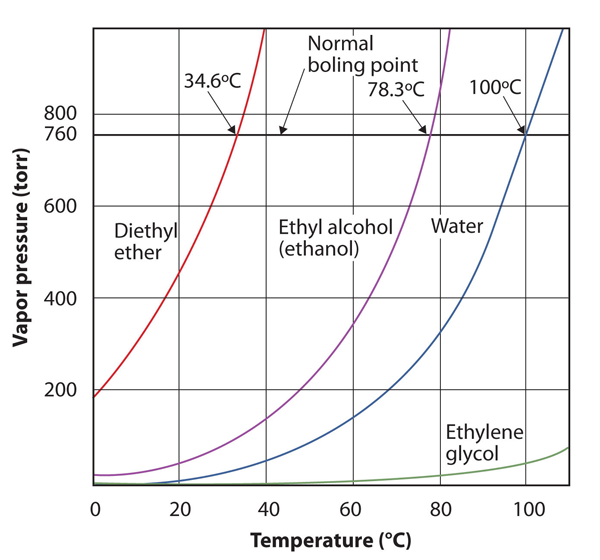
La pression de vapeur d’un liquide dépend de l’identité du liquide et de la température, comme le montre ce graphique.
Exemple 4
Utilisez la figure 10.8 « Graphiques de la Pression de vapeur par rapport à la Température de Plusieurs Liquides » pour estimer le point d’ébullition de l’eau à 500 torr, qui est la pression atmosphérique approximative au sommet du mont Everest.
Solution
Voir la figure ci-jointe. Cinq cents torr sont compris entre 400 et 600, nous étendons donc une ligne à partir de ce point sur l’axe des ordonnées jusqu’à la courbe pour l’eau, puis la descendons sur l’axe des abscisses pour lire la température associée. Il semble que le point de la courbe de pression de vapeur d’eau corresponde à une température d’environ 90 ° C, nous concluons donc que le point d’ébullition de l’eau à 500 torr est de 90 ° C.
Figure 10.9 En utilisant la Figure 10.8 « Graphiques de la Pression de Vapeur par rapport à la Température pour Plusieurs Liquides » pour Répondre à l’exemple 4
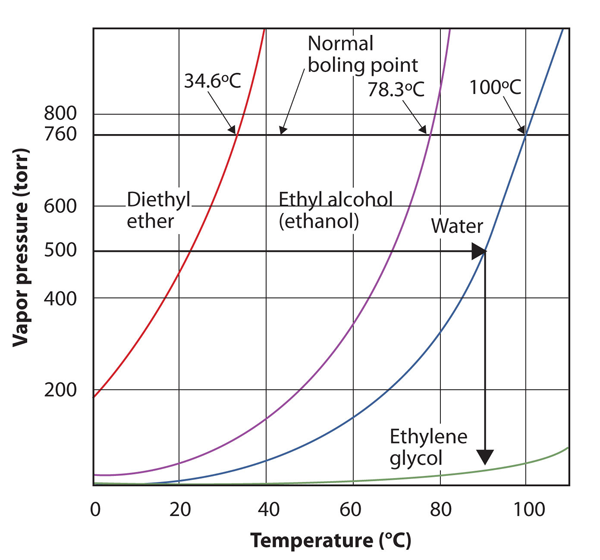
En lisant correctement le graphique, vous pouvez estimer le point d’ébullition d’un liquide à différentes températures.
Testez-vous
Utilisez la figure 10.8 « Graphiques de la Pression de vapeur par rapport à la Température de Plusieurs Liquides” pour estimer le point d’ébullition de l’éthanol à 400 torr.
Réponse
environ 65°C
La courbe de pression de vapeur de l’eau n’est pas exactement nulle au point de fusion — 0°C. Même la glace a une pression de vapeur; c’est pourquoi il se sublime au fil du temps. Cependant, les pressions de vapeur des solides sont généralement beaucoup plus faibles que celles des liquides. À -1°C, la pression de vapeur de la glace est de 4,2 torr. À une température de congélation de -17 ° C (0 ° F), la pression de vapeur de la glace n’est que de 1,0 torr; les congélateurs dits profonds peuvent descendre à -23 ° C, où la pression de vapeur de la glace n’est que de 0,6 torr.
Diagrammes de phase
Un diagramme de phase est une représentation graphique des relations d’équilibre qui existent entre les phases d’une substance sous des pressions et des températures spécifiées (Figure 10.10). Le diagramme de phase est une combinaison de trois courbes : la courbe de pression de vapeur, la courbe de fusion et la courbe de sublimation. Nous avons vu précédemment que les courbes de pression de vapeur représentent l’équilibre entre la phase liquide et gazeuse, et le point où la pression est égale à 1 atm est le point d’ébullition normal. Une caractéristique supplémentaire de cette courbe dans le diagramme de phase (vert), est qu’elle se termine au point critique. Le point critique est le point à la température et à la pression les plus élevées auquel les liquides et les gaz restent distinguables. Aux températures et à la pression au-delà de ce point, la matière existe dans une phase avec des propriétés à la fois liquides et gazeuses connue sous le nom de fluide supercritique.
La courbe de fusion (orange) représente l’équilibre entre solide et liquide, et le point auquel la pression est égale à 1 atm est le point de fusion normal. La courbe de sublimation (bleue) représente l’équilibre qui existe entre le solide et le gaz. Enfin, le point où les trois courbes se rencontrent est connu sous le nom de point triple. À ce stade, trois phases (solide, liquide et gaz) existent toutes à l’équilibre.
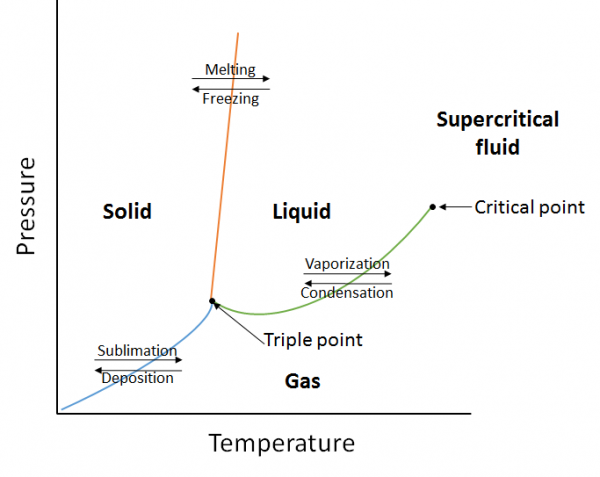
Exemple:
En utilisant le diagramme de phase suivant, déterminez ce qui se passerait si:
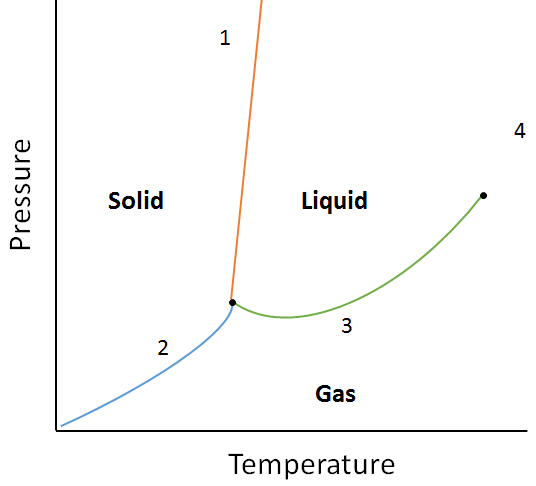
a. La température est augmentée pour la matière au point 1.
b. La pression est augmentée pour la matière au point 3.
Solution:
a. la matière au point 1 fondra (passe de la phase solide à la phase liquide) si la température augmente.
d. La matière au point 3 se condensera (changement de phase du gaz au liquide) si la température est augmentée.
Tension superficielle et Action capillaire
Tous les liquides partagent également d’autres propriétés. La tension superficielle est un effet provoqué par un déséquilibre des forces sur les atomes à la surface d’un liquide, comme le montre la Figure 10.11 « Tension superficielle”. La particule bleue dans la majeure partie du liquide subit des forces intermoléculaires de tout autour, comme illustré par les flèches. Cependant, la particule jaune à la surface ne subit aucune force au-dessus car il n’y a pas de particules au-dessus. Cela conduit à un déséquilibre des forces que nous appelons tension superficielle.
Figure 10.11 Tension superficielle

La tension superficielle provient du fait que les particules à la surface d’un liquide ne subissent pas d’interactions de toutes les directions, ce qui entraîne un déséquilibre des forces à la surface.
Figure 10.12 Effets de la tension superficielle

Source: « wet apple » de cristian ruberti est sous licence Creative Commons Attribution- NonCommercial-ShareAlike 2.0 Générique.