Chimie d’introduction – 1ère Édition canadienne
Objectifs d’apprentissage
- Définir le tampon.
- Identifiez correctement les deux composants d’un tampon.
Comme indiqué à la section 12.4 « Acides et Bases forts et Faibles et leurs Sels », les acides faibles sont relativement courants, même dans les aliments que nous mangeons. Mais nous rencontrons parfois un acide ou une base forte, comme l’acide gastrique, qui a un pH fortement acide de 1,7. Par définition, les acides et bases forts peuvent produire une quantité relativement importante d’ions H+ ou OH− et ont par conséquent des activités chimiques marquées. De plus, de très petites quantités d’acides et de bases forts peuvent modifier très rapidement le pH d’une solution. Si 1 mL d’acide gastrique était ajouté à la circulation sanguine et qu’aucun mécanisme de correction n’était présent, le pH du sang diminuerait d’environ 7,4 à environ 4,7 — un pH qui n’est pas propice à la vie continue. Heureusement, le corps dispose d’un mécanisme pour minimiser ces changements de pH spectaculaires.
Le mécanisme implique un tampon, une solution qui résiste à des changements spectaculaires de pH. Les tampons le font en étant composés de certaines paires de solutés: soit un acide faible plus un sel dérivé de cet acide faible, soit une base faible plus un sel de cette base faible. Par exemple, un tampon peut être composé de HC2H3O2 dissous (un acide faible) et de NaC2H3O2 (le sel dérivé de cet acide faible). Un autre exemple de tampon est une solution contenant du NH3 (une base faible) et du NH4Cl (un sel dérivé de cette base faible).
Utilisons un tampon HC2H3O2 / NaC2H3O2 pour démontrer le fonctionnement des tampons. Si une base forte − une source d’ions OH— (aq) − est ajoutée à la solution tampon, ces ions OH- réagiront avec le HC2H3O2 dans une réaction acide−base:
HC2H3O2 (aq) + OH− (aq) → H2O (ℓ) +C2H3O2− (aq)
Plutôt que de changer radicalement le pH en rendant la solution basique, les ions OH-ajoutés réagissent pour produire du H2O, de sorte que le pH ne change pas beaucoup.
Si un acide fort — une source d’ions H+ — est ajouté à la solution tampon, les ions H+ réagiront avec l’anion du sel. Parce que HC2H3O2 est un acide faible, il n’est pas beaucoup ionisé. Cela signifie que si beaucoup d’ions H+ et d’ions C2H3O2− sont présents dans la même solution, ils se réuniront pour produire HC2H3O2:
H + (aq) + C2H3O2− (aq) → HC2H3O2 (aq)
Plutôt que de changer radicalement le pH et de rendre la solution acide, les ions H+ ajoutés réagissent pour former des molécules d’un acide faible. La figure 12.2 ”Les actions des tampons » illustre les deux actions d’un tampon.
Figure 12.2 Les actions des tampons
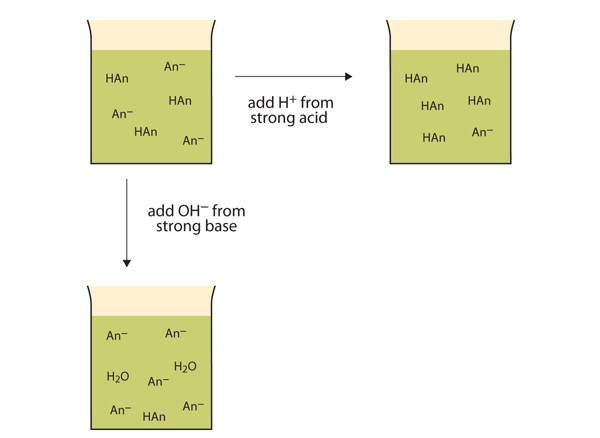
Les tampons peuvent réagir à la fois avec des acides forts (en haut) et des bases fortes (de côté) pour minimiser les changements importants de pH.
Les tampons fabriqués à partir de bases faibles et de sels de bases faibles agissent de la même manière. Par exemple, dans un tampon contenant NH3 et NH4Cl, les molécules NH3 peuvent réagir avec tout excès d’ions H+ introduits par des acides forts :
NH3(aq) + H + (aq) → NH4+ (aq)
tandis que l’ion NH4+ (aq) peut réagir avec tous les ions OH− introduits par des bases fortes:
NH4+(aq) + OH− (aq) → NH3 (aq) + H2O (ℓ)
Exemple 15
Quelles combinaisons de composés peuvent constituer une solution tampon ?
- HCHO2 et NaCHO2
- HCl et NaCl
- CH3NH2 et CH3NH3Cl
- NH3 et NaOH
Solution
- HCHO2 est l’acide formique, un acide faible, tandis que NaCHO2 est le sel fabriqué à partir de l’anion de l’acide faible (l’ion formiate). La combinaison de ces deux solutés constituerait une solution tampon.
- HCl est un acide fort, pas un acide faible, donc la combinaison de ces deux solutés ne ferait pas une solution tampon.
- CH3NH2 est la méthylamine, qui est comme NH3 avec un de ses atomes de H substitué par un groupe CH3. Parce qu’il n’est pas répertorié dans le tableau 12.2 « Acides et Bases forts », on peut supposer que c’est une base faible. Le composé CH3NH3Cl est un sel fabriqué à partir de cette base faible, de sorte que la combinaison de ces deux solutés constituerait une solution tampon.
- NH3 est une base faible, mais NaOH est une base forte. La combinaison de ces deux solutés ne constituerait pas une solution tampon.
Testez-vous
Quelles combinaisons de composés peuvent constituer une solution tampon?
- NaHCO3 et NaCl
- H3PO4 et NaH2PO4
- NH3 et (NH4)3PO4
- NaOH et NaCl
Réponses
- non
- oui
- oui
- non
- non
Tampons ne travaillez bien que pour des quantités limitées d’acide ou de base forte ajoutés. Une fois que l’un ou l’autre soluté a complètement réagi, la solution n’est plus un tampon et des changements rapides de pH peuvent se produire. Nous disons qu’un tampon a une certaine capacité. Les tampons qui contiennent plus de soluté dissous pour commencer ont des capacités plus importantes, comme on pouvait s’y attendre.
Le sang humain a un système tampon pour minimiser les changements extrêmes de pH. Un tampon dans le sang est basé sur la présence de HCO3− et de H2CO3. Avec ce tampon présent, même si un peu d’acide gastrique se retrouvait directement dans la circulation sanguine, le changement du pH du sang serait minime. À l’intérieur de nombreuses cellules du corps, il existe un système tampon basé sur des ions phosphate.
App Alimentation et boissons: L’Acide Qui soulage la douleur
Bien que les médicaments ne soient pas exactement des « aliments et boissons”, nous les ingérons, alors jetons un coup d’œil à un acide qui est probablement le médicament le plus courant: l’acide acétylsalicylique, également connu sous le nom d’aspirine. L’aspirine est bien connue comme analgésique et antipyrétique (réducteur de fièvre).
La structure de l’aspirine est illustrée sur la figure ci-jointe. La partie acide est encerclée; c’est l’atome H dans cette partie qui peut être donné car l’aspirine agit comme un acide Brønsted-Lowry. Comme il n’est pas donné dans le tableau 12.2 « Acides et bases forts”, l’acide acétylsalicylique est un acide faible. Cependant, c’est toujours un acide, et étant donné que certaines personnes consomment des quantités relativement importantes d’aspirine par jour, sa nature acide peut causer des problèmes dans la muqueuse de l’estomac, malgré les défenses de l’estomac contre son propre acide gastrique.
Figure 12.3 La structure moléculaire de l’aspirine

Les atomes encerclés sont la partie acide de la molécule.
Parce que les propriétés acides de l’aspirine peuvent être problématiques, de nombreuses marques d’aspirine proposent une forme « aspirine tamponnée” du médicament. Dans ces cas, l’aspirine contient également un agent tampon — généralement du MgO — qui régule l’acidité de l’aspirine pour minimiser ses effets secondaires acides.
Aussi utile et commune que soit l’aspirine, elle a été officiellement commercialisée comme médicament à partir de 1899. La Food and Drug Administration (FDA), l’agence gouvernementale chargée de superviser et d’approuver les médicaments aux États-Unis, n’a été créée qu’en 1906. Certains ont fait valoir que si la FDA avait été formée avant l’introduction de l’aspirine, l’aspirine n’aurait peut—être jamais été approuvée en raison de son potentiel d’effets secondaires – saignements gastro-intestinaux, bourdonnements dans les oreilles, syndrome de Reye (un problème de foie) et certaines réactions allergiques. Cependant, récemment, l’aspirine a été vantée pour ses effets sur la réduction des crises cardiaques et des accidents vasculaires cérébraux, il est donc probable que l’aspirine soit là pour rester.
Points à retenir
- Un tampon est une solution qui résiste aux changements soudains de pH.
Exercices
-
Définir le tampon. Quels sont les deux composants chimiques connexes nécessaires pour fabriquer un tampon?
-
Un tampon peut-il être fabriqué en combinant un acide fort avec une base forte? Pourquoi ou pourquoi pas ?
-
Quelles combinaisons de composés peuvent constituer un tampon? Supposons des solutions aqueuses.
a)HCl et NaCl
b) HNO2 et NaNO2
c) NH4NO3 et HNO3
d) NH4NO3 et NH3
4. Quelles combinaisons de composés peuvent constituer un tampon? Supposons des solutions aqueuses.
a) H3PO4 et Na3PO4
b) NaHCO3 et Na2CO3
c) NaNO3 et Ca(NO3)2
d)HN3 et NH3
5. Pour chaque combinaison de l’exercice 3 qui est un tampon, écrivez les équations chimiques pour les réactions des composants du tampon lorsqu’un acide fort et une base forte sont ajoutés.
6. Pour chaque combinaison de l’exercice 4 qui est un tampon, écrivez les équations chimiques pour les réactions des composants du tampon lorsqu’un acide fort et une base forte sont ajoutés.
7. Le système tampon phosphate complet est basé sur quatre substances: H3PO4, H2PO4-, HPO42- et PO43-. Quelles solutions tampons différentes peuvent être fabriquées à partir de ces substances?
8. Expliquez pourquoi le NaBr ne peut pas être un composant d’un tampon acide ou basique.
9. On réalise deux solutions contenant les mêmes concentrations de solutés. Une solution est composée de H3PO4 et de Na3PO4, tandis que l’autre est composée de HCN et de NaCN. Quelle solution devrait avoir la plus grande capacité en tant que tampon?
10. On réalise deux solutions contenant les mêmes concentrations de solutés. Une solution est composée de NH3 et NH4NO3, tandis que l’autre est composée de H2SO4 et Na2SO4. Quelle solution devrait avoir la plus grande capacité en tant que tampon?
Réponses
Un tampon est la combinaison d’un acide ou d’une base faible et d’un sel de cet acide ou de cette base faible.
a) non
b) oui
c) non
d) oui
3b: acide fort: NO2−+ H + → HNO2; base forte: HNO2 + OH − → NO2−+ H2O; 3d: base forte: NH4 ++ OH − → NH3 + H2O; acide fort: NH3 + H + → NH4 +7.
Les tampons peuvent être constitués de trois combinaisons: (1) H3PO4 et H2PO4-, (2) H2PO4− et HPO42−, et (3) HPO42− et PO43−. (Techniquement, un tampon peut être fabriqué à partir de deux composants quelconques.)
Le tampon phosphate doit avoir la plus grande capacité.