Chimie pour les Non-Majors
Comment l’énergie de ce travailleur change-t-elle lorsqu’il monte et descend l’échelle?
Monter une échelle demande de l’énergie. À chaque étape, vous vous opposez à la gravité et accumulez de l’énergie potentielle. Redescendre libère cette énergie potentielle lorsque vous descendez pas à pas. Si vous ne faites pas attention, vous pouvez libérer cette énergie potentielle en même temps lorsque vous tombez de l’échelle (ce n’est jamais une bonne idée). De plus, vous prenez la montée ou la descente par étapes. Il n’y a pas de position « entre les deux” sur l’échelle – votre pied frappe un échelon ou il frappe un espace vide et vous êtes en difficulté jusqu’à ce que vous trouviez un échelon sur lequel vous tenir debout.

Suite aux découvertes des spectres d’émission d’hydrogène et de l’effet photoélectrique, le physicien danois Niels Bohr (1885-1962) a proposé un nouveau modèle de l’atome en 1915. Bohr a proposé que les électrons ne rayonnent pas d’énergie lorsqu’ils orbitent autour du noyau, mais existent dans des états d’énergie constante qu’il a appelés états stationnaires. Cela signifie que les électrons orbitent à des distances fixes du noyau (voir Figure ci-dessous). Les travaux de Bohr étaient principalement basés sur les spectres d’émission de l’hydrogène. Ceci est également appelé le modèle planétaire de l’atome. Il a expliqué le fonctionnement interne de l’atome d’hydrogène. Bohr a reçu le prix Nobel de physique en 1922 pour ses travaux.
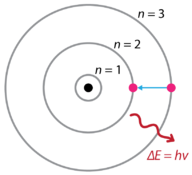
Figure 1. Spectres d’émission d’hydrogène du modèle atomique de Bohr.
Bohr a expliqué que les électrons peuvent être déplacés sur différentes orbites avec l’ajout d’énergie. Lorsque l’énergie est retirée, les électrons reviennent à leur état fondamental, émettant une quantité d’énergie correspondante – un quantum de lumière, ou photon. Ce fut la base de ce qui devint plus tard connu sous le nom de théorie quantique. C’est une théorie basée sur le principe que la matière et l’énergie ont les propriétés des particules et des ondes. Il rend compte d’un large éventail de phénomènes physiques, y compris l’existence de paquets discrets d’énergie et de matière, le principe d’incertitude et le principe d’exclusion.
Selon le modèle de Bohr, souvent appelé modèle planétaire, les électrons encerclent le noyau de l’atome dans des chemins admissibles spécifiques appelés orbites. Lorsque l’électron est sur l’une de ces orbites, son énergie est fixe. L’état fondamental de l’atome d’hydrogène, où son énergie est la plus faible, est lorsque l’électron est sur l’orbite la plus proche du noyau. Les orbites qui sont plus éloignées du noyau sont toutes d’énergie successivement plus grande. L’électron n’est autorisé à occuper aucun des espaces entre les orbites. Une analogie quotidienne avec le modèle de Bohr est les échelons d’une échelle. Lorsque vous montez ou descendez une échelle, vous ne pouvez occuper que des échelons spécifiques et ne pouvez pas être dans les espaces entre les échelons. Monter l’échelle augmente votre énergie potentielle, tandis que descendre l’échelle diminue votre énergie.
Les travaux de Bohr ont eu une forte influence sur notre compréhension moderne du fonctionnement interne de l’atome. Cependant, son modèle a bien fonctionné pour une explication des émissions de l’atome d’hydrogène, mais était sérieusement limité lorsqu’il était appliqué à d’autres atomes. Peu de temps après que Bohr a publié son modèle planétaire de l’atome, plusieurs nouvelles découvertes ont été faites, ce qui a abouti, encore une fois, à une vision révisée de l’atome.
Résumé
- Le modèle de Bohr postule que les électrons orbitent autour du noyau à des niveaux d’énergie fixes.
- Des orbites plus éloignées du noyau existent à des niveaux d’énergie plus élevés.
- Lorsque les électrons reviennent à un niveau d’énergie inférieur, ils émettent de l’énergie sous forme de lumière.
Pratique
Utilisez le lien ci-dessous pour répondre aux questions suivantes:
- Comment un électron change-t-il ses orbites?
- Sur quoi le modèle Bohr était-il basé ?
- Qu’est-ce que Bohr croyait des orbites ?
- Le modèle de Bohr fonctionne-t-il pour tous les atomes ?
Revue
- Quand Bohr a-t-il proposé son modèle de l’atome ?
- Qu’est-ce qu’un état stationnaire ?
- Quel est l’état fondamental ?
- L’électron peut-il occuper un espace quelconque entre les orbites ?
Glossaire
- modèle planétaire: Une façon de décrire le modèle de l’atome de Bohr.
- théorie quantique: La matière et l’énergie ont les propriétés des particules et des ondes.
- état stationnaire : Les électrons orbitent à distance fixe du noyau.