Jetez un coup d’œil aux articles récents
Résumé
L’insuffisance cardiaque à faible débit (LoHF) est une forme peu commune d’insuffisance cardiaque (HF) mais qui signale une HF très avancée. Elle est associée à un pronostic inquiétant ainsi qu’à une morbidité et une mortalité importantes. Cependant, le LoHF reste largement sous-étudié. La description traditionnelle de l’HF se concentrait sur l’insuffisance cardiaque congestive (ICC) marquée par un faible débit cardiaque et accompagnée d’une congestion pulmonaire / périphérique. Cette attention a contribué à la sous-appréciation des patients atteints de FSSL qui présentent peu ou pas de signes de congestion. De plus, les patients atteints de LoHF n’ont pas de traitement éprouvé et le choix du traitement approprié dépend de la physiopathologie individuelle et de l’étiologie sous-jacente. Les patients de LoHF ont une étiologie et une physiopathologie hétérogènes soulignant l’importance d’une compréhension approfondie de ses caractéristiques cliniques, de son diagnostic et de sa prise en charge clinique, qui constitue la base de la présente revue.
Mots clés
syndrome cardiaque à faible débit, insuffisance cardiaque à faible débit, état à faible débit
Introduction
Malgré des progrès remarquables dans les thérapies médicales et chirurgicales, la prise en charge efficace de l’insuffisance cardiaque continue de poser des défis importants aux fournisseurs de soins de santé. Le défi se traduit par des taux élevés de réadmissions hospitalières liées aux HF ainsi qu’une mortalité et une morbidité accrues. Une partie du défi est l’étiologie, la physiopathologie et les présentations cliniques très hétérogènes de différentes formes d’HF, dans lesquelles certaines formes d’HF ont un manque de données d’essais cliniques et par conséquent une compréhension limitée. En particulier, la description traditionnelle de la FH a été presque synonyme d’insuffisance cardiaque congestive (ICC), mais le terme ICC exclut une minorité de patients atteints de FH qui présentent peu ou pas de symptômes démontrables de congestion pulmonaire et / ou périphérique. HF à faible sortie (LoHF) a également été lié à un pronostic inquiétant et des signaux HF très avancés. De plus, les différences symptomatiques et physiopathologiques de l’ICC et de la LoHF soutiennent la nécessité de différentes approches de prise en charge clinique. Malgré ces différences, les thérapies HF traditionnelles ont été généralisées à toutes les formes d’HF, y compris l’CHF et la LoHF, créant un besoin clinique de comprendre la physiopathologie, le diagnostic et la prise en charge clinique de la LoHF. Dans cet article, nous agrégeons les données publiées sur la LoHF en termes d’épidémiologie, d’étiologie, de physiopathologie, de diagnostic et de prise en charge clinique. L’intention est de réorganiser les connaissances sur l’état clinique du LoHF ainsi que d’améliorer la prise en charge clinique de l’HF en général.
Définition
L’insuffisance cardiaque est un syndrome clinique complexe caractérisé par des anomalies myocardiques structurelles et/ ou fonctionnelles entraînant une altération du remplissage ou de l’éjection ventriculaire. La complexité du syndrome est évidente dans ses classifications hétérogènes: droite, gauche ou bi-ventriculaire en fonction de la localisation du défaut; aiguë ou chronique en fonction du moment d’apparition; fraction d’éjection préservée, limite ou réduite en fonction de l’état fonctionnel; sortie faible ou élevée basée sur le débit cardiaque (CO), et défaillance avant ou arrière basée sur la direction du flux sanguin. Chacune de ces classifications est significative pour le diagnostic et le traitement de l’HF. Malgré les différentes classifications, le terme CHF a traditionnellement été utilisé de manière interchangeable avec HF mais qui ne décrit pas suffisamment LoHF en raison de plusieurs différences symptomatiques et physiopathologiques.
Le LoHF, également appelé faible CO dans l’HF décompensée aiguë, décrit une forme d’HF à haute acuité caractérisée par une diminution du CO vers l’avant (indice cardiaque <2.0 L / min / m2 et pression artérielle systolique < 90 mmHg) et hypoperfusion des organes terminaux avec peu ou pas de signes de congestion pulmonaire. La LoHF est distincte de l’ICC, qui décrit l’HF caractérisée par une réduction du CO provoquant une congestion pulmonaire et périphérique conduisant respectivement à une dyspnée et à un œdème périphérique. Les lignes directrices de la Société européenne de cardiologie (ESC) de 2005 sur le diagnostic et la prise en charge de l’HF suggèrent un continuum allant du syndrome de faible débit cardiaque (LCOS) au LoHF en passant par le choc cardiogénique. Les lignes directrices de l’ESC définissent le choc cardiogénique comme la preuve d’une perfusion tissulaire induite par l’HF après la correction d’une pré-charge caractérisée par une pression artérielle systolique < 90 mmHg ou une baisse de la pression artérielle moyenne > 30 mmHg; débit urinaire < 0,5 ml/ kg/h; fréquence du pouls > 60 battements par minute (bpm) avec ou sans preuve de congestion. D’autre part, la LCOS est fréquente chez les patients HF postopératoires et définie comme la nécessité d’une pompe à ballonnet intra-aortique postopératoire ou d’un soutien inotrope pendant plus de 30 minutes dans un cadre de soins actifs.
Épidémiologie
La prévalence et l’incidence exactes de la LoHF dans la population générale sont totalement inconnues. À l’heure actuelle, il n’existe pas de données épidémiologiques basées sur la population spécifiques à LoHF. Les seules données disponibles proviennent d’essais cliniques centralisés portant sur une population sélectionnée de patients atteints de FH ayant subi une chirurgie cardiaque. En 1975, Parr et coll. a fait la description séminale de l’entité clinique de LCOS et a rapporté une incidence de 25% chez les enfants ayant subi une chirurgie cardiaque sur la base d’une diminution du CO définie comme CI < 2,0 L / min / m2. Deux décennies plus tard, Wernovsky et al. a démontré la même incidence de LCOS postopératoires chez les patients ayant subi une opération de commutation artérielle survenant dans les 6 à 18 heures suivant la chirurgie. De nombreux essais cliniques récents signalent une grande variation de la prévalence, de 3,6% (hommes) et 5,9% (femmes) à 9,1% et à 41% et une incidence de 14,7%. Dans un long terme récent (vingt ans: 1990-2009) essai clinique prospectif impliquant 25 176 patients ayant subi une chirurgie de dérivation de l’artère coronaire consécutive, Algarni et al. la prévalence des LCOS postopératoires a diminué de manière significative, passant de 9,1 % (1990-1994) à 2,4 % (2005-2009).
Étiologie
L’étiologie de LoHF est multifactorielle. Généralement, il s’agit d’une conséquence d’un dysfonctionnement du ventricule gauche (VG), du ventricule droit (RV) ou du ventricule systémique (anatomie d’un ventricule unique) et peut inclure un dysfonctionnement systolique et / ou diastolique ou les deux. Les perturbations du remplissage ou de l’éjection ventriculaire entraînent une LoHF, qui est une complication fréquente chez les patients ayant subi une chirurgie cardiaque ou en état de choc cardiogénique. Il peut se présenter comme une détérioration aiguë chez les patients atteints d’HF chronique ou il peut s’agir d’un épisode transitoire et réversible avec résolution du déclencheur aigu. C’est un syndrome clinique considéré comme la voie finale d’une multitude de maladies affectant la fonction cardiaque. Il ne suffit pas de poser un diagnostic de LoHF, la cause sous-jacente ou le déclencheur doit également être déterminé et, si possible, traité. Le tableau 1 fournit un résumé des conditions provoquant un état de faible rendement chez les patients atteints d’HF.
Tableau 1. Étiologie de l’état de faible sortie par physiopathologie
|
Mécanismes |
Conditions causales |
|
Perte de contractilité myocardique |
Maladie coronarienne, cardiomyopathie, myocardite, HF chronique décompensée, chirurgie post-cardiaque, toxines, nutrition (obésité) m maladies infiltrantes, insuffisance rénale terminale, maladie de Chagas ou infection à VIH |
|
Insuffisance de remplissage ou d’éjection ventriculaire |
Péricardite, épanchement péricardique, tamponnade cardiaque, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
La compréhension actuelle de la physiopathologie du LoHF repose en grande partie sur les données probantes des essais cliniques sur des patients atteints de CABG postopératoires. La caractéristique pathologique est un CO excessivement déprimé accompagné d’une hypoperfusion de l’organe terminal. Physiologiquement, le cœur fonctionne comme une pompe pour distribuer le sang oxygéné en quantité suffisante pour satisfaire les besoins métaboliques des tissus. Étant donné que les besoins métaboliques varient dans des situations normales et stressantes, le CO varie également pour satisfaire cette demande dynamique. La phase diastolique du cycle cardiaque est critique chez les patients atteints de LoHF car c’est lors de la relaxation ventriculaire que le remplissage coronarien se produit pour fournir une oxygénation myocardique. La fréquence cardiaque (HR) est également importante dans la diastole car une HR trop rapide empêche le cœur d’obtenir une relaxation et une perfusion myocardiques complètes. Ainsi, le dysfonctionnement cardiaque résulte d’un trouble cardiaque structurel (anomalie cardiaque résiduelle) ou fonctionnel (troubles du remplissage ou de la vidange ventriculaire, ou augmentation de la résistance vasculaire systémique).
Physiopathologiquement, le CO dépend de la HR et du volume de course (SV) (CO = HR * SV). Le volume de course à son tour est le produit net de trois variables de circulation interdépendantes: précharge, postcharge et contractilité. Si un ou plusieurs de ces composants sont altérés, un état de débit cardiaque faible peut se développer. De plus, ces composants affectent à la fois les phases systolique et diastolique du cycle cardiaque, provoquant un dysfonctionnement systolique du VG / RV et / ou un dysfonctionnement diastolique également appelé HF avec fraction d’éjection préservée (Figure 1). D’autres conditions telles que la cardiopathie valvulaire, l’hypertension pulmonaire (PH), le dysfonctionnement de la valve mécanique et l’insuffisance respiratoire peuvent précipiter ou aggraver le développement de la LoHF.
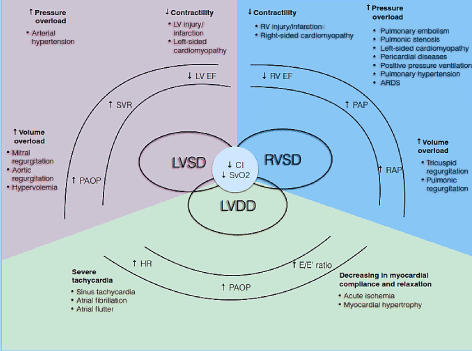
Figure 1. Mécanismes physiopathologiques de l’insuffisance cardiaque à faible débit
Causes courantes et typiques; les symptômes de la LoHF sont inclus. Les principaux mécanismes physiopathologiques de la LoHF sont le dysfonctionnement ventriculaire: Dysfonctionnement systolique et / ou diastolique du VG et dysfonctionnement systolique du VG, qui partagent tous des caractéristiques pathologiques communes de réduction de l’indice cardiaque (IC) et de réduction de la saturation en oxygène veineux mixte (SvO2). La dysfonction systolique du VG et du VR résulte d’une surcharge de pression accrue, d’une surcharge volumique accrue et d’une diminution de la contractilité, tandis que la dysfonction diastolique du VG résulte d’une tachycardie sévère et d’une diminution de la compliance et de la relaxation myocardiques. Adapté de Lomivorotov et al. 2017, p. 293
Dysfonction ystolique du VG
La dysfonction systolique du ventricule gauche (VG) (ou fraction d’éjection du VG déprimée) est le mécanisme physiopathologique le plus fréquent observé chez les patients atteints de FLO. Les variables circulatoires affectant la fonction systolique du VG sont la précharge, après la charge et la contractilité. Généralement, le dysfonctionnement systolique du VG est une conséquence de la perte ou de la réduction des cardiomyocytes fonctionnels résultant d’une nécrose due à une altération de la circulation coronaire et à une ischémie, d’une lésion de reperfusion ou du phénomène naturel moins compris de l’apoptose des cardiomyocytes. La perte de cardiomyocytes fonctionnels peut être transitoire comme on le voit lors de l’étourdissement myocardique défini comme un myocarde viable récupéré par reperfusion coronaire, qui présente un dysfonctionnement post-ischémique prolongé après reperfusion. La perte de cardiomyocyte fonctionnel peut également être réfractaire à l’inversion dans des conditions telles que l’infection; tachycardie; maladie valvulaire; troubles métaboliques tels que l’acidose, l’hypoglycémie, l’hypocalcémie; exposition à des toxines cardiaques et à des produits chimiques environnementaux; cardiomyopathie dilatée idiopathique (DCM); et des troubles génétiques tels que le DCM familial, la cardiomyopathie hypertrophique et les dystrophies musculaires. Une réponse cardiaque altérée à la précharge entraîne une diminution spectaculaire de l’apport de CO et d’oxygène à d’autres organes clés du corps, une pression auriculaire élevée, une pression de coin capillaire et un œdème pulmonaire cardiogénique. Bien que les modifications compensatoires du VG s’adaptent à une pression artérielle systémique relativement élevée, une augmentation significative de la postcharge peut induire un dysfonctionnement systolique du VG.
Dysfonction diastolique du VG
Bien que peu fréquente, la LoHF peut se développer chez les patients présentant une dysfonction diastolique du VG avec FEVG préservée. La condition résulte de l’incapacité de la chambre ventriculaire à se remplir d’un volume de sang adéquat malgré une précharge normale, qui se présente comme un dysfonctionnement diastolique. Des conditions sous-jacentes telles qu’une tachycardie sévère, une diminution de la compliance myocardique ou une relaxation ventriculaire anormale altèrent la relaxation et le remplissage du VG pendant la phase diastolique du cycle cardiaque. Au niveau des cardiomyocytes, ces conditions sont associées à l’élimination du calcium du cytosol et à l’homéostasie du calcium, à l’adéquation du décollement du pont transversal et au trouble fonctionnel intrinsèque de l’élément cytosquelettique. Le détachement du pont transversal peut contribuer à retarder le temps de relaxation isovolumique, ce qui entraîne une diminution du volume de course VG, en particulier à des heures plus élevées. La relaxation du VG dépend également de la recapture des ions calcium réticulaires sarcoplasmiques et de la signalisation de l’oxyde nitrique, qui facilitent également le détachement du pont transversal. Étant donné que le processus de détachement du pont transversal consomme de l’énergie, il peut provoquer un déficit d’énergie myocardique et par conséquent ralentir la relaxation myocardique du VG.
Bien que la dysfonction diastolique soit un phénomène répandu observé chez jusqu’à 70% des patients cardiaques postopératoires, la dysfonction diastolique à elle seule est insuffisante pour expliquer le développement de l’HF aiguë. Dans le cadre d’autres conditions cliniques telles que la fibrillation auriculaire (FA), la circulation coronarienne altérée et l’hypertension artérielle, un dysfonctionnement diastolique peut entraîner un état décompensé, et donc considéré comme un signe précoce d’ischémie myocardique. La relation dynamique entre les fonctions diastolique et systolique du VG contribue également à la dysfonction diastolique chez les patients atteints de LoHF. La stimulation de la catécholamine inotrope affecte à la fois la diastole et la systole et peut améliorer la dysfonction diastolique. La FEVG déprimée entraîne une augmentation du volume systolique final et prolonge la phase diastolique du cycle cardiaque.
Dysfonctionnement du RV
Dans le LoHF, en particulier après une chirurgie de l’artère coronaire, les principaux mécanismes physiopathologiques du dysfonctionnement du RV comprennent une augmentation de la précharge, une augmentation de la postcharge, une altération de la perfusion de l’artère coronaire droite et une diminution de la contractilité. Contrairement à l’artère coronaire gauche, la perfusion de l’artère coronaire droite se produit à la fois pendant la diastole et la systole. La présence de PH provoque une augmentation de la pression de VR entraînant une diminution de la perfusion de l’artère coronaire droite, ce qui explique l’importance pour assurer une circulation coronaire droite et gauche optimale. Chez les patients qui ont subi une chirurgie de l’artère coronaire, un dysfonctionnement du RV peut se développer à la suite d’une combinaison de mécanismes. L’ischémie et l’infarctus périopératoires du RV sont les principales causes d’altération de la contractilité du RV. La régurgitation tricuspide ou pulmonique est une cause fréquente de précharge volumique accrue tandis que la maladie valvulaire du côté gauche ou la cardiomyopathie, le PH ou l’embolie pulmonaire (EP), le syndrome de détresse respiratoire aiguë et la ventilation à haute pression positive sont des causes courantes de surcharge de pression. Étant donné que le RV permet normalement une perfusion à basse pression du système vasculaire pulmonaire, il est très sensible même aux augmentations modérées de la pression artérielle pulmonaire (PAP). Une défaillance du VR peut se développer dans le réglage du PH ou une contractilité altérée associée à une progression rapide de la dilatation du VR entraînant une augmentation de la pression du VR en fin de diastole. Ces altérations physiologiques peuvent provoquer un déplacement du septum inter ventriculaire vers une chambre VG déjà sous-remplie et entraîner par conséquent une réduction de la précharge VG et une diminution du CO.
Facteurs de risque
Les facteurs de risque pour le LoHF restent un domaine sous-étudié. Cependant, peu de données disponibles provenant d’essais cliniques sur HF et de patients LCOS postopératoires fournissent des informations précieuses sur les facteurs de risque et les prédicteurs de la LoHF. Dans l’analyse de 452 patients hospitalisés avec une HF décompensée et un débit cardiaque faible, les facteurs de risque significatifs de LoHF étaient la maladie de Chagas (risque relatif: 3,66), la fraction d’éjection déprimée (RR: 2,41), l’hyponatrémie (RR: 1,62) et la dysfonction rénale (RR: 1,92). Les facteurs de risque de LoHF postopératoire comprennent une altération de la fonction VG (< 50%), une CABG à la pompe, une chirurgie d’urgence ou de pontage cardiopulmonaire (CPB), une revascularisation incomplète, un âge > 65 ans et une présence combinée de diabète sucré et de dysfonctionnement rénal préopératoire. En plus des facteurs de risque du patient et de l’opération, les prédicteurs biochimiques de la LoHF chez les patients postopératoires sont le faible taux d’hémoglobine, le nombre total de lymphocytes < 2000 cellules / µL et les niveaux préopératoires de peptides natriurétiques sériques. Au cours des deux dernières décennies, les tendances de certains facteurs de risque reconnus ont changé. Des facteurs tels que l’hypertension, le sexe féminin, la maladie des vaisseaux triples et la maladie principale gauche ne sont plus statistiquement significatifs tandis que le risque associé à la fraction d’éjection préopératoire déprimée a doublé.
Diagnostic
Il n’y a pas de lignes directrices consensuelles ou de critères diagnostiques éprouvés pour les patients atteints de LoHF. De plus, les signes et symptômes cliniques ne sont pas spécifiques. En l’absence de lignes directrices normalisées, le diagnostic repose généralement sur une collection acceptée d’aberrations hémodynamiques et physiologiques utiles pour éveiller la suspicion clinique de LoHF. Le diagnostic de LoHF seul n’est souvent pas suffisant. La cause de l’état de faible sortie doit également être établie. Dans certaines causes d’état de faible rendement telles que PE ou MI, le traitement de la cause sous-jacente est la considération la plus importante et il est donc impératif de poser le diagnostic. Étant donné que les patients atteints de FSSL sont souvent instables, il est également courant que l’évaluation clinique, le diagnostic et le traitement se produisent simultanément davantage dans les milieux de soins actifs.
Signes et symptômes
Un débit cardiaque faible en tant que caractéristique de la FH décompensée aiguë est peu fréquent, affectant seulement 8,9 à 9,6% des patients hospitalisés à FH. La FLO peut partager de nombreuses caractéristiques cliniques avec l’ICC, mais il existe des différences notables qui peuvent soutenir ou guider les décisions diagnostiques ultérieures. Une fatigue excessive et une intolérance accrue à l’exercice sont des signes initiaux importants remarqués par les patients atteints de LoHF avant même le diagnostic. De plus, les patients atteints de LoHF présentent généralement une agitation, une confusion et / ou un niveau de conscience réduit; des périphéries froides / vasoconstrictées ou un temps de recharge capillaire retardé; hypotension; tachycardie ou bradycardie; pouls filant; pression veineuse jugulaire élevée; essoufflement et hypoxémie; et oligurie / anurie. Ces signes et symptômes peuvent différer entre une faible perfusion et une congestion chez les patients atteints d’HF (tableau 2).
Tableau 2. Symptômes et signes de faible perfusion vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Les lignes directrices ESC 2016 sur le diagnostic et la prise en charge de l’HF soulignent l’importance d’obtenir des antécédents médicaux détaillés et un examen physique de tous les patients soupçonnés d’être atteints d’HF. Les antécédents détaillés du patient, ou de ses proches et amis si le patient est trop malade, doivent se concentrer sur l’obtention d’informations sur les symptômes, les affections cardiaques et extra-cardiaques antérieures et actuelles susceptibles de précipiter ou d’aggraver l’HF, l’exposition à des facteurs de risque d’HF ou d’état de faible débit, et les antécédents de médicaments pour les affections médicales antérieures et actuelles. En plus des antécédents du patient, un examen physique est recommandé à tous les patients atteints de LoHF afin d’évaluer les indicateurs cliniques d’hémodynamique, de perfusion périphérique, de congestion, d’étiologie sous-jacente et de pathologie valvulaire. Les paramètres hémodynamiques d’intérêt comprennent la pression artérielle, le rythme cardiaque et cardiaque, le rythme de galop, la saturation en oxygène et la fréquence respiratoire. Les tests de perfusion périphérique doivent inclure les niveaux de conscience, la température périphérique de la peau / centrale, le temps de remplissage capillaire et le débit urinaire. Les tests de congestion comprennent une pression veineuse jugulaire élevée, un œdème périphérique / pulmonaire, une hépatomégalie, une ascite et des épanchements pleuraux. Les tests de l’étiologie sous-jacente doivent inclure un examen cardiovasculaire, ainsi que des bruits et des souffles cardiaques. Enfin, les preuves de dysfonctionnement valvulaire devraient inclure un frottement péricardique et des preuves d’épanchement péricardique avec ou sans tamponnade cardiaque.
La combinaison des antécédents du patient et de l’examen physique s’est avérée inestimable dans l’évaluation de l’état hémodynamique et la reconnaissance de la LoHF. En 1976, Forrester et al. examen physique des patients présentant un infarctus aigu du myocarde et identification de quatre profils hémodynamiques (A, B, L et C), comme illustré à la figure 2. Les profils hémodynamiques sont basés sur la présence ou l’absence de congestion pulmonaire (pression du coin capillaire pulmonaire > ou ≤18 mmHg) et l’adéquation de la perfusion (CI > 2,2 L/min/m2). Le profil A ne représente pas de congestion/hypoperfusion; Le profil B de congestion sans hypoperfusion; le profil C d’hypoperfusion sans congestion; et le profil L de congestion et d’hypoperfusion. Les patients atteints de LoHF relèvent des profils L et C (hypoperfusion ± congestion d’après Nohria et al. démonstration que les profils L et C présentent un CI moyen de 1,6 L/min/m2 et de 1,9 L/min/m2 respectivement.
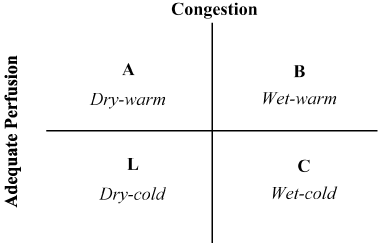
Figure 2. Présentation schématique du profil clinique de l’insuffisance cardiaque décompensée aiguë
La congestion est évaluée par la présence d’orthopnée, de distension veineuse jugulaire, de râles pulmonaires, de reflux hépatojugulaire, d’ascite, d’œdème périphérique, de reflux abdominal et d’onde carrée de Valsalva. Une faible perfusion a été évaluée par la présence d’une pression pulsée étroite, d’altérations du pulsus, d’extrémités froides, peut-être somnolentes, de taux sériques de sodium en baisse et d’une détérioration de la fonction rénale. Adapté de Nohria, et al.
Électrocardiogramme (ECG): Les directives AHA et ESC sur l’HF recommandent que l’électrocardiogramme (ECG) soit effectué le plus tôt possible chez tous les patients suspectés d’HF. L’ECG peut démontrer diverses anomalies et il est très peu probable qu’il soit normal chez les patients atteints d’HF. Il peut également fournir des preuves d’une étiologie sous-jacente d’un dysfonctionnement cardiaque, notamment une bradycardie, un bloc auriculo-ventriculaire, une tachycardie sinusale, une tachyarythmie auriculaire ou ventriculaire, une ischémie, une hypertrophie du VG et des complexes de basse tension.
Tests de laboratoire de base: Les directives AHA et ESC sur les HF recommandent également des tests de laboratoire de base dans l’évaluation clinique initiale pour appuyer le diagnostic de l’HF ou de la cause de l’état de faible rendement. Des tests sanguins doivent être effectués chez tous les patients suspectés d’HF. Le taux d’hémoglobine (Hb > 10 g/DL) indique un apport optimal d’oxygène aux tissus), l’anémie chronique est fréquente dans l’HF chronique et une augmentation marquée des globules blancs soulève la suspicion d’un autre diagnostic. Tests d’électrolyte sérique pour déterminer les niveaux de potassium, de magnésium et de calcium. Tests d’urée et de créatinine pour évaluer l’hypoperfusion rénale et le dysfonctionnement fréquents dans l’HF. Tests d’altération de la fonction hépatique, qui suggèrent une altération de la RV et / ou une congestion hépatique. Test de glucose pour évaluer l’hypoglycémie pouvant altérer la fonction cardiaque. Tests de la fonction thyroïdienne pour une hypo ou une hyper-thyroïdie pouvant provoquer un infarctus du myocarde intrinsèque. Enfin, des tests de peptides natriurétiques sériques dont les taux élevés indiquent une augmentation du stress de la paroi ventriculaire mais qui ne détectent pas de changements brusques des pressions de remplissage ventriculaire en raison de leur longue demi-vie.
Tests d’imagerie cardiaque: L’imagerie cardiaque joue un rôle central dans le diagnostic de l’HF ainsi que dans le suivi et l’orientation thérapeutique. L’échocardiographie est la modalité préférée pour des raisons de précision, de disponibilité, de sécurité et de rentabilité. Elle peut être complétée par d’autres modalités d’imagerie sélectionnées en fonction de la capacité à répondre à des questions cliniques spécifiques tout en tenant compte des contre-indications et des risques.
Échocardiographie: L’échocardiographie est fortement recommandée pour tous les patients suspectés en raison de sa capacité à confirmer ou à exclure le diagnostic clinique de LoHF, à évaluer le VSV et ses variations et à déterminer la cause de l’état de faible débit. L’échocardiographie transthoracique doit être réalisée dès que possible après le diagnostic clinique d’un débit cardiaque faible. Non seulement il mesure l’étendue du dysfonctionnement systolique et diastolique, mais il fournit également des informations précieuses sur la morphologie ventriculaire, le dysfonctionnement valvulaire, la maladie myocardique et péricardique et les anomalies régionales du mouvement de la paroi. L’échocardiographie évalue la fonction systolique en mesurant LEVF, où > 45-50% est considéré comme normal. D’autre part, la fonction diastolique est évaluée en utilisant les schémas d’écoulement mitral, le flux veineux pulmonaire et le Doppler tissulaire au niveau de l’anneau mitral, tandis que le CO et le SV sont évalués en utilisant le principe du Doppler. La pression artérielle pulmonaire (PAP) peut être estimée en mesurant la vitesse du jet de régurgitation. PAP élevé en présence de RV dilaté avec aplatissement septal ou repliement dans le VG indiquant une augmentation aiguë de la pression de RV augmentant la suspicion clinique de PE comme cause d’un état de faible débit.
Radiographie thoracique : Une radiographie thoracique pourrait être envisagée chez les patients suspectés d’être atteints de LoHF. Les indicateurs importants qui devraient être pris en compte pour l’évaluation comprennent une hypertrophie cardiaque indiquant une cardiomégalie ou une hypertrophie du VG; congestion veineuse pulmonaire indiquant une pression de remplissage élevée du VG; et épanchement pleural indiquant une pression VG élevée, une embolie pulmonaire ou une chirurgie post-cardiaque (.
Angiographie coronarienne: Les indications de l’angiographie coronarienne chez les patients atteints de FHLO doivent être conformes à la recommandation des directives consensuelles pertinentes pour l’HF. Chez les patients HF présentant des douleurs thoraciques et des signes d’infarctus du myocarde en élévation ST (STEMI) sur ECG, une revascularisation par intervention coronarienne percutanée primaire doit être effectuée dès que possible. L’angiographie coronaire doit également être envisagée chez les patients présentant un arrêt post-cardiaque d’étiologie ischémique, lorsqu’il existe des preuves d’HF et chez les patients qui se sont remis d’un état de faible débit lorsque la cause n’a pas été déterminée.
Prise en charge clinique
La présence de LoHF représente une affection à très haut risque nécessitant un traitement rapide, mais n’a pas de lignes directrices normalisées pour la prise en charge clinique. Par conséquent, les cliniciens considèrent normalement la physiopathologie individuelle pour choisir la stratégie de traitement la plus appropriée. Chez les patients atteints de FLO aigus, les lignes directrices ESC HF de 2016 recommandent l’utilisation de profils hémodynamiques (basés sur la présence ou l’absence de congestion et l’adéquation de la perfusion) pour guider la prise en charge clinique. Pour les patients LoHF de profil L (pas de congestion mais hypoperfusés) et de profil C (à la fois congestion et hypoperfusés) qui sont en état de décompensation aiguë, les objectifs du traitement d’urgence peuvent inclure la réanimation des patients, la restauration de l’oxygénation, l’amélioration de la perfusion des organes et l’optimisation hémodynamique (volume d’AVC et CO) et la résolution des symptômes. D’autres objectifs ultérieurs comprennent une surveillance optimale et l’établissement de la cause sous-jacente du faible débit cardiaque et le traitement de la cause s’il est réversible. À l’heure actuelle, les cibles thérapeutiques disponibles pour la LoHF sont l’optimisation de l’oxygénation des tissus, la stabilisation de la circulation et le traitement des causes réversibles de l’état de faible débit (figure 3).
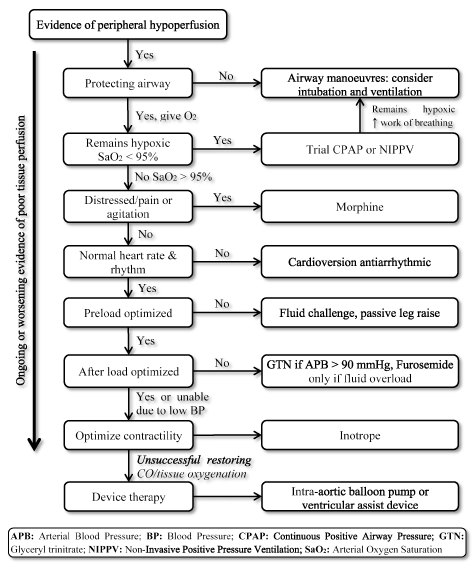
Figure 3. Algorithme de traitement pour l’insuffisance cardiaque à faible rendement
Le traitement des cibles LoHF améliore l’oxygénation des tissus et stabilise la circulation en fonction des symptômes en cours ou en aggravation de la perfusion tissulaire. Le traitement commence par l’amélioration de la ventilation en utilisant l’apport d’oxygène à haut débit, une pression positive continue des voies respiratoires (CPAP) ou une ventilation à pression positive non invasive (NIPPV). En cas d’échec, des médicaments cardioversion ou antiarythmiques sont administrés pour normaliser la fréquence cardiaque, un défi hydrique pour optimiser la précharge et / ou des vasodilatateurs et des inotropes pour manipuler et améliorer la contractilité respectivement. Si la ventilation et les médicaments antérieurs n’ont pas réussi à rétablir le débit cardiaque et / ou l’oxygénation tissulaire, une thérapie par appareil utilisant une pompe à ballonnet intra-aortique ou des dispositifs d’assistance ventriculaire peut être envisagée
Optimiser l’oxygénation tissulaire (stratégies ventilatoires)
La prise en charge clinique des patients atteints de FoHL commence souvent par l’évaluation des voies respiratoires, de la respiration et de la circulation pour détecter des signes d’hypoperfusion périphérique. Les stratégies de ventilation telles que les voies respiratoires oropharyngées ou nasopharyngées sont des adjuvants courants utilisés pour restaurer ou maintenir la perméabilité des voies respiratoires chez les patients atteints de FoHL dont le niveau de conscience est diminué en raison d’une diminution de la perfusion cérébrale. Une intubation endotrachéale supplémentaire doit être envisagée si les voies respiratoires du patient sont compromises. Si les patients continuent à rester hypoxiques (SaO2 < 95%), une maximisation de l’apport d’oxygène en utilisant de l’oxygène à haut débit, une pression positive continue des voies respiratoires (CPAP) ou une ventilation à pression positive non invasive (NIPPV) peut être envisagée. Chez les patients sans amélioration, une intubation ou une ventilation peuvent être envisagées.
Stabiliser la circulation
Le débit cardiaque (CO) est fonction de HR et de SV. À son tour, le SV dépend de quatre variables de circulation: la fréquence cardiaque, la précharge, la contractilité et la postcharge. L’optimisation de toutes ces variables améliorera le CO chez les patients atteints de LoHF. En milieu clinique, les stratégies d’augmentation du CO dépendent de la cause sous-jacente et de la variable circulatoire affectée. Les interventions cliniques comprennent l’ajustement du volume, le soutien pharmacologique et la thérapie par appareil.
Fréquence / Rythme cardiaque: Dans le cadre de la réponse physiologique du corps, l’augmentation de l’HR augmente le CO. Une HR trop rapide ou lente a un effet néfaste sur le CO. Chez les patients atteints de LoHF présentant une tachycardie (HR au repos trop rapide > 100 bpm) qui sont en détresse, agités et dyspnéiques, la morphine peut être administrée pour soulager la dyspnée, la douleur et l’agitation ainsi que c’est un venodilatateur doux pour réduire la postcharge, en particulier chez les patients CPAP ou NIPPV. Si HR < 40 bpm avec des signes de compromis hémodynamique et / ou de CO altéré, des médicaments qui augmentent HR (atropine et anticholinergiques) ou des interventions telles que la stimulation transcutanée / transveineuse doivent être effectuées. Une cardioversion électrique urgente doit être envisagée dans une LoHF sélectionnée avec une tachycardie ventriculaire / supraventriculaire ou une FA rapide avec des signes de compromission cardiovasculaire.
Optimiser la précharge (réglages de volume) : La mesure de la précharge est essentielle à son optimisation. Il est recommandé chez les patients présentant des signes cliniques d’altération de la perfusion périphérique. Un test de fluide doit être effectué pour évaluer la réactivité de la précharge. Infuser rapidement 250 ml de liquide (cristalloïde ou colloïde) pendant plus de cinq minutes et évaluer objectivement l’effet sur le SV. Si l’effet est une augmentation ou une diminution > de 10%, le patient doit continuer à recevoir des bolus liquides pour optimiser la précharge jusqu’à ce qu’ils ne répondent plus aux liquides. Pour les patients présentant des signes de congestion et d’œdème pulmonaire qui ne nécessitent pas de bolus liquide, une élévation passive de la jambe peut être effectuée – en soulevant la jambe du patient à 45 degrés pour exclure la nécessité d’un défi hydrique. Si la réponse est favorable, un véritable défi fluide peut être donné.
Manipuler la postcharge (support pharmacologique): La postcharge est la résistance contre laquelle le ventricule éjecte le sang, parfois estimée en SVR. La postcharge doit être réduite chez les patients présentant une postcharge élevée, une faible teneur en CO, des signes de mauvaise perfusion périphérique et un œdème pulmonaire. Un soutien pharmacologique utilisant des vasodilatateurs doit être administré aux patients atteints de LoHF dont la pression artérielle systolique est ≥110 mmHg. Chez les patients présentant une pression artérielle systolique < 90 mmHg et une pression artérielle moyenne < 65 mmHg, les vasodilatateurs ne sont pas recommandés en raison du risque d’hypotension, qui peut compliquer la perfusion d’organes. Chez ces patients, inotropes est recommandé en première ligne de traitement.
Améliorer la contractilité (support pharmacologique): Si le patient persiste avec des signes d’hypoperfusion tissulaire ou de réduction de l’apport d’oxygène malgré des interventions sur la fréquence cardiaque, la précharge et la postcharge, un traitement visant à améliorer la contractilité doit être envisagé. Pendant ce temps, l’optimisation de l’apport en oxygène doit être poursuivie pour viser un taux d’hémoglobine ≥10 g / dl et assurer des saturations optimales en oxygène (SaO2). Les facteurs affectant négativement la contractilité myocardique sont l’hyperkaliémie, l’hypomagnésémie, l’hypocalcémie, l’acidose sévère, l’hypoxie et l’hypoglycémie, qui doivent être corrigés. Les inotropes sont recommandés pour améliorer la contractilité et par la suite le CO chez les patients atteints de LoHF présentant une BP faible et / ou une IC faible en présence de signes de mauvaise perfusion périphérique ou de congestion. Cependant, un support pharmacologique utilisant de la Dobutamine (un inotrope) doit être utilisé avec prudence chez les patients présentant une tachycardie ou une FA car il augmente la conduction des nœuds AV et peut précipiter des rythmes ventriculaires rapides. D’un autre côté, le lévosimendan est recommandé chez les patients atteints de LoHF présentant une ischémie myocardique aiguë ou une chirurgie post-cardiaque car il n’augmente pas la demande en oxygène myocardique. L’effet à long terme des inotropes pourrait être préjudiciable et leur utilisation devrait donc être arrêtée une fois la stabilité atteinte. Les vasopresseurs ne devraient pas être le médicament de première intention dans les états à faible rendement car ils augmentent la RVS et altèrent par la suite le CO. Cependant, une bithérapie des vasopresseurs et de l’inotrope est recommandée chez les patients présentant une septicémie comme cause sous-jacente de l’état de faible débit.
Thérapie par le dispositif: Un traitement par le dispositif doit être envisagé chez les patients atteints de L’ HLO lorsque les traitements médicaux optimaux n’ont pas réussi à rétablir le CO et l’oxygénation des tissus. Les thérapies par appareil courantes comprennent la pompe à ballonnet intra-aortique (IABP) et le dispositif d’assistance ventriculaire (VAD). L’utilisation de l’IABP est fréquente chez les patients atteints d’une cardiopathie ischémique, d’une intervention pré ou post-percutanée ou d’une chirurgie post-cardiaque. L’IABP consiste en un ballonnet inséré dans l’aorte à travers l’artère fémorale. Le ballon se gonfle pendant la diastole et se dégonfle pendant la systole pour augmenter la pression artérielle diastolique et par conséquent la perfusion coronaire, et réduit la postcharge augmentant ainsi le CO. D’autre part, l’utilisation de VAD est rare. Il ne peut être utilisé que dans des centres spécialisés. Il est couramment utilisé comme pont vers la transplantation cardiaque chez les patients ayant une qualité de vie favorable ou vers le rétablissement chez les patients atteints de myocardite aiguë.
Traitement des causes sous-jacentes
Certaines causes d’état de faible rendement chez les patients atteints de LoHF peuvent être inversées avec des traitements spécifiques. Les causes réversibles doivent être identifiées tôt au cours de l’évaluation clinique initiale. Ces causes comprennent l’infarctus aigu du myocarde, la tamponnade cardiaque, le pneumothorax de tension, l’embolie pulmonaire et l’insuffisance valvulaire aiguë. (Tableau 3).
Méta-analyse du diagnostic et de la prise en charge clinique
La base du diagnostic clinique de LoHF a été la preuve échocardiographique d’un dysfonctionnement systolique du VG / RV et / ou d’un dysfonctionnement diastolique du VG accompagné de preuves d’une réduction du CO et de la SvO2. Des profils hémodynamiques basés sur des mesures de congestion et de perfusion ont été utilisés pour classer les patients HF aigus en quatre profils: sec-chaud (A), humide-chaud (B), sec-froid (L) et humide-froid (C) et utiles pour identifier les patients LoHF. Les patients atteints de LoHF ont été classés en profils (L) et (C) en fonction de la présence / absence de congestion et / ou de l’insuffisance de la perfusion périphérique. Ces deux profils hémodynamiques ont constitué la base de la sélection des patients atteints de LoHF dans les essais cliniques et fournissent une évaluation simple au chevet du patient pour aider à classer les patients au moment de la présentation et guider la sélection des traitements initiaux. L’objectif de la présente méta-analyse est d’agréger des preuves publiées de caractéristiques diagnostiques et de résultats de traitement communs pour les patients atteints de LoHF.
Stratégie de recherche
Trois grandes bases de données en ligne (PubMed, EMBASE et Cochrane) ont été systématiquement recherchées depuis leur création jusqu’en décembre 2018 pour des études portant sur le diagnostic et la prise en charge clinique du LoHF. Pour éviter de négliger les études qui ne mentionnaient pas LoHF dans le titre ou le résumé, les 200 premiers articles classés par pertinence récupérés avec une recherche Google Scholar en texte intégral ont été inclus. Aucune restriction de temps de publication ou de langue n’a été appliquée. Des études supplémentaires ont été identifiées grâce à une recherche manuelle de la liste des références des études incluses ainsi que des articles de revue pertinents, qui ont ensuite été soumis aux critères d’inclusion. Les critères de recherche comprenaient la population d’intérêt (patients atteints de LoHF ou de LCOS), les tests diagnostiques d’intérêt (échocardiographie et profils hémodynamiques) et l’intervention d’intérêt (stratégies de ventilation, ajustement du volume, soutien pharmacologique et thérapie par appareil). Les études ont été incluses si elles répondaient aux critères suivants: (a) inclus les patients atteints de LoHF; (b) diagnostiqué à l’aide d’échocardiographie et de profils hémodynamiques; (c) patients traités pour une stabilisation hémodynamique; et (d) résultats du traitement rapportés. Dans les cas d’études rapportant des données en double, seule l’étude qui a fourni le plus grand nombre de patients a été incluse. Les résumés de conférences, les rapports de cas et les articles d’examen ont été exclus.
Sélection des études
La figure 4 illustre le processus de recherche et de sélection utilisé pour inclure les études admissibles. Deux examinateurs ont examiné de manière indépendante tous les titres et résumés extraits de la recherche systématique en ligne. Les résumés qui comprenaient la population, l’intervention et les résultats d’intérêt ont été inclus pour la recherche en texte intégral. Par la suite, les deux examinateurs ont également examiné de manière indépendante des articles en texte intégral en fonction des critères d’inclusion. En cas de divergence, elle a été résolue par la discussion et le consensus.

Figure 4. Organigramme du processus de recherche et d’inclusion de la littérature
Collecte de données
Deux examinateurs ont extrait indépendamment les données des études incluses et toute divergence a été résolue par consensus. Les principales données extraites étaient des données de profil échocardiographique et hémodynamique, et le traitement utilisé et les résultats du traitement sur l’hémodynamique (indice cardiaque, PCWP) et la mortalité. En plus de ces données principales, les deux examinateurs ont également extrait des données sur les caractéristiques de l’étude, les caractéristiques des patients et la durée du suivi (tableau 4).
Analyse statistique
Les résultats d’intérêt rapportés dans plus d’une étude sont l’indice cardiaque, la PCWP et la mortalité. Pour chaque résultat, des statistiques sommaires (moyenne ± écart type) avant et après l’intervention ont été extraites ou la différence entre la ligne de base et après le traitement. Ces statistiques sommaires ont été extraites séparément pour les groupes de traitement et de contrôle/placebo. Les résultats diagnostiques et les effets du traitement ont été mesurés par la différence des moyennes avant et après l’intervention et l’intervalle de confiance associé à 95 %. Des parcelles forestières ont été utilisées pour examiner visuellement l’hétérogénéité (I2) d’une étude à l’autre. L’effet de diagnostic et de traitement groupé et l’intervalle de confiance associé à 95% ont été estimés à l’aide d’un effet fixe (I2 < 49%) ou d’un modèle à effet aléatoire (I2 > 50%). La valeur P > 0,05 a été considérée comme statistiquement significative.
Résultats
Caractéristiques de l’étude
Douze (12) essais contrôlés randomisés (ECR) satisfaisaient aux critères d’inclusion. Sept (7) études ont inclus des patients atteints de FhLO et les cinq (5) autres ont inclus des patients atteints de FH qui ont subi une chirurgie cardiaque avec un débit cardiaque faible. La majorité des essais cliniques publiés (10) ont examiné des médicaments comparant l’effet de différents types d’inotropes sur l’hémodynamique et la prévention de la mort: dobutamine uniquement, dobutamine et dopamine; lévosimendan et dobutamine, et lévosimendan et placebo. Parmi les deux autres essais cliniques, chacun a étudié le vasodilatateur (nitroprussiate) et le placebo, ainsi que la thérapie par un dispositif (IABP) et l’inotrope (levosimendan) seul ou en association avec l’IAPB. Au total, les 12 essais cliniques ont inclus 3 738 patients âgés en moyenne de 64 ans (intervalle = 55-74 ans), la majorité étant des hommes (78 %).
Synthèse des résultats
Les données de diagnostic sur le LoHF étaient incohérentes. Au cours des douze essais cliniques, aucune définition commune de LoHF n’a émergé qui aurait été utile pour guider le diagnostic. Les critères hémodynamiques utilisés pour l’inclusion des patients dans les essais comprenaient CI < 2,0 L/min/m2, CI < 2,2 L/min/m2 ou CI < 2,5 L/min/m2 et PCWP > 15 mm HG ou ≥18 mm HG. La définition variait également selon les études – état postopératoire avec hypotension (TA systolique < 90 mmHg pour > 30 minutes) ou besoin d’un soutien inotrope pour maintenir TA systolique > 90 mmHg et hypoperfusion des organes terminaux (périphéries froides, sortie d’urine < 30 ml/heure). Le choc cardiogénique a été décrit comme un syndrome complexe impliquant une cascade de dysfonctionnement du VG aigu, une diminution du CO, une hypotension et une hypoperfusion tissulaire.
Les figures 5 et 6 montrent les parcelles forestières pour la moyenne normalisée de l’indice cardiaque au début et après le traitement par inotrope ou vasodilatateur respectivement. L’indice cardiaque initial est passé d’une moyenne de 1,93 (IC à 95 % : 1,91-1,95) à une moyenne post-traitement de 2,82 (IC à 95 % : 2,80-2,84). La figure 7 montre une parcelle forestière pour la différence moyenne standard (SMD) de l’indice cardiaque après traitement par le lévosimendan et la dobutamine. Le lévosimendan atteint un indice cardiaque plus élevé que la dobutamine (SMD: 2,82; IC à 95%: 2,54-3,10). En tant que prophylactique contre la LoHF chez les patients postopératoires, la perfusion de levosimendan après anesthésie a atteint un indice cardiaque plus élevé (2,57) par rapport à l’IABP préopératoire (2,3) ou avec une association de levosimendan (2,4). La figure 8 montre une parcelle forestière du taux de mortalité entre le lévosimendan et le placebo. Le taux de mortalité du Lévosimendan était inférieur à celui du placebo (Rapport de cotes: 0,83; IC à 95% : 0,59-1,18), mais la différence n’était pas statistiquement significative (p = 0,30). Enfin, la figure 9 montre en outre que le Lévosimendan a un taux de mortalité inférieur à celui de la dobutamine (OR: 0,65; IC à 95%: 0,39-1.08) but the difference was not statistically significant (p=0.10).
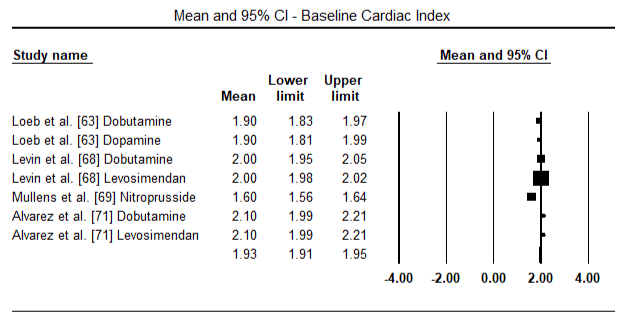
Figure 5. Mean baseline cardiac index
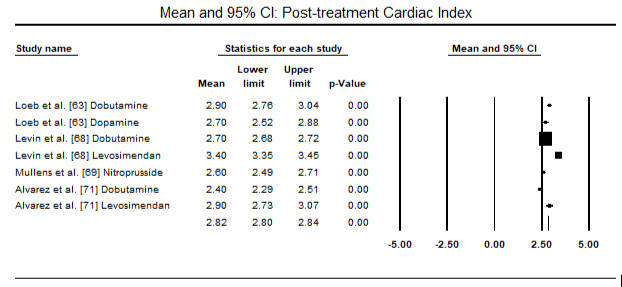
Figure 6. Mean post-treatment cardiac index
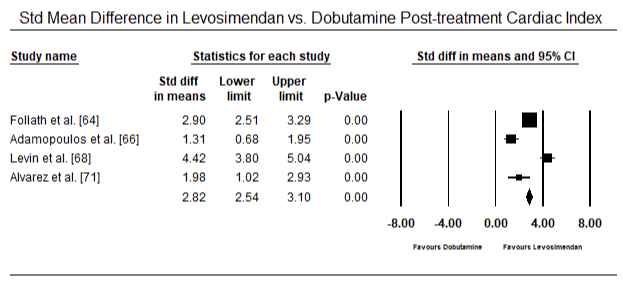
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
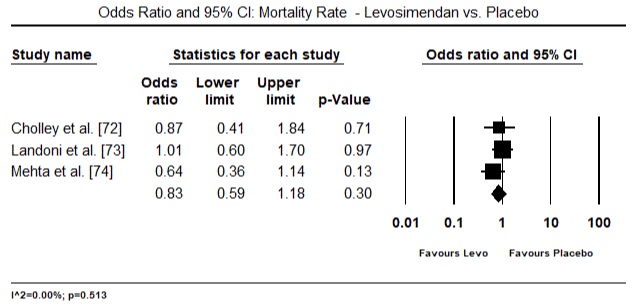
Figure 8. Mortality rate between levosimendan and placebo
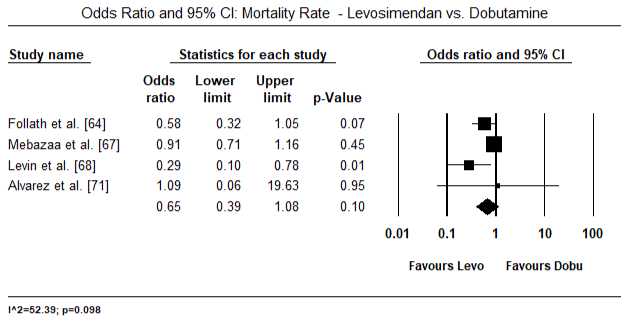
Figure 9. Taux de mortalité entre le lévosimendan et la dobutamine
Discussion des résultats
Cette revue systématique et cette méta-analyse ont évalué les caractéristiques diagnostiques communes et les résultats du traitement de la thérapie médicale et de l’appareil (IABP) chez les patients atteints de LoHF. Les résultats indiquent que les patients atteints de LoHF n’ont pas de caractéristiques diagnostiques largement acceptées ou normalisées. Bien que les patients atteints de LoHF puissent présenter plusieurs caractéristiques, notamment l’index cardiaque, la PCWP, la BP systolique et la SvO2, pour suggérer ou soutenir le diagnostic clinique, toutes ces caractéristiques ont des valeurs limites différentes selon les études. L’indice cardiaque, qui est la caractéristique clinique la plus courante démontrant un état de faible débit dans la LoHF, a trois valeurs de coupure: < 2,0 L / min /m2, < 2,2 L/min/m2 ou < 2,5 L/min/m2. Le soutien inotrope est apparu comme une intervention très courante pour améliorer la perfusion et normaliser le débit cardiaque chez les patients atteints de LoHF.
Les médicaments inotropes tels que le lévosimendan, la dobutamine, la dopamine, le vasodilatateur (nitroprussiate) et l’IABP ont considérablement amélioré l’IC entre le début et la fin du traitement. En termes d’inotropes, le lévosimendan est plus efficace pour améliorer la stabilité hémodynamique et une meilleure prophylaxie contre la mort à court terme (mortalité à 30 jours) que la dobutamine. De plus, les inotropes peuvent agir comme prophylactiques contre le développement de LoHF postopératoire. D’autre part, si les inotropes améliorent l’hémodynamique et normalisent le débit cardiaque, ils n’offrent pas une protection significativement meilleure contre la mortalité quel que soit le type d’inotrope utilisé.
Le rôle des inotropes dans le traitement de la LoHF a été soutenu par un examen antérieur des agents inotropes et des stratégies vasodilatatrices pour le traitement du choc cardiogénique et des LCOS. L’examen des inotropes rapportés améliore les effets indésirables hémodynamiques dans les LCOS postopératoires et réduit la mortalité. Des inotropes plus récents tels que le lévosimendan (un sensibilisant au calcium et un inodilatateur) est un inotrope positif qui possède certaines propriétés vasodilatatrices. Il peut également être considéré comme un vasodilatateur hépatique sélectif, qui peut améliorer le flux veineux portail via l’artère hépatique et le flux veineux portail par rapport à la dobutamine qui ne peut améliorer que le flux veineux portail sans vasodilatation de l’artère hépatique. Le Levosimendan n’augmente pas non plus la demande en oxygène du myocarde et est recommandé par rapport à la dobutamine chez les patients atteints d’ischémie myocardique aiguë ou de chirurgie post-cardiaque. Pour la LoHF postopératoire, l’effet protecteur des inotropes contre le taux de mortalité à court terme (mortalité à 30 jours) reste insignifiant par rapport au placebo.
La présente revue systématique et la méta-analyse présentent d’importantes limites. LoHF peut survenir dans une maladie cardiaque secondaire à sous-jacente telle qu’un infarctus aigu du myocarde ou postopératoire. La plupart des études incluaient une LoHF postopératoire avec moins de présentation de LoHF provenant d’autres causes. La plupart des études se sont concentrées sur deux inotropes (Lévosimendan et dobutamine), limitant la compréhension d’autres inotropes ainsi que d’autres thérapies telles que les thérapies par appareils. Dans certains essais, l’analyse présentait un risque de biais de classification erroné en raison d’un nombre important de patients perdus de vue pour le suivi. Étant donné que la plupart des essais ne rapportent pas la différence pré et post-intervention par paire avec l’écart-type associé, la différence pré et post-intervention avec l’écart-type, les mesures des résultats pré et post-intervention comme indépendantes, cela permet d’obtenir des intervalles de confiance sider pour l’effet du traitement avec un écart-type associé.
Conclusion
L’insuffisance cardiaque à faible débit (LoHF) est un syndrome clinique caractérisé par une diminution du débit cardiaque accompagnée d’une hypoperfusion de l’organe terminal. C’est une forme rare d’insuffisance cardiaque dans la population générale, mais répandue chez les patients HF postopératoires. Son étiologie est hétérogène, composée de diverses conditions provoquant un état de faible débit et une chirurgie cardiaque. Les principaux mécanismes physiopathologiques sont la dysfonction systolique et / ou diastolique du VG et la dysfonction du VG causée par des modifications de la fréquence cardiaque, de la précharge, de la postcharge et / ou de la contractilité. Les facteurs de risque généraux de LoHF comprennent la maladie de Chagas, la fraction d’éjection déprimée et la dysfonction rénale, tandis que chez les patients postopératoires, la fonction VG altérée, la revascularisation incomplète, l’âge avancé et la présence de diabète et de dysfonction rénale. Le diagnostic manque de directives standardisées et dépend de la collecte acceptée d’aberrations hémodynamiques et physiologiques, y compris des conditions provoquant un état de faible rendement. Les antécédents du patient et l’examen physique aident à évaluer l’état hémodynamique et à reconnaître l’état de faible débit, tandis que l’échocardiographie confirme un dysfonctionnement ventriculaire (HF) et un faible débit cardiaque. D’autres tests pour appuyer le diagnostic ou établir la cause de l’état de faible débit comprennent l’électrocardiogramme et les tests de laboratoire de base (sang, électrolyte sérique, urée et créatinine, test hépatique, fonction thyroïdienne et peptides natriurétiques sériques) et l’imagerie cardiaque (radiographie pulmonaire ou angiographie coronarienne). Le traitement n’a pas de lignes directrices établies, mais dépend de l’évaluation de la physiopathologie individuelle pour sélectionner la stratégie de traitement la plus appropriée. Le traitement comprend des stratégies de ventilation pour améliorer la fréquence cardiaque et le rythme; un ajustement du volume pour optimiser la précharge; un soutien pharmacologique (inotropes et vasodilatateurs) pour manipuler la postcharge et améliorer la contractilité; et une thérapie par appareil (pompe à ballonnet intra-aortique ou dispositif d’assistance ventriculaire) lorsque ces stratégies ne rétablissent pas le débit cardiaque. Chez certains patients, des thérapies pour inverser la maladie sous-jacente peuvent restaurer le débit cardiaque.
- Inamdar A, Inamdar A (2016) Diagnostic, gestion et utilisation de l’insuffisance cardiaque. J Clin Med 5:62.
- Dassanayaka S, Jones SP (2015) Développements récents dans l’insuffisance cardiaque. Circ Res 117:e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Lignes directrices pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique 2012: Le Groupe de travail pour le Diagnostic et le Traitement de l’Insuffisance Cardiaque Aiguë et Chronique 2012 de la Société Européenne de Cardiologie. Développé en collaboration avec l’Association de l’Insuffisance cardiaque (HFA) du CES. Eur J Défaillance cardiaque 14:803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, et al. (2013) Ligne directrice 2013 de l’ACCF / AHA pour la prise en charge de l’insuffisance cardiaque: rapport du groupe de travail de l’American College of Cardiology Foundation / American Heart Association sur les directives de pratique. Je suis Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) Lignes directrices ESC 2016 pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique: Le Groupe de travail pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique de la Société européenne de Cardiologie (ESC) S’est développé avec la contribution spéciale de l’Association de l’insuffisance cardiaque (HFA) de l’ESC. Cœur Eur J 37:2129-2200.
- Masse L, Antonacci M (2005) Syndrome de bas débit cardiaque: identification et prise en charge. Crit Care Nurs Clin 17:375-383.
- Poppas A, Rounds S (2002) Insuffisance cardiaque congestive. Am J Respir Crit Soins Med 165:4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Résumé des lignes directrices sur le diagnostic et le traitement de l’insuffisance cardiaque aiguë: Le Groupe de travail sur l’Insuffisance Cardiaque aiguë de la Société européenne de Cardiologie. Cœur Eur J 26:384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) Cardiac performance and mortality early after intracardiac surgery in infants and young children. Tirage 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) Évolution postopératoire et profil hémodynamique après l’opération de commutation artérielle chez les nouveau-nés et les nourrissons: une comparaison du pontage cardiopulmonaire à faible débit et de l’arrêt circulatoire. Circulation 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) Les complications cardiaques et neurologiques identifient les risques de mortalité chez les hommes et les femmes subissant un pontage coronarien. Anesthésiologie 95:1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) Prédicteurs du syndrome de faible débit cardiaque après pontage aorto-coronarien. J Thorac Cardiovasc Surg 112:38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) Épidémiologie et nouveaux prédicteurs du syndrome de faible débit cardiaque après pontage coronarien isolé. Cœur Eur J 31:68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, et al. (2012) Facteurs de risque du syndrome de faible débit cardiaque après un pontage coronarien. Braz J Cardiovasc Surg 27:217-223.
- Algarni KD, Maganti M, Yau TM (2011) Prédicteurs du syndrome de faible débit cardiaque après pontage coronarien isolé: tendances sur 20 ans. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Gestion du syndrome de faible débit cardiaque à la suite d’une chirurgie pour une cardiopathie congénitale. Curr Cardiol Rév 12:107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) Syndrome de faible débit cardiaque après une chirurgie cardiaque. J Cardiothorac Vasc Anesth31:291-308.
- Tibby SM., Murdoch IA (2003) Surveillance de la fonction cardiaque en soins intensifs. Arch Dis Enfant 88:46-52.
- Carcillo JA, Field AI (2002) Clinical practice parameters for hemodynamic support of paediatric and neonatal patients in septic shock. Crit Care Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) Mort cardiomyocytaire: mécanismes et implications translationnelles. Mort cellulaire &maladie 2: e244.
- Tavernarakis N (2007) Nécrose cardiomyocytaire: mécanismes alternatifs, interventions efficaces. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research 1773: 480-482.
- Dorn GW (2008) Mort cardiomyocytaire programmée apoptotique et non apoptotique dans le remodelage ventriculaire. Cardiovasc Res 81:465-473.
- Richard Conti C (1991) Le myocarde étourdi et hibernant: une brève revue. Clin Cardiol 14:708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) Insuffisance cardiaque diastolique après chirurgie cardiaque. Dans La Maladie coronarienne – Concepts actuels en Épidémiologie, Physiopathologie, Diagnostic et Traitement 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) Quels mécanismes sous-tendent la dysfonction diastolique dans l’insuffisance cardiaque? Circ Res 94:1533-1542.
- Borlaug BA, Paulus WJ (2010) Insuffisance cardiaque avec fraction d’éjection préservée: physiopathologie, diagnostic et traitement. Cœur Eur J 32:670-679.
- Ramirez-Correa GA, Murphy AM (2007) La Phospholambane ou la troponine I est-elle la « prima Donna” de la Lusitropie induite par les β-adrénergiques? Circ Res 101:326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) Effets aigus de l’oxyde nitrique sur la relaxation ventriculaire gauche et la distensibilité diastolique chez l’homme. Évaluation par perfusion de nitroprussiate de sodium bicoronaire. Circ 89:2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prévalence des Abnorrnalités de Remplissage Diastolique Ventriculaire Gauche chez les Patients Chirurgicaux Cardiaques Adultes: Une Étude cardiographique par Écho Peropératoire. Semin Thorac Cardiovasc Surg 11:125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) Modèles de remplissage diastolique biventriculaire après un pontage coronarien. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Hypertension artérielle pulmonaire: le rôle clé de l’échocardiographie. Poitrine 127: 1836-1843.
- Zochios V, Jones N (2014) Syndrome du cœur droit aigu chez le patient gravement malade. Vaisseau pulmonaire cardiaque 6:157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Première expérience clinique avec une sonde d’échocardiographie transoesophagienne miniaturisée dans une unité de soins intensifs cardiaques. J Cardiothorac Vasc Anesthe 29:582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Performance du ventricule droit sous stress: Relation avec le flux coronaire droit. J Clin Invest 50: 2176-2183.
- Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Dysfonction vasculaire pulmonaire et ventriculaire droite en soins intensifs chez l’adulte: Options actuelles et émergentes pour la prise en charge: Une revue systématique de la littérature. Soins critiques 14: R169.
- Pfisterer M (2003) Atteinte ventriculaire droite dans l’infarctus du myocarde et le choc cardiogénique. Lancette 362:392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Prédicteurs d’un débit cardiaque faible dans une insuffisance cardiaque grave décompensée. Cliniques 66:239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Résultat clinique d’un pontage coronarien urgent. J Med coréen Sci 22:270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Prédicteurs du syndrome de faible débit cardiaque après une chirurgie valvulaire aortique isolée. Tirage 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) Évaluation des outils de dépistage nutritionnel pour les patients devant subir une chirurgie cardiaque. Nutrition 29:436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) Les valeurs préopératoires de l’hémoglobine et du peptide natriurétique de type B, mais pas les marqueurs inflammatoires, sont associées à la morbidité postopératoire en chirurgie cardiaque: Une étude analytique de cohorte prospective. J Cardiothorac Surg 8:170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) Nombre total de lymphocytes préopératoires dans le sang périphérique comme prédicteur de mauvais résultats en chirurgie cardiaque chez l’adulte. J Cardiothorac Vasc Anesthe 25:975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) Niveaux de peptides natriurétiques de type pro-B N-terminal et résultats précoces après une chirurgie cardiaque: Une étude de cohorte prospective. Br J Anaesth 103:647-653.
- Sans hutte R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Utilité du peptide natriurétique de type B dans la prédiction des complications et des résultats postopératoires chez les patients subissant une chirurgie cardiaque. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) Relation entre la concentration sérique de sodium d’admission et les résultats cliniques chez les patients hospitalisés pour insuffisance cardiaque: une analyse du registre OPTIMIZE-HF. Cœur Eur J 28:980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) Mortalité hospitalière chez les patients atteints d’insuffisance cardiaque décompensée aiguë nécessitant des médicaments vasoactifs intraveineux: une analyse du Registre national de l’insuffisance cardiaque décompensée aiguë (ADHERE). J Am Coll Cardiol 46:57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Gestion d’équipe des patients atteints d’insuffisance cardiaque: une déclaration pour les professionnels de la santé du Conseil des soins infirmiers cardiovasculaires de l’American Heart Association. Circulation 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) La fiabilité limitée des signes physiques pour estimer l’hémodynamique dans l’insuffisance cardiaque chronique. Jama 261:884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) L’évaluation clinique identifie les profils hémodynamiques qui prédisent les résultats chez les patients admis avec une insuffisance cardiaque. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Thérapie médicale de l’infarctus aigu du myocarde par application de sous-ensembles hémodynamiques. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) Gestion médicale de l’insuffisance cardiaque avancée. Jama 287:628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) L’échocardiographie dans l’insuffisance cardiaque: applications, utilité et nouveaux horizons. Je suis Coll Cardiol 50:381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) Évaluation échocardiographique de l’hémodynamique chez les patients atteints d’insuffisance cardiaque systolique décompensée. Circ Cardiovasc Imaging 4:220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) Recommandations pour la quantification de la chambre cardiaque par échocardiographie chez l’adulte: une mise à jour de l’American Society of Echocardiography et de l’Association Européenne d’imagerie cardiovasculaire. Eur Heart J Cardiovasc Imaging 16:233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) Critères de pertinence pour l’utilisation de l’imagerie cardiovasculaire dans l’insuffisance cardiaque: rapport d’examen de la littérature. Eur Heart J Cardiovasc Imaging 16:147-153.
- Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) Évaluation de l’imagerie cardiaque non invasive des patients atteints d’insuffisance cardiaque systolique chronique: rapport de l’Association Européenne d’imagerie cardiovasculaire (EACVI). Cœur Eur J 35:3417-3425.
- Vazir A, Cowie MR (2012) Évaluation de l’insuffisance cardiaque aiguë décompensée: Stratégies et outils. Eur Cardiol 8:128-133.
- Gray A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) Ventilation non invasive dans l’œdème pulmonaire cardiogénique aigu. N Angl J Med 359:142-151.
- Cotter G, Cotter OM, Kaluski E (2008) Surveillance hémodynamique dans l’insuffisance cardiaque aiguë. Soins critiques Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) La pompe à ballonnet intra-aortique dans la gestion de l’insuffisance cardiaque: implications pour la pratique infirmière. Aust Crit Care 22:125-131.
- Slaughter MS, Singh R (2012) Le rôle des dispositifs d’assistance ventriculaire dans l’insuffisance cardiaque avancée. Revue de Cardiologie Espagnole 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) Profils hémodynamiques de l’insuffisance cardiaque avancée: association avec les caractéristiques cliniques et les résultats à long terme. Échec de la carte J 7:105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) Supériorité de la dobutamine sur la dopamine pour l’augmentation du débit cardiaque chez les patients atteints d’insuffisance cardiaque chronique à faible débit. Tirage 55:375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, et al. (2002) Efficacité et innocuité du lévosimendan intraveineux par rapport à la dobutamine dans l’insuffisance cardiaque grave à faible débit (étude LIDO): un essai randomisé en double aveugle. La Lancette 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) Sténose aortique à faible débit et à faible gradient chez les patients présentant une fonction systolique ventriculaire gauche déprimée: l’utilité clinique du défi dobutamine en laboratoire de cathétérisme. Circulation 106:809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Effets du lévosimendan par rapport à la dobutamine sur les voies inflammatoires et apoptotiques dans l’insuffisance cardiaque chronique intensément décompensée. Am J Cardiol 98:102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007) Survivent aux enquêteurs. Levosimendan vs dobutamine pour les patients atteints d’insuffisance cardiaque aiguë décompensée: l’essai randomisé SURVIVE. Jama 297:1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) Le sensibilisateur calcique levosimendan donne des résultats supérieurs à la dobutamine dans le syndrome de bas débit cardiaque postopératoire. Revista Española de Cardiología (édition anglaise) 61:471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) nitroprussiate de sodium pour l’insuffisance cardiaque avancée à faible rendement. J Am Coll Cardiol 52:200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan contre une pompe à ballonnet intra-aortique chez des patients cardiaques à haut risque. J Cardiothorac Vasc Anthe 26:596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) Une comparaison du débit sanguin hépatique de la doubutamine et du lévosimendan n chez des patients présentant un faible débit cardiaque après une chirurgie cardiaque: une étude contrôlée randomisée. Soins intensifs anesthésiques 41:719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Effet du lévosimendan sur le syndrome de faible débit cardiaque chez les patients présentant une faible fraction d’éjection subissant un pontage aorto-coronarien avec pontage cardiopulmonaire: l’essai clinique randomisé LICORN. Jama 318:548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan pour le soutien hémodynamique après une chirurgie cardiaque. En anglais J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendan chez des patients présentant un dysfonctionnement ventriculaire gauche subissant une chirurgie cardiaque. N Engl J Med 376:2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) Agents inotropes et stratégies vasodilatatrices pour le traitement du choc cardiogénique ou du syndrome de faible débit cardiaque. La bibliothèque Cochrane. 2 : 1-10.