Mupirocin Cream
Nom générique: mupirocin calcium
Forme posologique: crème
Revue médicale par Drugs.com . Dernière mise à jour le 1er janvier 2021.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Grossesse
- Plus
Indications et utilisation de la Crème de Mupirocine
La crème de Mupirocine USP, 2% est indiquée pour le traitement des lésions cutanées traumatiques secondairement infectées (jusqu’à 10 cm de longueur ou 100 cm2 de surface) en raison de lésions cutanées sensibles isolats de Staphylococcus aureus (S. aureus) et de Streptococcus pyogenes (S. pyogenes).
Posologie et administration de la Crème de Mupirocine
- À Usage topique Uniquement.
- Appliquez une petite quantité de crème de Mupirocine, avec un coton-tige ou un tampon de gaze, sur la zone touchée 3 fois par jour pendant 10 jours.
- Couvrir la zone traitée avec un pansement de gaze si désiré.
- Réévaluer les patients ne présentant pas de réponse clinique dans les 3 à 5 jours.
- La crème de Mupirocine n’est pas destinée à un usage intranasal, ophtalmique ou autre.
- N’appliquez pas la crème de Mupirocine en même temps que d’autres lotions, crèmes ou onguents.
Formes posologiques et concentrations
La crème de mupirocine USP, 2% est une crème blanche qui contient 20 mg (2% p / p) de mupirocine par gramme dans une émulsion à base d’huile et d’eau, fournie dans des tubes de 15 et 30 grammes.
Contre-indications
La Crème de Mupirocine est contre-indiquée chez les patients présentant une hypersensibilité connue à la mupirocine ou à l’un des excipients de la Crème de Mupirocine.
Mises en garde et précautions
Réactions allergiques sévères
Des réactions allergiques systémiques, y compris l’anaphylaxie, l’urticaire, l’œdème de quincke et l’éruption cutanée généralisée, ont été rapportées chez des patients traités par des formulations de mupirocine, y compris la Crème de mupirocine.
Irritation des yeux
Éviter tout contact avec les yeux. En cas de contact accidentel, bien rincer à l’eau.
Irritation locale
En cas de sensibilisation ou d’irritation locale sévère due à la crème de Mupirocine, l’utilisation doit être interrompue et un traitement alternatif approprié pour l’infection doit être instauré.
Diarrhée associée à Clostridium difficile
Une diarrhée associée à Clostridium difficile (DCD) a été rapportée avec l’utilisation de presque tous les agents antibactériens et sa gravité peut aller d’une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens modifie la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit des toxines A et B qui contribuent au développement du CDAD. Souches de C produisant des hypertoxines. difficile cause une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et peuvent nécessiter une colectomie. Le DCD doit être envisagé chez tous les patients présentant une diarrhée suite à l’utilisation d’un médicament antibactérien. Des antécédents médicaux prudents sont nécessaires car il a été rapporté que le DSCD survenait plus de 2 mois après l’administration d’agents antibactériens.
En cas de suspicion ou de confirmation d’une ADC, il peut être nécessaire d’arrêter l’utilisation continue d’un médicament antibactérien non dirigé contre C. difficile. Une gestion appropriée des fluides et des électrolytes, une supplémentation en protéines, un traitement antibactérien de C. difficile et une évaluation chirurgicale doivent être mis en place selon les indications cliniques.
Potentiel de prolifération microbienne
Comme avec d’autres produits antibactériens, l’utilisation prolongée de la crème de Mupirocine peut entraîner une prolifération de microorganismes non sensibles, y compris les champignons.
Risque associé à l’utilisation dans les muqueuses
La crème de Mupirocine n’est pas formulée pour une utilisation sur les surfaces muqueuses. Une formulation distincte, la pommade nasale au calcium mupirocine, est disponible pour un usage intranasal.
Effets indésirables
Les effets indésirables suivants sont discutés plus en détail dans d’autres sections de l’étiquetage :
- Réactions allergiques graves
- Irritation oculaire
- Irritation locale
- Diarrhée associée à Clostridium difficile
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d’effets indésirables observés dans les essais cliniques d’un médicament ne peuvent pas être directement comparé aux taux des essais cliniques d’un autre médicament et peut ne pas refléter les taux observés dans la pratique.
Dans 2 essais randomisés, en double aveugle et à double mannequin, 339 sujets ont été traités avec de la crème de Mupirocine topique plus un placebo par voie orale. Des effets indésirables sont survenus chez 28 sujets (8,3 %). Les effets indésirables suivants ont été rapportés par au moins 1% des sujets en relation avec l’utilisation de la crème de Mupirocine dans les essais cliniques: maux de tête (1,7%), éruptions cutanées (1,1%) et nausées (1,1 %).
Les autres effets indésirables survenus chez moins de 1% des sujets étaient : douleurs abdominales, brûlures au site d’application, cellulite, dermatite, vertiges, prurit, infection secondaire de la plaie et stomatite ulcéreuse.
Dans un essai de soutien dans le traitement de l’eczéma secondairement infecté, 82 sujets ont été traités avec de la crème de Mupirocine. L’incidence des effets indésirables était la suivante: nausées (4,9%), maux de tête et brûlures au site d’application (3,6% chacun), prurit (2,4%) et 1 rapport de douleur abdominale, saignement secondaire à l’eczéma, douleur secondaire à l’eczéma, urticaire, peau sèche et éruption cutanée.
Expérience après la mise sur le marché
Outre les effets indésirables rapportés lors des essais cliniques, les réactions suivantes ont été identifiées lors de l’utilisation de la crème Mupirocine après la mise sur le marché. Étant donné qu’ils sont déclarés volontairement à partir d’une population de taille inconnue, il n’est pas possible d’estimer leur fréquence. Ces réactions ont été choisies pour être incluses en raison de leur gravité, de leur fréquence de déclaration ou de leur relation de cause à effet potentielle avec la crème de Mupirocine.
Troubles du système immunitaire
Réactions allergiques systémiques, y compris anaphylaxie, urticaire, œdème de quincke et éruption cutanée généralisée.
UTILISATION DANS DES POPULATIONS SPÉCIFIQUES
Grossesse
Résumé du risque
Les données humaines sont insuffisantes pour établir s’il existe un risque associé au médicament avec la crème de Mupirocine chez la femme enceinte. L’absorption systémique de la mupirocine par la peau humaine intacte est minime après l’administration topique de la crème de Mupirocine. Aucune toxicité pour le développement n’a été observée chez les rats ou les lapins traités par la mupirocine par voie sous-cutanée au cours de l’organogenèse à des doses de 160 ou 40 mg par kg par jour, respectivement (22 et 11 fois la dose topique humaine sur la base des calculs de la dose divisée par la surface corporelle entière).
Le risque de fond estimé de malformations congénitales majeures et de fausses couches pour la population indiquée est inconnu. Le risque de fond estimé dans la population générale des États-Unis d’anomalies congénitales majeures est de 2% à 4% et de fausse couche est de 15% à 20% des grossesses cliniquement reconnues.
Données
Données animales: Des études de toxicité pour le développement ont été réalisées avec de la mupirocine administrée par voie sous-cutanée à des rats et des lapins à des doses allant jusqu’à 160 mg par kg par jour pendant l’organogenèse. Cette dose est respectivement de 22 et 43 fois la dose topique humaine (environ 60 mg de mupirocine par jour) sur la base des calculs de dose divisés par la surface corporelle entière. Une toxicité maternelle a été observée (perte de poids corporel / diminution du gain de poids corporel et diminution de l’alimentation) chez les deux espèces, sans aucune preuve de toxicité pour le développement chez le rat. Chez le lapin, une toxicité maternelle excessive à la dose élevée a empêché l’évaluation des résultats fœtaux. Il n’y a pas eu de toxicité pour le développement chez le lapin à raison de 40 mg par kg par jour, soit 11 fois la dose topique humaine, selon les calculs de la dose divisée par la surface corporelle entière.
La mupirocine administrée par voie sous-cutanée à des rats dans une étude de développement pré- et postnatal (dosée pendant la fin de la gestation jusqu’à la lactation) a été associée à une diminution de la viabilité de la progéniture au début de la période postnatale à la dose de 106.7 mg par kg, en présence d’irritation au site d’injection et / ou d’hémorragie sous-cutanée. Cette dose est 14 fois la dose topique humaine basée sur des calculs de dose divisée par la surface corporelle entière. Le taux d’effet indésirable sans effet observé dans cette étude était de 44,2 mg par kg par jour, soit 6 fois la dose topique humaine.
Lactation
Résumé du risque
On ne sait pas si la mupirocine est présente dans le lait maternel, si elle a des effets sur l’enfant allaité ou si elle a des effets sur la production de lait. Cependant, l’allaitement ne devrait pas entraîner une exposition de l’enfant au médicament en raison de l’absorption systémique minimale de la mupirocine chez l’homme après l’administration topique de la crème de mupirocine. Les avantages pour le développement et la santé de l’allaitement doivent être pris en compte, de même que les besoins cliniques de la mère en crème de Mupirocine et tout effet indésirable potentiel de la Crème de Mupirocine ou de la condition maternelle sous-jacente sur l’enfant allaité.
Considérations cliniques
Pour minimiser l’exposition orale du médicament aux enfants, un sein et / ou un mamelon traité avec de la crème de Mupirocine doit être soigneusement lavé avant l’allaitement.
Utilisation pédiatrique
L’innocuité et l’efficacité de la crème de Mupirocine ont été établies dans les groupes d’âge de 3 mois à 16 ans. L’utilisation de la Crème de Mupirocine dans ces groupes d’âge est étayée par des preuves d’essais adéquats et bien contrôlés de la Crème de Mupirocine chez l’adulte avec des données supplémentaires de 93 sujets pédiatriques étudiés dans le cadre des essais pivots chez l’adulte.
Utilisation gériatrique
Dans 2 essais adéquats et bien contrôlés, 30 sujets âgés de plus de 65 ans ont été traités avec de la crème de Mupirocine. Aucune différence globale dans l’efficacité ou l’innocuité de la crème de Mupirocine n’a été observée dans cette population de patients par rapport à celle observée chez les patients plus jeunes.
Crème de Mupirocine Description
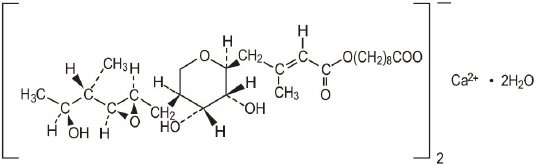
La crème de Mupirocine USP, 2% contient l’hémi-sel de calcium cristallin dihydraté de l’inhibiteur antibactérien de l’ARN synthétase, la mupirocine. Chimiquement, il s’agit de l’acide (aE, 2S, 3R, 4R, 5S) -5-tétrahydro-3,4-dihydroxy-ß-méthyl-2H-pyran-2-crotonique, ester avec l’acide 9-hydroxynonanoïque, sel de calcium (2: 1), dihydrate.
La formule moléculaire de la mupirocine calcique est (C26H43O9) 2Ca∙2H2O et son poids moléculaire est de 1075,3. Le poids moléculaire de l’acide libre de mupirocine est de 500,6. La formule structurelle du calcium de mupirocine est la suivante:
Chaque gramme de crème de mupirocine contient 20 mg (2% p / p) de mupirocine équivalent à 21,5 mg (2,15% p / p) de calcium de mupirocine. The inactive ingredients are benzyl alcohol, cetomacrogol 1000, cetyl alcohol, mineral oil, phenoxyethanol, purified water, stearyl alcohol, and xanthan gum.
Mupirocin Cream – Clinical Pharmacology
Mechanism of Action
Mupirocin is an RNA synthetase inhibitor antibacterial .
Pharmacokinetics
Absorption
Systemic absorption of mupirocin through intact human skin is minimal. L’absorption systémique de la mupirocine a été étudiée après application de la Crème de Mupirocine 3 fois par jour pendant 5 jours sur diverses lésions cutanées de plus de 10 cm de longueur ou 100 cm2 de surface chez 16 adultes (âgés de 29 à 60 ans) et 10 enfants (âgés de 3 à 12 ans). Une certaine absorption systémique a été observée, comme en témoigne la détection du métabolite, l’acide monique, dans l’urine. Les données de cet essai ont indiqué une occurrence plus fréquente d’absorption percutanée chez les enfants (90% des sujets) par rapport aux adultes (44% des sujets); cependant, les concentrations urinaires observées chez les enfants (0,07 à 1.3 mcg par mL) sont dans la plage observée (0,08 à 10,03 mcg par mL) dans la population adulte. En général, le degré d’absorption percutanée après administration multiple semble être minime chez l’adulte et l’enfant.
L’effet de l’application simultanée de la crème de Mupirocine avec d’autres produits topiques n’a pas été étudié.
Élimination
Dans un essai mené chez 7 sujets mâles adultes en bonne santé, la demi-vie d’élimination après administration intraveineuse de mupirocine était de 20 à 40 minutes pour la mupirocine et de 30 à 80 minutes pour l’acide monique.
Métabolisme: Après administration intraveineuse ou orale, la mupirocine est rapidement métabolisée. Le principal métabolite, l’acide monique, ne présente aucune activité antibactérienne.
Excrétion: L’acide monique est principalement éliminé par excrétion rénale.
Microbiologie
La mupirocine est un inhibiteur de l’ARN synthétase antibactérien produit par fermentation à l’aide de l’organisme Pseudomonas fluorescens.
Mécanisme d’action
La mupirocine inhibe la synthèse des protéines bactériennes en se liant de manière réversible et spécifique à l’ARN de transfert d’isoleucyle (ARNt) synthétase bactérienne.
La mupirocine est bactéricide aux concentrations obtenues par administration topique. La mupirocine est fortement liée aux protéines (supérieure à 97%) et l’effet des sécrétions de la plaie sur les concentrations minimales inhibitrices (CMI) de la mupirocine n’a pas été déterminé.
Résistance
Lorsque la résistance à la mupirocine se produit, elle résulte de la production d’une isoleucyl-ARNt synthétase modifiée, ou de l’acquisition, par transfert génétique, d’un plasmide médiant une nouvelle isoleucyl-ARNt synthétase. Une résistance élevée médiée par les plasmides (CMI ≥512 mcg/mL) a été rapportée dans un nombre croissant d’isolats de S. aureus et avec une fréquence plus élevée dans les staphylocoques à coagulase négative. La résistance à la mupirocine se produit avec une plus grande fréquence chez les staphylocoques résistants à la méthicilline que chez les staphylocoques sensibles à la méthicilline.
Résistance croisée
En raison de son mode d’action, la mupirocine ne présente pas de résistance croisée avec d’autres classes d’agents antimicrobiens.
Activité antimicrobienne
Il a été démontré que la mupirocine est active contre les isolats sensibles de S. aureus et S. pyogènes, à la fois in vitro et dans les essais cliniques. Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. La mupirocine est active contre la plupart des isolats de Staphylococcus epidermidis.
Méthodes d’essai de susceptibilité
Une résistance élevée à la mupirocine (≥512 mcg/mL) peut être déterminée à l’aide d’essais standard de diffusion sur disque ou de microdilution en bouillon.1,2 En raison de l’apparition d’une résistance à la mupirocine chez les S résistants à la méthicilline. aureus (SARM), il convient de tester la sensibilité des populations de SARM à la mupirocine avant l’utilisation de la mupirocine à l’aide d’une méthode normalisée.3,4,5
Toxicologie non clinique
Carcinogenèse, Mutagénèse, Altération de la fertilité
Aucune étude à long terme chez l’animal pour évaluer le potentiel cancérogène de la mupirocine calcique n’a été menée.
Les résultats des études suivantes réalisées avec de la mupirocine calcique ou de la mupirocine sodique in vitro et in vivo n’ont pas indiqué de potentiel de génotoxicité: synthèse d’ADN non programmée des hépatocytes primaires de rat, analyse des sédiments pour les ruptures de brins d’ADN, test de réversion de Salmonella (Ames), test de mutation d’Escherichia coli, analyse de métaphase de lymphocytes humains, test de lymphome de souris et test de micronoyaux de moelle osseuse chez la souris.
Dans une étude sur la fertilité et la performance reproductive (avec dosage pendant la lactation), la mupirocine administrée par voie sous-cutanée à des rats mâles et femelles à des doses allant jusqu’à 100 mg par kg par jour, soit 14 fois la dose topique humaine (environ 60 mg de mupirocine par jour) sur la base de calculs de dose divisés par la surface corporelle entière, n’a pas entraîné d’altération de la fertilité ou de la performance reproductive imputable à la mupirocine.
Études cliniques
L’efficacité de la crème de Mupirocine topique pour le traitement des lésions cutanées traumatiques secondairement infectées (p. ex., des lacérations, des plaies suturées et des abrasions d’une longueur maximale de 10 cm ou d’une surface totale de 100 cm2) ont été comparées à celles de la céphalexine orale dans 2 essais cliniques randomisés, en double aveugle et à double mannequin. Les taux d’efficacité clinique au suivi dans les populations par protocole (adultes et sujets pédiatriques inclus) étaient de 96,1 % pour la crème de Mupirocine (n = 231) et de 93,1 % pour la céphalexine orale (n = 219). Les taux d’éradication des agents pathogènes au suivi dans les populations par protocole étaient de 100% pour la crème de Mupirocine et la céphalexine orale.
Pédiatrie
Il y avait 93 sujets pédiatriques âgés de 2 semaines à 16 ans inscrits par protocole dans les essais sur les lésions cutanées secondairement infectées, bien que seulement 3 étaient âgés de moins de 2 ans dans la population traitée avec de la crème de Mupirocine. Les sujets ont été randomisés pour 10 jours de crème de Mupirocine topique 3 fois par jour ou 10 jours de céphalexine orale (250 mg 4 fois par jour pour les sujets supérieurs à 40 kg ou 25 mg par kg par jour de suspension orale en 4 doses fractionnées pour les sujets inférieurs ou égaux à 40 kg). L’efficacité clinique au suivi (7 à 12 jours après le traitement) dans les populations par protocole était de 97,7% (43 sur 44) pour la crème de Mupirocine et de 93,9 % (46 sur 49) pour la céphalexine.
- Institut des normes cliniques et de laboratoire (CLSI). Normes de rendement pour les tests de sensibilité aux antimicrobiens; Vingt-sixième Supplément d’information. Document CLSI M100-S26. Institut des normes cliniques et de laboratoire, 950 West Valley Rd., Suite 2500, Wayne, PA 19087, États-Unis, 2016.
- Patel J, Gorwitz RJ, et al. Résistance à la Mupirocine. Maladies infectieuses cliniques. 2009; 49(6):935-41.
- Institut des normes Cliniques et de laboratoire (CLSI). Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; Approved Standard – Dixième Édition. Document CLSI M07-A10. Institut des normes cliniques et de laboratoire, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis, 2015.
- Institut des normes Cliniques et de laboratoire (CLSI). Normes de Performance pour les Tests de Sensibilité à la Diffusion de Disques Antimicrobiens; Norme Approuvée – Douzième Édition. Document CLSI M02-A12. Institut des normes cliniques et de laboratoire, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis, 2015.
- Finlay JE, Miller LA, Poupard JA. Critères d’interprétation pour tester la sensibilité des staphylocoques à la mupirocine. Antimicrob Agents Chemother 1997; 41 (5): 1137-1139.
Comment Fournir / Stockage et manipulation
La crème de mupirocine est une crème blanche qui contient 20 mg (2% p / p) de mupirocine par gramme dans une émulsion à base d’huile et d’eau.
La crème de mupirocine USP, 2% est fournie en tubes de 15 grammes (NDC 16714-055-01) et de 30 grammes (NDC 16714-055-02).
Conserver entre 20 et 25 °C (68 et 77 °F). Ne pas congeler.
Informations sur le conseil du patient
Conseillez au patient de lire l’étiquetage du patient approuvé par la FDA (Informations sur le patient).
Conseillez au patient d’administrer la crème de Mupirocine comme suit:
- Utilisez la crème de Mupirocine uniquement selon les directives du fournisseur de soins de santé. Il est destiné à un usage externe uniquement. Eviter le contact de la crème de Mupirocine avec les yeux. Si la crème de Mupirocine pénètre dans les yeux, rincez abondamment à l’eau.
- N’utilisez pas de crème de Mupirocine dans le nez.
- Lavez-vous les mains avant et après l’application de la crème Mupirocine.
- Utilisez un tampon de gaze ou un coton-tige pour appliquer une petite quantité de crème Mupirocine sur la zone touchée. La zone traitée peut être recouverte d’un pansement de gaze si désiré.
- Signalez au fournisseur de soins de santé tout signe d’effets indésirables locaux. La crème de Mupirocine doit être arrêtée et le fournisseur de soins de santé doit être contacté en cas d’irritation, de démangeaisons sévères ou d’éruption cutanée.
- Signalez-vous au fournisseur de soins de santé ou rendez-vous aux urgences les plus proches en cas de réactions allergiques graves, telles qu’un gonflement des lèvres, du visage ou de la langue, ou une respiration sifflante.
- Si aucune amélioration n’est constatée en 3 à 5 jours, contactez le fournisseur de soins de santé.
Fabriqué pour: Northstar RxLLC
Memphis, TN 38141.
Fabriqué par: Taro Pharmaceuticals Inc.
Brampton, Ontario, Canada L6T 1C1.
Publié: Novembre 2020
5214500
54
| Cette information sur le patient a été approuvée par la Food and Drug Administration des États-Unis. Émis: Novembre 2020 5214500 54 |
||
| INFORMATIONS SUR LE PATIENT CRÈME MUPIROCINE (mue pir’oh sin), à usage topique |
||
| Qu’est-ce que la crème Mupirocine ? La crème Mupirocine est un médicament sur ordonnance utilisé sur la peau (usage topique) pour traiter certaines infections cutanées causées par des bactéries appelées Staphylococcus aureus et Streptococcus pyogenes. On ne sait pas si la crème de Mupirocine est sûre et efficace chez les enfants de moins de 3 mois. |
||
| Qui ne devrait pas utiliser de crème Mupirocine? N’utilisez pas de Crème à la Mupirocine si :
|
||
| Que dois-je dire à mon professionnel de la santé avant d’utiliser la Crème Mupirocine? Avant d’utiliser la crème de Mupirocine, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous:
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Ne mélangez pas la crème de Mupirocine avec d’autres lotions, crèmes ou onguents. |
||
Comment utiliser la Crème Mupirocine?
|
||
| Quels sont les effets secondaires possibles de la crème Mupirocine? La crème de Mupirocine peut provoquer des effets secondaires graves, notamment:
|
||
|
|
|
Les effets secondaires les plus courants de la crème Mupirocine comprennent:
Ce ne sont pas tous les effets secondaires possibles de la crème Mupirocine. Appelez votre médecin pour obtenir un avis médical sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088. |
||
Comment conserver la Crème Mupirocine?
|
||
| Informations générales sur l’utilisation sûre et efficace de la crème Mupirocine. Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d’information pour le patient. N’utilisez pas de crème de Mupirocine pour une affection pour laquelle elle n’a pas été prescrite. Ne donnez pas de crème de Mupirocine à d’autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre pharmacien ou à votre fournisseur de soins de santé des informations sur la crème Mupirocine écrite pour les professionnels de la santé. |
||
| Quels sont les ingrédients de la crème Mupirocine? Ingrédient actif: mupirocine calcium Ingrédients inactifs: alcool benzylique, cétomacrogol 1000, alcool cétylique, huile minérale, phénoxyéthanol, eau purifiée, alcool stéarylique et gomme xanthane Fabriqué pour: Northstar RxLLC, Memphis, TN 38141. Manufactured by: Taro Pharmaceuticals Inc., Brampton, Ontario, Canada L6T 1C1. For more information, call 1-800-206-7821. |
||
PRINCIPAL DISPLAY PANEL – 30 g Tube Carton
NDC 16714-055-02
Rx only
Mupirocin Cream USP
2%
FOR DERMATOLOGIC USE ONLY.
NORTHSTARx®
30 g

| MUPIROCIN mupirocin calcium cream |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Étiqueteuse -NORTHSTAR RX LLC (830546433)
Foire aux questions
- Puis-je utiliser une pommade à la mupirocine pour l’érythème fessier?
- La mupirocine peut-elle guérir ou aider à l’eczéma?
- La mupirocine peut-elle être utilisée pour le pied des athlètes?
- La crème de mupirocine peut-elle être utilisée pour les plaies de lit?
En savoir plus sur la mupirocine topique
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Comparez les alternatives
- Groupe de soutien
- Prix & Coupons
- Espagnol
- 38 Avis
- Classe de médicaments: antibiotiques topiques
Ressources pour les consommateurs
- Informations sur les patients
- Mupirocine Nasale (Lecture Avancée)
- Mupirocine Topique (Lecture Avancée)
Ressources professionnelles
- Informations sur la prescription
- Mupirocine (Conseils Professionnels aux Patients)
- Mupirocine (FDA)
>
Autres marques Bactroban, Bactroban Nasal, Centany, Centany AT, Pirnuo
Guides de traitement connexes
- Portage Nasal de Staphylococcus aureus
- Infection cutanée et structurale
- Infections Bactériennes Cutanées Secondaires
- Impétigo
- Paronychie
Avertissement médical