Qu’est–ce que la Radiobiologie – Biologie des rayonnements – Définition
La radiobiologie (également connue sous le nom de radiobiologie) est une science médicale qui implique l’étude des effets biologiques des rayonnements ionisants sur les tissus vivants. Le rayonnement est tout autour de nous. Dans, autour et au-dessus du monde dans lequel nous vivons. C’est une force énergétique naturelle qui nous entoure. C’est une partie de notre monde naturel qui est ici depuis la naissance de notre planète. Que la source de rayonnement soit naturelle ou d’origine humaine, qu’il s’agisse d’une forte dose de rayonnement ou d’une petite dose, il y aura des effets biologiques. En général, les rayonnements ionisants sont nocifs et potentiellement mortels pour les êtres vivants, mais peuvent avoir des avantages pour la santé en médecine, par exemple en radiothérapie pour le traitement du cancer et de la thyréotoxicose. Ce chapitre résume brièvement les conséquences à court et à long terme qui peuvent résulter d’une exposition aux rayonnements.
Dommages cellulaires – Radiobiologie
Tous les effets de dommages biologiques commencent par la conséquence des interactions de rayonnement avec les atomes formant les cellules. Tous les êtres vivants sont composés d’une ou plusieurs cellules. Chaque partie de votre corps est constituée de cellules ou a été construite par elles. Bien que nous ayons tendance à penser aux effets biologiques en termes d’effet des rayonnements sur les cellules vivantes, en réalité, les rayonnements ionisants, par définition, n’interagissent qu’avec les atomes par un processus appelé ionisation. Pour les rayonnements ionisants, l’énergie cinétique des particules (photons, électrons, etc.) de rayonnement ionisant est suffisant et la particule peut ioniser (pour former des ions en perdant des électrons) des atomes cibles pour former des ions. Le simple rayonnement ionisant peut frapper les électrons d’un atome.
Il existe deux mécanismes par lesquels le rayonnement affecte finalement les cellules. Ces deux mécanismes sont communément appelés :
- Effets directs. Les effets directs sont causés par le rayonnement, lorsque le rayonnement interagit directement avec les atomes de la molécule d’ADN, ou d’un autre composant cellulaire essentiel à la survie de la cellule. La probabilité que le rayonnement interagisse avec la molécule d’ADN est très faible car ces composants critiques constituent une si petite partie de la cellule.
- Effets indirects. Les effets indirects sont causés par l’interaction du rayonnement généralement avec des molécules d’eau. Chaque cellule, tout comme c’est le cas pour le corps humain, est principalement composée d’eau. Les rayonnements ionisants peuvent briser les liaisons qui maintiennent la molécule d’eau ensemble, produisant des radicaux tels que l’hydroxyle OH, l’anion superoxyde O2 – et d’autres. Ces radicaux peuvent contribuer à la destruction de la cellule.
Un grand nombre de cellules de tout type particulier est appelé un tissu. Si ce tissu forme une unité fonctionnelle spécialisée, on parle d’organe. Le type et le nombre de cellules touchées sont également un facteur important. Certaines cellules et organes du corps sont plus sensibles aux rayonnements ionisants que d’autres.
La sensibilité de divers types de cellules aux rayonnements ionisants est très élevée pour les tissus constitués de cellules qui se divisent rapidement comme celles que l’on trouve dans la moelle osseuse, l’estomac, les intestins, les organes reproducteurs mâles et femelles et les fœtus en développement. En effet, la division des cellules nécessite des informations ADN correctes pour que la progéniture de la cellule survive. Une interaction directe du rayonnement avec une cellule active pourrait entraîner la mort ou la mutation de la cellule, alors qu’une interaction directe avec l’ADN d’une cellule dormante aurait moins d’effet.
En conséquence, les cellules vivantes peuvent être classées en fonction de leur taux de reproduction, ce qui indique également leur sensibilité relative au rayonnement. En conséquence, les cellules qui se reproduisent activement sont plus sensibles aux rayonnements ionisants que les cellules qui composent les tissus cutanés, rénaux ou hépatiques. Les cellules nerveuses et musculaires sont les plus lentes à se régénérer et sont les cellules les moins sensibles.
 La sensibilité des différents organes du corps humain est en corrélation avec la sensibilité relative des cellules à partir desquelles ils sont composés. En pratique, cette sensibilité est représentée par le facteur de pondération tissulaire, wT, qui est le facteur par lequel la dose équivalente dans un tissu ou un organe T est pondérée pour représenter la contribution relative de ce tissu ou de cet organe au préjudice total pour la santé résultant d’une irradiation uniforme du corps (CIPR, 1991b).
La sensibilité des différents organes du corps humain est en corrélation avec la sensibilité relative des cellules à partir desquelles ils sont composés. En pratique, cette sensibilité est représentée par le facteur de pondération tissulaire, wT, qui est le facteur par lequel la dose équivalente dans un tissu ou un organe T est pondérée pour représenter la contribution relative de ce tissu ou de cet organe au préjudice total pour la santé résultant d’une irradiation uniforme du corps (CIPR, 1991b).
Si une personne n’est irradiée que partiellement, la dose dépendra fortement du tissu qui a été irradié. Par exemple, une dose gamma de 10 mSv pour l’ensemble du corps et une dose de 50 mSv pour la thyroïde sont les mêmes, en termes de risque, qu’une dose pour l’ensemble du corps de 10 + 0,04 x 50 = 12 mSv.
Rayonnement élevé et faible
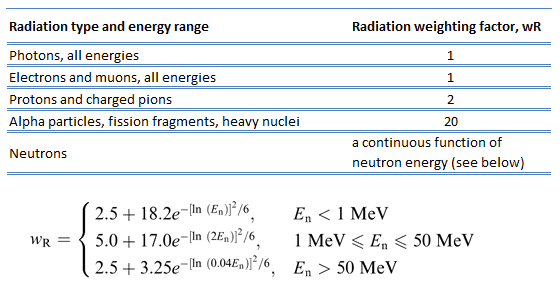
Comme cela a été écrit, chaque type de rayonnement interagit avec la matière d’une manière différente. Par exemple, les particules chargées à hautes énergies peuvent ioniser directement les atomes. Les particules alpha sont assez massives et portent une double charge positive, elles ont donc tendance à ne parcourir qu’une courte distance et à ne pas pénétrer très loin dans les tissus, voire pas du tout. Cependant, les particules alpha déposeront leur énergie sur un volume plus petit (peut-être seulement quelques cellules si elles pénètrent dans un corps) et causeront plus de dommages à ces quelques cellules.
Les particules bêta (électrons) sont beaucoup plus petites que les particules alpha. Ils portent une seule charge négative. Ils sont plus pénétrants que les particules alpha. Elles peuvent parcourir plusieurs mètres mais déposer moins d’énergie en un point quelconque de leur trajet que les particules alpha. Cela signifie que les particules bêta ont tendance à endommager plus de cellules, mais avec moins de dommages pour chacune. D’autre part, les particules électriquement neutres n’interagissent qu’indirectement, mais peuvent également transférer une partie ou la totalité de leurs énergies à la matière.
Cela simplifierait certainement les choses si les effets biologiques des rayonnements étaient directement proportionnels à la dose absorbée. Malheureusement, les effets biologiques dépendent également de la manière dont la dose absorbée est répartie le long du trajet du rayonnement. Des études ont montré que les rayonnements alpha et neutronique causent des dommages biologiques plus importants pour un dépôt d’énergie donné par kg de tissu que les rayonnements gamma. Il a été découvert que les effets biologiques de tout rayonnement augmentent avec le transfert d’énergie linéaire (LET). En bref, les dommages biologiques causés par un rayonnement à forte intensité (particules alpha, protons ou neutrons) sont beaucoup plus importants que ceux causés par un rayonnement à faible intensité (rayons gamma). En effet, le tissu vivant peut plus facilement réparer les dommages causés par les rayonnements répartis sur une grande surface que ceux concentrés sur une petite surface. Bien sûr, à des niveaux d’exposition très élevés, les rayons gamma peuvent encore causer de nombreux dommages aux tissus.
Comme plus de dommages biologiques sont causés pour la même dose physique (c’est-à-dire la même énergie déposée par unité de masse de tissu), un gris de rayonnement alpha ou neutronique est plus nocif qu’un gris de rayonnement gamma. Ce fait que des rayonnements de différents types (et énergies) donnent des effets biologiques différents pour une même dose absorbée est décrit en termes de facteurs connus sous le nom d’efficacité biologique relative (RBE) et de facteur de pondération du rayonnement (wR).
Dose aiguë et Dose chronique
Les effets biologiques des rayonnements et leurs conséquences dépendent fortement du niveau de débit de dose obtenu. En radiobiologie, le débit de dose est une mesure de l’intensité (ou de la force) de la dose de rayonnement. Les doses faibles sont courantes dans la vie quotidienne. Dans les points suivants, il y a quelques exemples d’exposition au rayonnement, qui peuvent être obtenus à partir de diverses sources.
- 05 µSv – Dormir à côté de quelqu’un
- 09 µSv – Vivre à moins de 30 miles d’une centrale nucléaire pendant un an
- 1 µSv – Manger une banane
- 3 µSv – Vivre à moins de 50 miles d’une centrale à charbon pendant un an
- 10 µSv – Dose quotidienne moyenne reçue de fond naturel
- 20 µSv – Radiographie pulmonaire
>
Du point de vue des conséquences biologiques, il est très important de distinguer les doses reçues sur des périodes courtes et prolongées. Par conséquent, les effets biologiques des rayonnements sont généralement divisés en deux catégories.
- Doses aiguës. Une ”dose aiguë » (dose élevée à court terme) est une dose qui se produit sur une période de temps courte et finie, c’est-à-dire en une journée.
- Doses chroniques. Une « dose chronique » (dose de faible intensité à long terme) est une dose qui se poursuit pendant une période prolongée, c’est-à-dire des semaines et des mois, de sorte qu’elle est mieux décrite par un débit de dose.
Des doses élevées ont tendance à tuer les cellules, tandis que de faibles doses ont tendance à les endommager ou à les modifier. Des doses élevées peuvent provoquer des brûlures par rayonnement visuellement spectaculaires et / ou une mort rapide par syndrome de rayonnement aigu. Les doses aiguës inférieures à 250 mGy sont peu susceptibles d’avoir des effets observables. Les doses aiguës d’environ 3 à 5 Gy ont 50% de chances de tuer une personne quelques semaines après l’exposition, si une personne ne reçoit aucun traitement médical.
De faibles doses étalées sur de longues périodes ne causent pas de problème immédiat à aucun organe du corps. Les effets de faibles doses de rayonnement se produisent au niveau de la cellule et les résultats peuvent ne pas être observés avant de nombreuses années. De plus, certaines études démontrent que la plupart des tissus humains présentent une tolérance plus prononcée aux effets d’un rayonnement faible en cas d’exposition prolongée par rapport à une exposition ponctuelle à une dose similaire.
Effets déterministes et stochastiques
En radiobiologie, la plupart des effets nocifs de l’exposition aux rayonnements sur la santé sont généralement divisés en deux grandes classes :
- Les effets déterministes sont des effets seuils sur la santé, qui sont directement liés à la dose de rayonnement absorbée et la gravité de l’effet augmente à mesure que la dose augmente.
- Les effets stochastiques surviennent par hasard, généralement sans seuil de dose. La probabilité d’apparition d’effets stochastiques est proportionnelle à la dose, mais la gravité de l’effet est indépendante de la dose reçue.
Effets déterministes
En radiobiologie, les effets déterministes (ou effets non stochastiques sur la santé) sont des effets sur la santé, qui sont directement liés à la dose de rayonnement absorbée et dont la gravité augmente à mesure que la dose augmente. Les effets déterministes ont un seuil en dessous duquel aucun effet clinique détectable ne se produit. Le seuil peut être très bas (de l’ordre de grandeur de 0,1 Gy ou plus) et peut varier d’une personne à l’autre. Pour des doses comprises entre 0,25 Gy et 0,5 Gy, de légers changements sanguins peuvent être détectés par des évaluations médicales et pour des doses comprises entre 0,5 Gy et 1,5 Gy, des changements sanguins seront notés et des symptômes de nausée, de fatigue, de vomissements se produiront.
Une fois le seuil dépassé, la sévérité d’un effet augmente avec la dose. La raison de la présence de cette dose seuil est que les dommages causés par les rayonnements (dysfonctionnement grave ou décès) d’une population critique de cellules (des doses élevées ont tendance à tuer les cellules) dans un tissu donné doivent être soutenus avant que les lésions ne soient exprimées sous une forme cliniquement pertinente. Par conséquent, les effets déterministes sont également appelés réaction tissulaire. Ils sont également appelés effets non stochastiques pour contraster avec des effets stochastiques aléatoires (par exemple, induction du cancer).
Les effets déterministes ne sont pas nécessairement plus ou moins graves que les effets stochastiques. Des doses élevées peuvent provoquer des brûlures par rayonnement visuellement spectaculaires et / ou une mort rapide par syndrome de rayonnement aigu. Les doses aiguës inférieures à 250 mGy sont peu susceptibles d’avoir des effets observables. Les doses aiguës d’environ 3 à 5 Gy ont 50% de chances de tuer une personne quelques semaines après l’exposition, si une personne ne reçoit aucun traitement médical. Les effets déterministes peuvent finalement conduire à une nuisance temporaire ou également à une fatalité. Exemples d’effets déterministes :
Des exemples d’effets déterministes sont:
- Syndrome de rayonnement aigu, par rayonnement aigu du corps entier
- Brûlures par rayonnement, du rayonnement à une surface corporelle particulière
- Thyroïdite induite par rayonnement, un effet secondaire potentiel du traitement par rayonnement contre l’hyperthyroïdie
- Syndrome de rayonnement chronique, du rayonnement à long terme.
- Lésion pulmonaire induite par les radiations, par exemple une radiothérapie aux poumons
Doses létales de rayonnement
La dose létale de rayonnement (LD) est une indication de la quantité létale de rayonnement. En radioprotection, la dose létale médiane, LDXY, est généralement utilisée. Par exemple, la dose de rayonnement qui devrait entraîner la mort de 50% des personnes irradiées dans les 30 jours est la DL50 / 30. La LD1 est la dose qui devrait entraîner la mort de 1% des personnes irradiées, par conséquent, la LD99 est mortelle pour toutes les personnes irradiées (99%). Il est également très important qu’une personne reçoive un traitement médical ou non. Plus une dose de rayonnement aigu est élevée, plus la possibilité qu’elle tue l’individu est grande. Pour un adulte en bonne santé, la DL50 est estimée entre 3 et 5 Gy.
- 2,5 Sv – Dose qui tue un humain avec un risque de 1% (DL1), si la dose est reçue sur une très courte durée.
- 5 Sv – Dose qui tue un humain avec un risque de 50% dans les 30 jours (DL50/ 30), si la dose est reçue sur une très courte durée. La cause du décès sera la perte de la fonction de la moelle osseuse.
- 8 Sv – Dose qui tue un humain avec un risque de 99% (DL99), si la dose est reçue sur une très courte durée. Vers 10 Gy, une inflammation aiguë des poumons peut survenir et entraîner la mort.
Les données de dose létale données ci-dessus s’appliquent aux doses gamma aiguës administrées en très peu de temps, par exemple quelques minutes. Une dose plus importante est nécessaire pour produire les effets énumérés ci-dessus, si la dose est reçue sur une période de plusieurs heures ou plus.
Effets stochastiques
En radiobiologie, les effets stochastiques des rayonnements ionisants se produisent par hasard, généralement sans seuil de dose. La probabilité d’apparition d’effets stochastiques est proportionnelle à la dose, mais la gravité de l’effet est indépendante de la dose reçue. Les effets biologiques des rayonnements sur les personnes peuvent être regroupés en effets somatiques et héréditaires. Les effets somatiques sont ceux subis par la personne exposée. Les effets héréditaires sont ceux subis par la progéniture de l’individu exposé. Le risque de cancer est généralement mentionné comme le principal effet stochastique des rayonnements ionisants, mais les troubles héréditaires sont également des effets stochastiques.
Selon la CIPR:
(83) Sur la base de ces calculs, la Commission propose des coefficients de probabilité nominaux pour le risque de cancer ajusté au détriment de 5,5 x 10-2 Sv-1 pour l’ensemble de la population et 4.1 x 10-2 Sv-1 pour les travailleurs adultes. Pour les effets héréditaires, le risque nominal corrigé du préjudice dans l’ensemble de la population est estimé à 0,2 x 10-2 Sv-1 et chez les travailleurs adultes à 0,1 x 10-2 Sv-1.
Référence spéciale: CIPR, 2007. Les Recommandations de 2007 de la Commission Internationale de radioprotection. Publication de la CIPR 103. Ann. CIPR 37 (2-4).
L’unité SI pour la dose efficace, le sievert, représente l’effet biologique équivalent du dépôt d’un joule d’énergie des rayons gamma dans un kilogramme de tissu humain. En conséquence, un sievert représente un 5.5% de chances de développer un cancer. Notez que la dose efficace n’est pas conçue comme une mesure des effets déterministes sur la santé, c’est-à-dire la gravité d’une lésion tissulaire aiguë qui est certaine de se produire, mesurée par la quantité de dose absorbée.
Il existe trois catégories générales d’effets stochastiques résultant d’une exposition à de faibles doses de rayonnement. Ce sont :
- Effets génétiques. L’effet génétique est subi par la progéniture de l’individu exposé. Elle implique la mutation de cellules très spécifiques, à savoir les spermatozoïdes ou les ovules. Le rayonnement est un exemple d’agent mutagène physique. Notez qu’il existe également de nombreux agents chimiques ainsi que des agents biologiques (tels que des virus) qui provoquent des mutations. Un fait très important à retenir est que le rayonnement augmente le taux de mutation spontanée, mais ne produit aucune nouvelle mutation.
- Effets somatiques. Les effets somatiques sont ceux subis par la personne exposée. L’impact le plus courant de l’irradiation est l’induction stochastique du cancer avec une période de latence de plusieurs années ou décennies après l’exposition. Puisque le cancer est le résultat principal, on l’appelle parfois l’effet cancérigène. Le rayonnement est un exemple de cancérogène physique, tandis que les cigarettes sont un exemple d’agent cancérigène chimique. Les virus sont des exemples d’agents cancérigènes biologiques.
- Les effets in utero impliquent la production de malformations chez les embryons en développement. Cependant, il s’agit en fait d’un cas particulier de l’effet somatique, puisque l’embryon / le fœtus est celui exposé au rayonnement.
La plupart pensent que les effets somatiques résultant de l’exposition aux rayonnements se produisent de manière stochastique. Le modèle le plus largement accepté postule que l’incidence des cancers dus aux rayonnements ionisants augmente linéairement avec la dose de rayonnement efficace à un taux de 5,5 % par sievert. Ce modèle est connu sous le nom de modèle linéaire sans seuil (LNT). Ce modèle suppose qu’il n’y a pas de point seuil et que le risque augmente linéairement avec une dose. Si ce modèle linéaire est correct, alors le rayonnement de fond naturel est la source de rayonnement la plus dangereuse pour la santé publique en général, suivi de l’imagerie médicale en deuxième position. Le LNT n’est pas universellement accepté, certains proposant une relation dose–réponse adaptative où les faibles doses sont protectrices et les fortes doses nuisibles. Il convient de souligner qu’un certain nombre d’organisations ne sont pas d’accord avec l’utilisation du modèle linéaire sans seuil pour estimer le risque lié à une exposition aux rayonnements de faible intensité dans l’environnement et au travail.
Radiobiologie et limites de dose
En radioprotection, les limites de dose sont fixées pour limiter les effets stochastiques à un niveau acceptable et pour prévenir complètement les effets déterministes. Notez que les effets stochastiques sont ceux résultant du hasard: plus la dose est élevée, plus l’effet est probable. Les effets déterministes sont ceux qui ont normalement un seuil: au-dessus de celui-ci, la sévérité de l’effet augmente avec la dose. Les limites de dose sont un élément fondamental de la radioprotection, et le non-respect de ces limites est contraire à la réglementation des rayonnements dans la plupart des pays. Notez que les limites de dose décrites dans cet article s’appliquent aux opérations de routine. Ils ne s’appliquent pas à une situation d’urgence lorsque la vie humaine est en danger. Ils ne s’appliquent pas dans les situations d’exposition d’urgence où une personne tente de prévenir une situation catastrophique.
Les limites sont divisées en deux groupes, le public et les travailleurs exposés au travail. Selon la CIPR, l’exposition professionnelle désigne l’ensemble des expositions subies par les travailleurs dans le cadre de leur travail, à l’exception des
- expositions exclues et des expositions résultant d’activités exemptées impliquant des rayonnements ou des sources exemptées
- toute exposition médicale
- le rayonnement de fond naturel local normal.
Le tableau suivant résume les limites de dose pour les travailleurs exposés au travail et pour le public:
Source des données : CIPR, 2007. Les Recommandations de 2007 de la Commission Internationale de radioprotection. Publication de la CIPR 103. Ann. CIPR 37 (2-4).
Selon la recommandation de la CIPR dans sa déclaration sur les réactions tissulaires de 21. En avril 2011, la limite de dose équivalente pour le cristallin pour l’exposition professionnelle dans des situations d’exposition planifiées a été réduite de 150 mSv/an à 20 mSv/an, en moyenne sur des périodes définies de 5 ans, aucune dose annuelle au cours d’une seule année ne dépassant 50 mSv.
Les limites de dose efficace correspondent à la somme des doses efficaces pertinentes résultant d’une exposition externe au cours de la période spécifiée et de la dose efficace engagée résultant des apports de radionucléides au cours de la même période. Pour les adultes, la dose efficace engagée est calculée pour une période de 50 ans après la prise, tandis que pour les enfants, elle est calculée pour la période allant jusqu’à l’âge de 70 ans. La limite de dose efficace pour l’ensemble du corps de 20 mSv est une valeur moyenne sur cinq ans. La limite réelle est de 100 mSv en 5 ans, avec pas plus de 50 mSv en une année.