Retards AV & VV
1. Concepts de base
- Concepts de base: Optimisation du retard AV et du retard VV
- Optimisation du retard AV
- Optimisation du retard VV
- Stimulation LV seule ou stimulation biventriculaire?
- Algorithme AdaptivCRT
La resynchronisation biventriculaire offre un bénéfice clinique significatif, un remodelage inverse avec réduction du volume cardiaque et une diminution de la morbidité et de la mortalité chez les patients insuffisants cardiaques présentant un QRS large. La principale limitation de cette thérapie est que toutes les études ont trouvé un pourcentage significatif de patients qui ne répondent pas favorablement à la thérapie de resynchronisation. Différentes approches ont été proposées pour réduire le pourcentage de non-répondants. Une fois le patient implanté, un réglage sous-optimal du dispositif CRT peut contribuer à altérer la qualité de la réponse. Le principe du tube cathodique est de modifier la séquence d’activation chez un patient présentant un trouble de la conduction électrique en ajustant les délais d’activation entre une sonde auriculaire droite, une sonde ventriculaire droite et une sonde ventriculaire gauche. Deux paramètres programmables sont accessibles dans ce contexte : 1) le retard AV qui détermine le timing d’activation entre l’oreillette droite et le ventricule droit, avec programmation indépendante d’un retard AV détecté (après la détection d’un auriculaire spontané (AS cycle-BV)) et d’un retard AV rythmé suivant un rythme auriculaire (AP-cycle BV). Il est possible de programmer un retard AV variable avec une réduction linéaire du retard AV parallèlement à l’augmentation de la fréquence cardiaque ; 2) Le retard VV régule le retard d’activation entre le ventricule droit et le ventricule gauche ; une activation simultanée (retard VV à 0), une pré-activation droite (RV à LV, X ms) ou une pré-activation gauche (LV à RV, X ms) sont programmables ; il n’est pas possible de programmer un retard VV variable avec des valeurs différentes au repos et pendant l’effort. Les études hémodynamiques aiguës ont clairement démontré un avantage significatif apporté par l’optimisation du retard AV et/ ou VV. La démonstration clinique de ce bénéfice est beaucoup moins convaincante.
OPTIMISATION DU RETARD AV
La contraction auriculaire contribue à 20 à 30% du débit cardiaque au repos chez les patients insuffisants cardiaques présentant un dysfonctionnement systolique, cette contribution augmentant pendant l’exercice. Les patients souffrant d’insuffisance cardiaque présentant un trouble de la conduction électrique présentent souvent une asynchronie auriculo-ventriculaire avec un raccourcissement du temps de remplissage, une fusion des ondes E et A et une régurgitation mitrale diastolique.
Chez les patients resynchronisés, la programmation d’un court délai AV permet d’anticiper l’onde E, une dissociation des ondes E et A et un allongement du temps de remplissage. Le délai AV ne doit pas être trop court car cela entraînerait l’amputation de l’onde A par fermeture mitrale. L’ajustement du délai AV est recommandé après l’implantation d’un stimulateur cardiaque ou d’un défibrillateur cathodique, même si le niveau de preuve clinique est modeste.
Il existe de grandes variations interindividuelles de la conduction intra-auriculaire et des troubles intra-ventriculaires générant des différences marquées en termes de retard AV optimal justifiant théoriquement une approche adaptée à chaque patient. Les retards AV détectés et rythmés sont programmables indépendamment et doivent également être optimisés indépendamment. Une limitation de l’optimisation du retard AV est qu’il est généralement effectué au repos en décubitus dorsal et pour une fréquence cardiaque donnée. Ces conditions diffèrent considérablement de celles observées dans la vie quotidienne. Pendant l’exercice, contrairement aux patients ayant un cœur en bonne santé où le délai AV optimal se raccourcit avec l’augmentation de la fréquence cardiaque, il semble que la réponse des patients resynchronisés au stress n’est pas stéréotypée. Chez certains patients, le délai AV optimal pendant l’exercice est plus long qu’au repos, chez d’autres, il est plus court. L’utilisation systématique de l’algorithme de retard AV automatique assure probablement une capture continue pendant l’exercice, mais n’est pas nécessairement associée à un avantage hémodynamique supplémentaire. Par conséquent, sa programmation doit être discutée pour chaque patient. La resynchronisation biventriculaire permet un remodelage inverse avec une réduction progressive dans le temps des pressions de sable volumiques télésystoliques et diastoliques finales. Par conséquent, l’optimisation du retard AV doit être idéalement répétée périodiquement.
Le retard AV optimal permet une contribution maximale de la contraction auriculaire gauche au remplissage ventriculaire gauche, prolonge le temps de remplissage, améliore le débit cardiaque en l’absence de régurgitation mitrale diastolique.
Si le retard AV est réglé trop longtemps, la contraction auriculaire se produit trop tôt dans la diastole, limitant la contribution auriculaire au remplissage ventriculaire. La contraction auriculaire est superposée à la phase diastolique initiale. L’échocardiographie cardiaque trouve une fusion entre l’onde E et une onde et un temps de remplissage court avec une régurgitation mitrale diastolique persistante.
Si le retard AV est réglé trop court, la contraction ventriculaire se produit trop tôt, ce qui entraîne une fermeture mitrale prématurée interrompant le remplissage actuel et limite la contribution auriculaire au remplissage ventriculaire. L’échocardiographie trouve une onde E prématurée, un temps de remplissage long et une onde E fendue et une onde avec une onde A tronquée par la fermeture mitrale. La diminution de la pression diastolique finale et la diminution de la précharge entraînent une réduction du dP / dt max et du débit cardiaque.
Avant de commencer l’optimisation du délai AV, certains éléments doivent être connus. Chez les patients présentant un bloc auriculo-ventriculaire complet et un bloc AV de haut grade ou avec un intervalle PR très long, les modifications du retard AV n’auront aucun effet direct sur le degré de capture et de fusion ventriculaires. En revanche, chez les patients présentant une conduction auriculo-ventriculaire préservée, la prolongation du retard AV provoquera une fusion progressive avec activation spontanée. Le réglage du retard AV doit être effectué sous contrôle électrocardiographique en intégrant l’idée que dans le groupe de patients sans bloc AV complet, qui représente la majorité des patients, le réglage du retard AV fera varier le retard entre la systole auriculaire et la systole ventriculaire mais interférera également directement avec la séquence d’activation ventriculaire et le degré de fusion ventriculaire. Pour pallier cette difficulté, le retard AV est souvent systématiquement programmé court (entre 90 et 120 ms après une activité auriculaire détectée et entre 130 et 150 ms après une stimulation auriculaire).
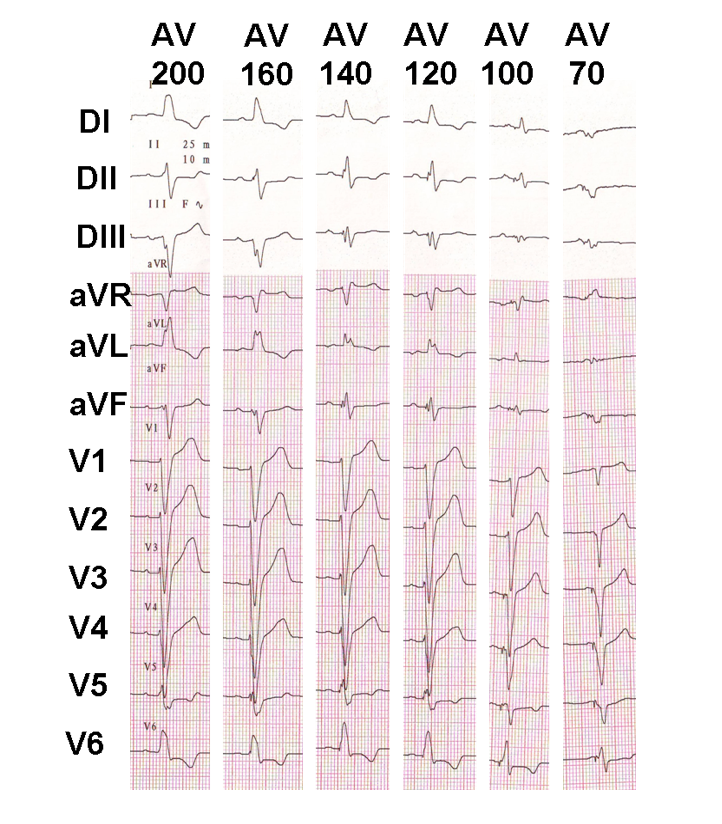
Exemple d’ajustement progressif du retard AV chez un patient resynchronisé avec conduction AV préservée; une fusion progressive apparaît avec l’allongement du retard AV.
Différentes techniques ont été proposées pour optimiser le retard AV :
- Échocardiographie
Différentes méthodes d’échocardiographie ont été proposées pour optimiser le retard AV: la méthode de Ritter (qui n’a pas été validée dans une population de patients souffrant d’insuffisance cardiaque), la recherche d’une ITV aortique ou mitrale maximale, d’une dP/dt max maximale, et la méthode itérative. Ce dernier est largement utilisé en pratique clinique, le but étant d’obtenir le temps de remplissage le plus long sans amputation de l’onde A sur la base de l’analyse du flux trans-mitral. - Autres méthodes
Diverses estimations de la contractilité cardiaque ou du débit cardiaque peuvent être utilisées: pouls d’onde, pression artérielle, dP / dt max, aspect électrocardiographique… L’applicabilité clinique dans la pratique quotidienne est souvent limitée. - Algorithme d’optimisation automatique intégré à l’appareil
Si des optimisations répétées du retard AV sont nécessaires et doivent être effectuées dans diverses conditions de pré-charge, la solution idéale serait que le stimulateur cardiaque le réalise lui-même. La fonction AdpativCRT est disponible dans la dernière génération de défibrillateurs Medtronic; les principes de fonctionnement de ce nouvel algorithme seront discutés à la fin du présent chapitre.
OPTIMISATION DU RETARD VV
Certains patients ne répondent pas à la CRT et continuent de présenter une dyssynchronie ventriculaire mécanique importante après l’implantation. L’ajustement du retard VV entraîne une stimulation biventriculaire séquentielle et a un impact direct sur la séquence d’activation ventriculaire. La modification du délai VV peut être proposée pour réduire l’asynchronie persistante chez les patients non répondants. Ce paramètre apparaît intéressant en théorie chez les patients présentant une position sous-optimale de la sonde VG, ou une latence et un temps de conduction prolongé au site de stimulation. Si l’optimisation du retard VV permet un bénéfice hémodynamique aigu significatif, la question de la pertinence clinique de ce paramètre reste débattue et non confirmée par les études cliniques. Quant au réglage du retard AV, il est probable que le processus de remodelage affecte directement l’optimisation du retard VV et que l’optimisation de ce paramètre doit être répétée dans le temps et dans diverses conditions de pré-charge.
Les mêmes outils peuvent être utilisés pour optimiser le retard AV et VV. L’échocardiographie cardiaque est souvent utilisée en pratique clinique. Le VTI aortique reflétant le débit cardiaque, le dP / dt max reflétant la contractilité cardiaque ou la mesure du degré d’asynchronie ventriculaire sont principalement utilisés. Encore une fois, la fonction AdaptivCRT propose également d’optimiser automatiquement le délai VV. Au vu des limites pratiques de l’optimisation VV, l’ajustement automatique répété de ce paramètre par l’appareil lui-même semble prometteur. Cependant, il est encore nécessaire de démontrer sa pertinence clinique.
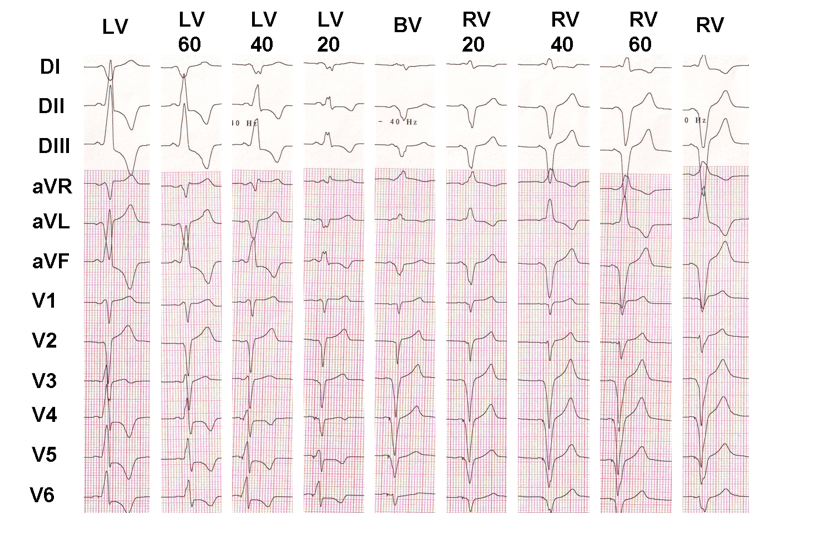
Cet exemple montre l’effet du retard VV sur l’activation électrique ventriculaire; s’il est facile de montrer que l’aspect électrocardiographique est en fait différent d’une configuration à l’autre, il est beaucoup plus difficile de déterminer quelle configuration fournira le mieux réponse clinique.
STIMULATION DU VG SEULE OU STIMULATION BIVENTRICULAIRE?
Un des principes de fonctionnement de l’algorithme AdaptivCRT consiste à choisir entre ventriculaire gauche avec fusion et stimulation biventriculaire.
Aucune étude n’a jamais démontré la supériorité de la stimulation biventriculaire sur une stimulation ventriculaire gauche pure. En revanche, les études hémodynamiques aiguës ont toujours trouvé un avantage significatif avec une stimulation ventriculaire gauche isolée. De même, les études cliniques ont trouvé un bénéfice plus ou moins identique en termes de classe NYHA, de capacité d’exercice et de remodelage ventriculaire à ceux observés avec une stimulation biventriculaire. Néanmoins, de grandes études démontrant les avantages de la resynchronisation ont toutes été réalisées avec une stimulation biventriculaire et non avec une stimulation ventriculaire gauche.
En configuration de stimulation LV, la resynchronisation des deux ventricules peut être obtenue par la fusion entre l’activation rythmique ventriculaire gauche de l’activation intrinsèque du ventricule droit. S’il semble que le bénéfice hémodynamique aigu optimal puisse être obtenu avec un certain degré de fusion (données limitées sur un nombre très limité de patients), ce degré de fusion optimal est difficile à définir et à maintenir pendant l’exercice (modifications de la fréquence cardiaque et de l’intervalle PR).
La stimulation ventriculaire gauche isolée est une option intéressante, en particulier si le dispositif implanté est un stimulateur cardiaque cathodique. En effet, elle peut être réalisée en utilisant un stimulateur cardiaque classique à double chambre sans implantation de plomb ventriculaire droit ce qui augmente le rapport coût/efficacité et réduit le risque de complication. Cependant, chez les patients dépendants d’un stimulateur cardiaque à bloc AV, l’implantation d’une sonde ventriculaire gauche seulement semble risquée étant donné le pourcentage plus élevé de délogement de la sonde et le seuil de stimulation élevé. Chez les patients implantés avec un défibrillateur CRT, l’implantation d’une sonde ventriculaire droite est essentielle. Cependant, la programmation du dispositif en configuration » stimulation BT uniquement » permet d’éviter la consommation liée à la stimulation ventriculaire droite.
ALGORITHME ADAPTIV-CRT
Comme on l’a vu précédemment, l’idéal pour des optimisations répétées de la configuration de stimulation serait que l’appareil lui-même effectue cela automatiquement. Cette procédure d’optimisation n’a aucun coût supplémentaire, et est « sans effort » pour le médecin et les différents services cliniques (échocardiographie, électrophysiologie…). De plus, la majorité des mesures effectuées par le dispositif sont reproductibles. L’algorithme d’optimisation AdaptivCRT a été développé dans ce but. La démonstration de son impact clinique favorable sur les patients resynchronisés reste cependant non prouvée.
Principes de fonctionnement
L’algorithme AdaptivCRT n’est disponible qu’en mode DDD ou DDDR et peut être activé en sélectionnant: 1) le réglage « Adaptive Bi-V » – l’appareil optimise automatiquement les paramètres de stimulation (retards AV et VV) – ou 2) le réglage ”Adaptive Bi-V et LV » – l’appareil choisira entre une configuration de stimulation BT pure avec fusion et une stimulation biventriculaire régulière avec optimisation des retards AV et VV. Cet algorithme peut également être désactivé en programmant 3) « CRT non adaptatif”.
Cet algorithme ne conduit jamais à l’utilisation de valeurs extrêmes de retards AV ou VV. Pour la fonction AdaptivCRT, les retards AV possibles détectés varient entre 80 ms et 140 ms. Les retards AV possibles varient entre 100 ms et 180 ms. La plage de synchronisation des retards VV intraventriculaires varie de 0 ms à 40 ms (préexcitation gauche ou droite).
La fonction de fonctionnement de l’AdaptivCRT repose sur l’évaluation régulière de 1) le temps de conduction auriculo-ventriculaire, qui correspond au retard entre l’EGM enregistré par la sonde auriculaire droite et l’EGM enregistré par la sonde ventriculaire droite; 2) la largeur de l’onde P, qui correspond au retard entre l’EGM auriculaire enregistré sur le canal bipolaire de la sonde auriculaire droite et l’extrémité de l’EGM auriculaire enregistrée par le canal de choc; 3) la largeur du complexe QRS qui correspond au retard entre l’EGM détecté par le bipôle ventriculaire droit et l’extrémité de l’EGM enregistrée sur le canal de choc.
L’algorithme évalue la conduction auriculo-ventriculaire intrinsèque du patient toutes les minutes et détermine si l’intervalle AV du patient est normal ou prolongé. La mesure de l’intervalle AV est effectuée en prolongeant le retard AV détecté et rythmé à 300 ms pour permettre une conduction intrinsèque. En l’absence d’événement ventriculaire conduit spontané pendant plus de 3 cycles consécutifs, une conduction AV prolongée est diagnostiquée et l’intervalle de temps entre les mesures d’intervalle AV double (par exemple, 2 min, 4 min, 8 min and et ainsi de suite jusqu’à atteindre un maximum de 16 heures).
Les mesures de largeur de l’onde P et du QRS sont programmées toutes les 16 heures. Cet intervalle justifie un échantillonnage à différents moments de la journée. Pendant la mesure, l’appareil commutera le canal d’enregistrement EGM 1 sur bobine RV (HVA) / bobine SVC (HVB) (ou HVA / anode auriculaire en l’absence de bobine SVC). Après 5 battements, le retard entre l’EGMS auriculaire et ventriculaire, la largeur de l’onde P et la largeur du QRS sont mesurés.
La première mesure de l’onde P et de la largeur QRS est programmée 30 minutes après l’implant. Après implantation, l’onde P et la largeur QRS peuvent être mesurées à tout moment en programmant le paramètre AdaptivCRT.
Si le paramètre AdaptivCRT est réglé sur « Adaptive Bi-V et BT », il peut basculer automatiquement entre le mode auto BIV et BT. Le patient sera stimulé en mode VG pur, si les conditions suivantes sont respectées: 1) la fréquence cardiaque du patient doit être inférieure ou égale à 100 bpm; 2) le retard de conduction entre l’EGM auriculaire spontanée et l’EGM ventriculaire spontanée doit être inférieur ou égal à 200 ms; 3) le retard de conduction entre l’EGM auriculaire rythmée et l’EGM ventriculaire spontanée doit être inférieur ou égal à 250 ms.
Si l’un de ces critères n’est pas trouvé, le patient est stimulé en mode biventriculaire.
Détails de la fonction de fonctionnement de l’algorithme
Le fonctionnement exact de cet algorithme est relativement confidentiel.
Dans une première étape, le dispositif évalue la conduction intrinsèque pour déterminer si l’intervalle AV d’un patient est normal ou prolongé. Les intervalles AV normaux sont définis comme étant inférieurs à 200 ms pour les intervalles auriculaires détectés et inférieurs à 250 ms pour les intervalles auriculaires.
En présence d’un temps de conduction AV normal et si la fréquence cardiaque du patient est inférieure à 100bpm, l’appareil utilisera le mode de stimulation LV adaptatif (rythme LV uniquement). La synchronisation du rythme VG est automatiquement ajustée en fonction de la mesure d’intervalle AV intrinsèque qui se produit toutes les minutes.
Si le temps de conduction AV du patient dépasse 133,3 ms, la stimulation VG se produit à environ 70% de l’intervalle AV intrinsèque.
Si le temps de conduction AV est inférieur à 133,3 ms, la stimulation BT sera délivrée 40 ms avant le QRS intrinsèque (retard AV calculé – 40 ms).
Lorsque les intervalles AV intrinsèques sont prolongés, ou lorsque la fréquence cardiaque du patient est supérieure à 100 bpm, ou si une perte de capture du VG est confirmée par la gestion de la capture du VG (LVCM), le mode BiV adaptatif fonctionnera.
Le retard AV sera alors calculé de la manière suivante :
- Après un événement auriculaire détecté, le retard AV est ajusté à un rythme de 40 ms après la fin de l’onde P (mesurée sur le canal de choc) mais d’au moins 50 ms avant le début du QRS intrinsèque.
- Après un événement auriculaire rythmé, le retard AV est ajusté à un rythme de 30 ms après la fin de l’onde P (mesurée sur le canal de choc) mais d’au moins 50 ms avant le début du QRS intrinsèque lors de la stimulation auriculaire (synchronisation entre le stimulus auriculaire et l’EGM bipolaire ventriculaire droit).
Pendant la stimulation adaptative du BiV, le délai VV optimal sera déduit de la largeur QRS.
Si la durée QRS (temporisation entre l’EGM RV bipolaire et la fin de l’EGM QRS sur le canal de choc) est comprise entre 50 ms et 150 ms, le LV sera préexcité. Si la largeur QRS est comprise entre 150 et 180 ms, une pré-excitation ventriculaire droite est définie. Si la largeur QRS n’est pas comprise entre 50 et 180 ms, une pré-excitation LV ou RV de 10 ms sera utilisée.
Les temps de conduction AV et la largeur d’onde P seront également utilisés pour optimiser le retard VV. Si le temps de conduction AV pendant le rythme auriculaire spontané est plus long que la largeur d’onde P, le retard VV sera réglé sur 0 ms.