2.1: az atomelmélet evolúciója
atomelmélet a tizenkilencedik század után
ha az anyag atomokból állt, miből álltak az atomok? Ezek voltak a legkisebb részecskék, vagy volt valami kisebb? Az 1800-as évek végén számos, az ilyen kérdések iránt érdeklődő tudós megvizsgálta az alacsony nyomású gázokban előállítható elektromos kisüléseket, a legjelentősebb felfedezést az angol fizikus tette J. J. Thomson katódsugárcső segítségével. Ez a készülék egy lezárt üvegcsőből állt, amelyből szinte az összes levegőt eltávolították; a cső két fémelektródát tartalmazott. Amikor nagyfeszültséget alkalmaztak az elektródákon, egy katódsugárnak nevezett látható sugár jelent meg közöttük. Ezt a sugarat a pozitív töltés felé és a negatív töltéstől távolították el, és ugyanolyan módon állították elő azonos tulajdonságokkal, amikor különböző fémeket használtak az elektródákhoz. Hasonló kísérletekben a sugarat egyidejűleg egy alkalmazott mágneses mező eltérítette, és az elhajlás mértékének és a mágneses tér erősségének mérése lehetővé tette Thomson számára a katódsugaras részecskék töltés / tömeg arányának kiszámítását. Ezeknek a méréseknek az eredményei azt mutatták, hogy ezek a részecskék sokkal könnyebbek voltak, mint az atomok (\(\PageIndex{1}\) ábra).
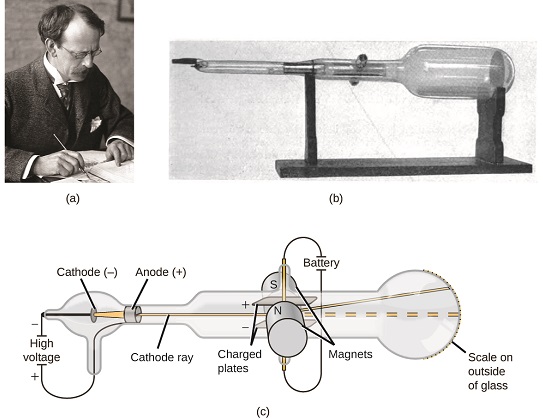
\(\PageIndex{5}\) ábra: (a) J. J. Thomson látható sugarat készített egy katódsugárcsőben. (b) Ez egy korai katódsugárcső, amelyet 1897-ben talált fel Ferdinand Braun. (c) a katódsugárban a sugár (sárga színnel látható) a katódból származik, és az anód mellett felgyorsul a cső végén lévő fluoreszcens skála felé. Az alkalmazott elektromos és mágneses mezők egyidejű eltérítése lehetővé tette a Thomson számára a katódsugarat alkotó részecskék tömeg / töltés arányának kiszámítását. (a hitel: a Nobel Alapítvány munkájának módosítása; B hitel: Eugen Nesper munkájának módosítása; C hitel: a munka módosítása “Kurzon”/Wikimedia Commons).
megfigyelései alapján Thomson javasolta és miért: a részecskéket pozitív (+) töltések vonzzák, és negatív (−) töltések taszítják, tehát negatív töltésűnek kell lenniük (mint a töltések taszítják és ellentétben a töltések vonzzák); kevésbé masszívak, mint az atomok és megkülönböztethetetlenek, függetlenül a forrásanyagtól, tehát minden atom alapvető, szubatomi alkotóelemeinek kell lenniük. Bár akkoriban ellentmondásos volt, Thomson gondolatát fokozatosan elfogadták, és katódsugaras részecskéje az, amit ma elektronnak nevezünk, negatív töltésű, szubatomi részecske, amelynek tömege több mint ezerszer kisebb, mint egy atomé. Az “elektron” kifejezést 1891-ben George Stoney Ír fizikus találta ki az “elektromos ion” – ból.”
1909-ben Robert A. Millikan amerikai fizikus több információt tárt fel az elektronról az “olajcsepp” kísérletein keresztül. Millikan mikroszkopikus olajcseppeket hozott létre, amelyeket súrlódás útján elektromosan fel lehet tölteni, amikor kialakulnak, vagy röntgensugarak segítségével. Ezek a cseppek kezdetben a gravitáció miatt estek le, de lefelé irányuló előrehaladásukat lelassíthatja vagy akár megfordíthatja a készülékben alacsonyabb elektromos mező. Az elektromos térerősség beállításával és gondos mérésekkel és megfelelő számításokkal Millikan meg tudta határozni az egyes cseppek töltését (\(\PageIndex{2}\) ábra).
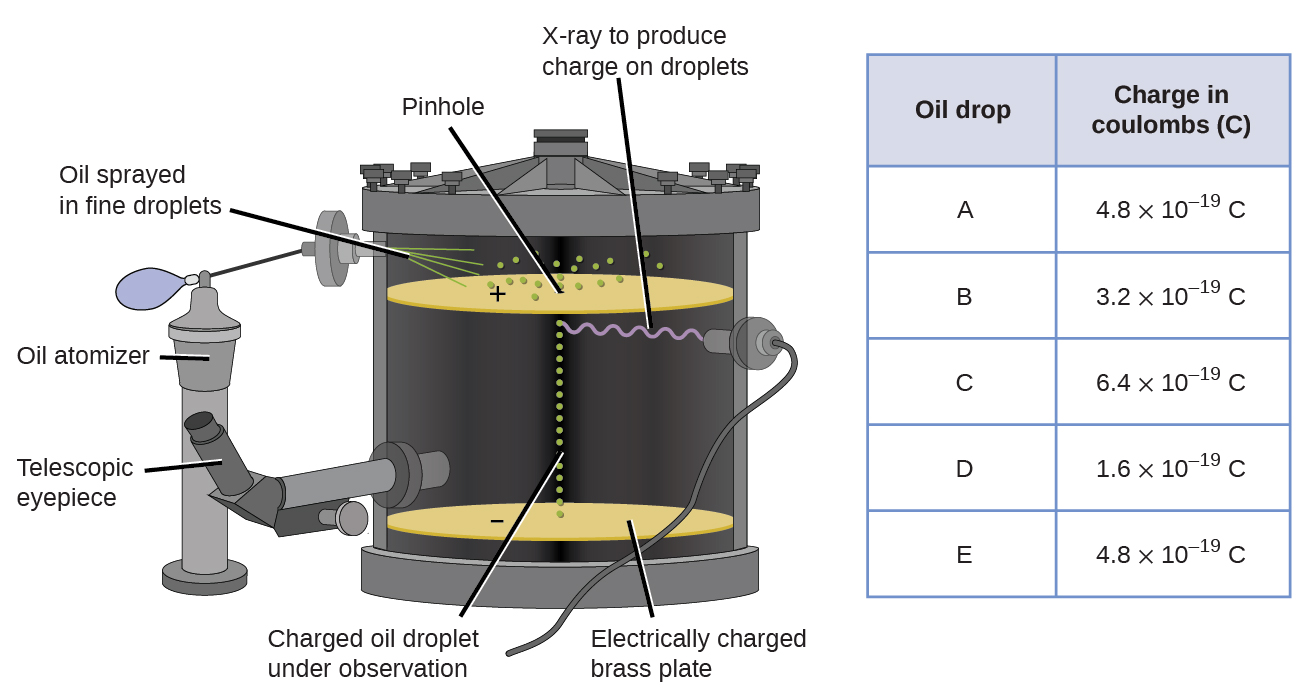
\(\PageIndex{6}\) ábra: Millikan kísérlete az egyes olajcseppek töltését mérte. A táblázatos adatok példák néhány lehetséges értékre.
A Millikan által összegyűjtött töltési adatokat tekintve felismerhette, hogy egy olajcsepp töltése mindig egy adott töltés többszöröse, 1,6 \(\times\) 10-19 C. Millikan arra a következtetésre jutott, hogy ennek az értéknek tehát alapvető töltésnek kell lennie—egyetlen elektron töltésének—mért töltéseivel egy elektron feleslege miatt (1-szer 1.6 \ (\alkalommal\) 10-19 C), két elektron (2-szer 1,6 \(\alkalommal\) 10-19 C), három elektron (3-szor 1,6 \(\alkalommal\) 10-19 C), és így tovább, egy adott olajcseppen. Mivel az elektron töltése Millikan kutatásának köszönhetően már ismert volt, és a töltés/tömeg arány Thomson kutatásának köszönhetően már ismert volt (1,759 \(\times\) 1011 C / kg), csak egyszerű számításra volt szükség az elektron tömegének meghatározásához is.
\
A tudósok most megállapították, hogy az atom nem oszthatatlan, ahogy Dalton hitte, és Thomson, Millikan és mások munkájának köszönhetően a negatív, szubatomi részecskék—az elektronok—töltése és tömege ismert volt. Az atom pozitív töltésű része azonban még nem volt jól megértve. 1904-ben Thomson javasolta az atomok “szilva puding” modelljét, amely pozitív töltésű tömeget írt le azonos mennyiségű negatív töltéssel, bele ágyazott elektronok formájában, mivel minden atom elektromosan semleges. 1903-ban hantaro Nagaoka versengő modellt javasolt, aki Szaturnusz-szerű atomot feltételezett, amely pozitív töltésű gömbből áll, amelyet elektronok halója vesz körül (\(\PageIndex{3}\) ábra).
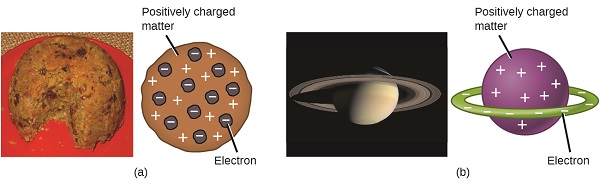
ábra \(\PageIndex{7}\): (a) Thomson azt javasolta, hogy az atomok hasonlítsanak a szilva pudingra, egy angol desszertre, amely nedves süteményből áll, beágyazott mazsolával (“szilva”). (B) Nagaoka azt javasolta, hogy az atomok hasonlítsanak a Szaturnusz bolygóra, egy pozitív “bolygót körülvevő elektrongyűrűvel.”(a jóváírás: a munka módosítása A “Man vyi”/Wikimedia Commons által; B jóváírás: a munka módosítása a “NASA”által/Wikimedia Commons).
az atom megértésének következő jelentős fejleménye Ernest Rutherford, egy új-zélandi fizikus volt, aki tudományos karrierjét nagyrészt Kanadában és Angliában töltötte. Kísérletsorozatot hajtott végre nagy sebességű, pozitív töltésű alfa-részecskék (a rádium radioaktív bomlása által előállított) sugárnyaláb felhasználásával; a radioaktív bomlásról két protonból és két neutronból áll (a radioaktív bomlásról a nukleáris kémiáról szóló fejezetben többet megtudhat). Rutherford és kollégái, Hans Geiger (később híres a Geiger-számlálóról) és Ernest Marsden egy nagyon vékony aranyfóliára céloztak egy olyan sugárnyi antioxidánst, amelynek forrását egy ólomtömbbe ágyazták be, hogy elnyeljék a sugárzás nagy részét, és megvizsgálták az ebből eredő szétszóródást a ++ részecskék segítségével egy Lumineszcens képernyő segítségével, amely rövid ideig ragyogott, ahol egy ++ részecske eltalálta.
mit fedeztek fel? A legtöbb részecske áthaladt a fólián anélkül, hogy egyáltalán elhajlott volna. Néhányat azonban kissé eltérítettek, és nagyon kis számban szinte egyenesen a forrás felé tereltek (\(\PageIndex{4}\) ábra). Rutherford leírta ezeket az eredményeket: “ez volt a leghihetetlenebb esemény, ami valaha történt velem az életemben. Majdnem olyan hihetetlen volt, mintha egy 15 hüvelykes héjat lőtt volna egy darab selyempapírra, és visszajött, és megütött”1 (68. o.).
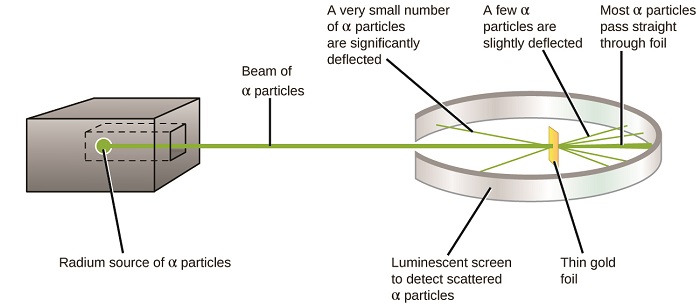
\(\PageIndex{8}\) ábra: Geiger és Rutherford egy darab aranyfóliára lőtte ki a belőlük származó részecskéket, és észlelte, hogy a részecskék hova kerültek, amint azt a kísérlet ezen vázlatos ábrája is mutatja. A részecskék többsége egyenesen áthaladt a fólián, de néhányat kissé eltérítettek, nagyon kis számban pedig jelentősen eltérítettek.
Rutherford erre a következtetésre jutott: mivel a gyorsan mozgó ++ részecskék többsége szabadon haladt át az aranyatomokon, az atom belsejében lényegében üres térben kellett utazniuk. Az alfa részecskék pozitív töltésűek, így az elhajlások akkor keletkeztek, amikor egy másik pozitív töltéssel találkoztak (mint például a töltések taszítják egymást). Mivel a hasonló töltések taszítják egymást, az a néhány pozitív töltésű részecske, amely hirtelen megváltoztatta az utat, biztosan eltalált, vagy szorosan megközelítette egy másik testet, amelynek szintén erősen koncentrált, pozitív töltése volt. Mivel az elhajlás az idő kis részében történt, ez a töltés csak kis mennyiségű helyet foglalt el az aranyfóliában. Az ilyen kísérletek sorozatát részletesen elemezve Rutherford két következtetést vont le:
- az atom által elfoglalt térfogatnak nagy mennyiségű üres térből kell állnia.
- minden atom középpontjában egy kicsi, viszonylag nehéz, pozitív töltésű testnek, a magnak kell lennie.
ez az elemzés arra késztette Rutherfordot, hogy javasoljon egy modellt, amelyben egy atom egy nagyon kicsi, pozitív töltésű magból áll, amelyben az atom tömegének nagy része koncentrálódik, negatív töltésű elektronokkal körülvéve, így az atom elektromosan semleges (\(\PageIndex{5}\) ábra).
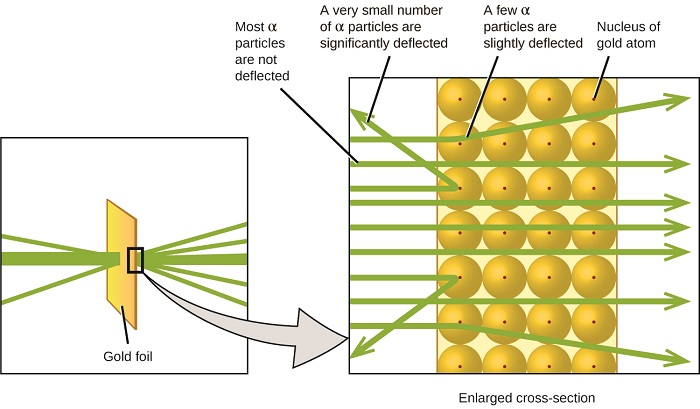
\(\PageIndex{9}\) ábra: a \ (\PageIndex {9}\) részecskék csak akkor térnek el, ha ütköznek a sokkal nehezebb, pozitív töltésű aranymaggal, vagy annak közelében haladnak át. Mivel a mag nagyon kicsi az atom méretéhez képest, nagyon kevés a belőlük származó részecskék elhajlása. A legtöbb áthalad az elektronok által elfoglalt viszonylag nagy régión, amelyek túl könnyűek ahhoz, hogy eltérítsék a gyorsan mozgó részecskéket.
sok további kísérlet után Rutherford azt is felfedezte, hogy más elemek magjai “építőelemként” tartalmazzák a hidrogénmagot, és ezt az alapvetőbb részecskét protonnak, a pozitív töltésű, szubatomi részecskének nevezte el, amely a magban található. Egy kiegészítéssel, amelyet a következőkben megtudhat, az atomnak ezt a nukleáris modelljét, amelyet több mint egy évszázaddal ezelőtt javasoltak, ma is használják.
egy másik fontos megállapítás az izotópok felfedezése volt. Az 1900-as évek elején a tudósok számos olyan anyagot azonosítottak, amelyek új elemeknek tűntek, elkülönítve őket a radioaktív ércektől. Például a tórium radioaktív bomlása által előállított” új elem ” kezdetben mesothorium nevet kapta. Egy részletesebb elemzés azonban azt mutatta, hogy a mesothorium kémiailag azonos a rádiummal (egy másik bomlástermék), annak ellenére, hogy eltérő atomtömegű volt. Ez az eredmény, más elemek hasonló megállapításaival együtt, arra késztette Frederick Soddy angol kémikust, hogy rájöjjön, hogy egy elemnek lehetnek különböző típusú atomjai, amelyek kémiailag megkülönböztethetetlenek. Ezeket a különböző típusokat izotópoknak nevezzük-ugyanazon elem atomjai, amelyek tömegükben különböznek egymástól. Soddy 1921-ben elnyerte a kémiai Nobel-díjat ezért a felfedezésért.
egy rejtvény maradt: a magról ismert volt, hogy egy atom tömegének szinte teljes részét tartalmazza, a protonok száma csak ennek a tömegnek a felét vagy annál kevesebbet szolgáltat. Különböző javaslatokat tettek annak magyarázatára, hogy mi alkotja a fennmaradó tömeget, beleértve a semleges részecskék létezését a magban. Ahogy az várható volt, a töltetlen részecskék kimutatása nagy kihívást jelent, és James Chadwick csak 1932-ben talált bizonyítékot neutronokra, töltetlen, szubatomi részecskékre, amelyek tömege megközelítőleg azonos a protonokéval. A neutron létezése az izotópokat is magyarázta: tömegükben különböznek, mert különböző számú neutronjuk van, de kémiailag azonosak, mert azonos számú protonjuk van. Ezt később részletesebben ismertetjük ebben az egységben.