bevezető kémia-1. kanadai kiadás
tanulási célok
- határozza meg a folyadékok gőznyomását.
- magyarázza el mind a felületi feszültség, mind a kapilláris hatás eredetét.
minden folyadéknak van néhány tulajdonsága. A folyadék, amelyet leginkább ismerünk, valószínűleg víz, és rendelkezik ezekkel a tulajdonságokkal. Más folyadékok is rendelkeznek velük, amit szem előtt kell tartani.
minden folyadék részecskéinek egy bizonyos része elegendő energiával rendelkezik ahhoz, hogy belépjen a gázfázisba, és ha ezek a részecskék a folyadék felszínén vannak, akkor ezt megteszik (10.6.ábra “párolgás”). A gáz képződését folyadékból a forráspont alatti hőmérsékleten elpárologtatásnak nevezzük. Ezen a hőmérsékleten a gázfázisban lévő anyagot gőznek nevezzük, nem pedig gáznak; a gáz kifejezés akkor van fenntartva, amikor a gázfázis a stabil fázis.
10. ábra.6 párolgás

a folyadék egyes részecskéinek elegendő energiája van ahhoz, hogy a folyadékfázisból gőzré váljanak.
Ha a rendelkezésre álló térfogat elég nagy, végül az összes folyadék gőzré válik. De ha a rendelkezésre álló térfogat nem elegendő, végül a gőzrészecskék egy része visszatér a folyadékfázisba (10.7.ábra “egyensúly”). Egy bizonyos ponton a gőzfázisba belépő részecskék száma megegyezik a gőzfázisból kilépő részecskék számával, így a rendszerben nincs nettó változás a gőz mennyiségében. Azt mondjuk, hogy a rendszer egyensúlyban van. A gőz egyensúlyi parciális nyomását a folyadék gőznyomásának nevezzük.
ábra 10.7 egyensúly

egy bizonyos ponton a gőzfázisba belépő részecskék számát kiegyenlíti a folyadékba visszatérő részecskék száma. Ezt a pontot egyensúlynak nevezik.
értsd meg, hogy a folyadék nem állt le a párolgás. A fordított folyamat-a kondenzáció-olyan gyorsan megy végbe, mint a párolgás, így a rendszerben nincs nettó változás a gőz mennyiségében. A dinamikus egyensúly kifejezés olyan helyzetet jelent, amelyben egy folyamat még mindig bekövetkezik, de az ellenkező folyamat is ugyanolyan ütemben zajlik, így a rendszerben nincs nettó változás.
Az anyag gőznyomása az anyag hőmérsékletétől függ; a hőmérséklet növekedésével a gőznyomás is. 10. ábra.8 “több folyadék gőznyomásának vagy hőmérsékletének diagramja” a gőznyomás és a hőmérséklet diagramja több folyadék esetében. A gőznyomás meghatározása után újradefiniálhatjuk a folyadék forráspontját is: azt a hőmérsékletet, amelyen a folyadék gőznyomása megegyezik a környező környezeti nyomással. A normál gőznyomás tehát az a hőmérséklet, amelyen a gőznyomás 760 torr, vagy pontosan 1 atm. Így a forráspontok a környező nyomástól függően változnak, ez a tény nagy hatással lehet az ételek szakácsára a normálnál alacsonyabb vagy magasabb magasságokban. A légköri nyomás a magasságtól függően jelentősen változik.
10.8.ábra több folyadék gőznyomásának és hőmérsékletének diagramjai
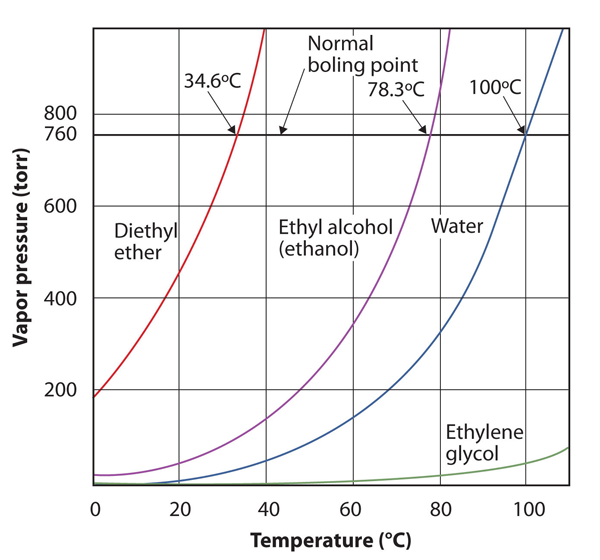
a folyadék gőznyomása a folyadék azonosságától és a hőmérséklettől függ, amint azt ez a diagram mutatja.
4. példa
használja a 10.8. ábrát “több folyadék gőznyomásának és hőmérsékletének diagramjai” a víz forráspontjának 500 torr-ra történő becsléséhez, amely a Mount Everest tetején lévő hozzávetőleges légköri nyomás.
megoldás
lásd a mellékelt ábrát. Az ötszáz torr 400 és 600 között van, ezért az y tengely ezen pontjától a víz görbéjéig húzunk egy vonalat, majd leengedjük az x tengelyre, hogy leolvassuk a kapcsolódó hőmérsékletet. Úgy tűnik, hogy a vízgőznyomás-görbe pontja körülbelül 90 Celsius-C hőmérsékletnek felel meg, ezért arra a következtetésre jutunk, hogy a víz forráspontja 500 torr-nál 90 Celsius-C.
10.9 ábra a 10.ábrával.8 “gőznyomás és hőmérséklet több folyadék esetében” a 4. példa megválaszolásához
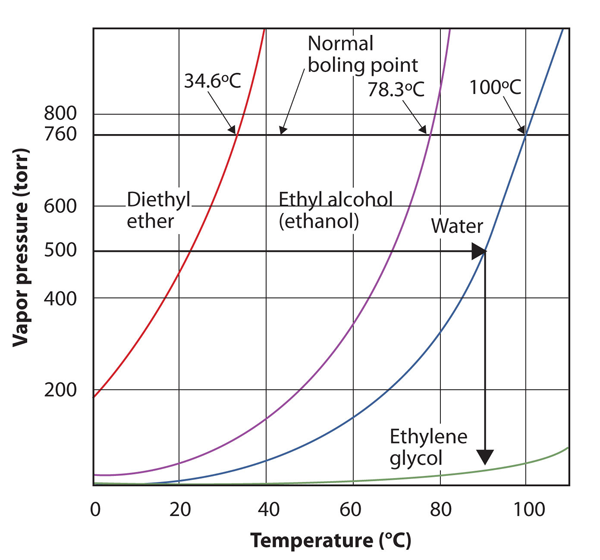
a grafikon megfelelő olvasásával megbecsülheti a folyadék forráspontját különböző hőmérsékleteken.
tesztelje magát
használja a 10.8.ábrát “több folyadék gőznyomásának és hőmérsékletének diagramjai” az etanol forráspontjának 400 torr-ra történő becsléséhez.
válasz
körülbelül 65++C
a víz gőznyomási görbéje nem pontosan nulla az olvadáspontnál—0 C. még a jégnek is van gőznyomása; ezért szublimál az idő múlásával. A szilárd anyagok gőznyomása azonban általában sokkal alacsonyabb, mint a folyadékoké. -1 C-nál a jég gőznyomása 4,2 torr. Ha a fagyasztó hőmérséklete 0 GB F (-17 C), a jég gőznyomása csak 1,0 torr; az úgynevezett mélyfagyasztók -23 C-ra süllyedhetnek, ahol a jég gőznyomása csak 0,6 torr.
Fázisdiagramok
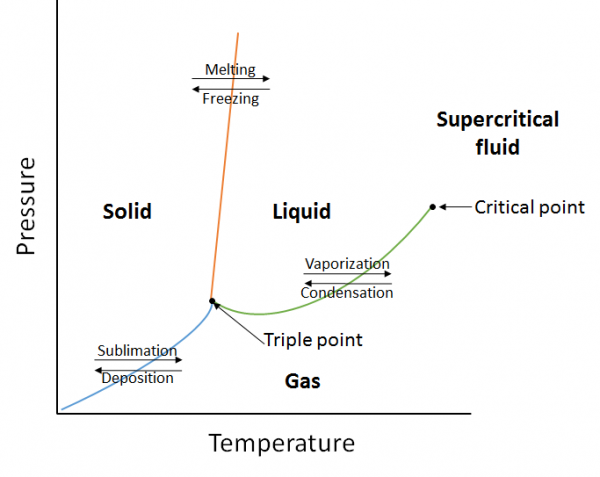
a fázisdiagram az anyag fázisai közötti egyensúlyi viszonyok grafikus ábrázolása meghatározott nyomás és hőmérséklet mellett (10.10.ábra). A fázisdiagram három görbe kombinációja: a gőznyomás-görbe, az olvadási görbe és a szublimációs görbe. Korábban láttuk, hogy a gőznyomás-görbék a folyadék-és gázfázis egyensúlyát képviselik, és az a pont, ahol a nyomás 1 atm-nek felel meg, a normál forráspont. Ennek a görbének egy további jellemzője a fázisdiagramban (zöld) az, hogy a kritikus ponton végződik. A kritikus pont az a pont a legmagasabb hőmérsékleten és nyomáson, ahol a folyadékok és gázok megkülönböztethetők maradnak. Ezen a ponton túli hőmérsékleten és nyomáson az anyag egy olyan fázisban létezik, amely mind a folyadékok, mind a gázok tulajdonságait szuperkritikus folyadéknak nevezik.
az olvadási görbe (narancssárga) a szilárd és a folyadék közötti egyensúlyt jelenti, és az a pont, ahol a nyomás 1 atm-nek felel meg, a normál olvadáspont. A szublimációs görbe (kék) a szilárd és a gáz közötti egyensúlyt jelenti. Végül azt a pontot, ahol mindhárom görbe találkozik, hármas pontnak nevezzük. Ezen a ponton három fázis (szilárd, folyékony és gáz) létezik egyensúlyban.
példa:
a következő fázisdiagram segítségével határozza meg, mi történne, ha:
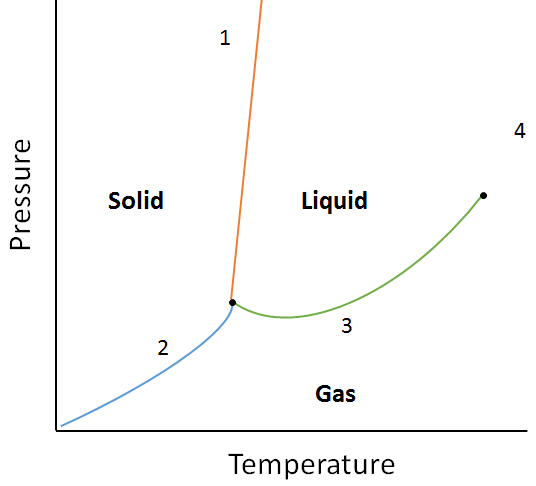
a. Az anyag hőmérséklete az 1.pontban megemelkedik.
b.Az anyag nyomása a 3.pontban növekszik.
oldat:
a. az 1. pontban lévő anyag megolvad (a fázist Szilárdról folyadékra változtatja), ha a hőmérsékletet megemelik.
b. A 3.pontban lévő anyag kondenzálódik (fázisváltás gázról folyadékra), ha a hőmérsékletet megemelik.
felületi feszültség és kapilláris hatás
minden folyadéknak más tulajdonságai is vannak. A felületi feszültség olyan hatás, amelyet a folyadék felületén lévő atomokra gyakorolt erők egyensúlyhiánya okoz, amint azt a 10.11.ábra mutatja “felületi feszültség”. A folyadék nagy részében lévő kék részecske intermolekuláris erőket tapasztal a környékről, amint azt a nyilak szemléltetik. A felszínen lévő sárga részecske azonban nem tapasztal semmilyen erőt felette, mert nincsenek részecskék felette. Ez az erők egyensúlyhiányához vezet, amelyet felületi feszültségnek nevezünk.
ábra 10.11 felületi feszültség

a felületi feszültség abból adódik, hogy a folyadék felszínén lévő részecskék nem tapasztalnak kölcsönhatásokat minden irányból, ami a felületen lévő erők egyensúlyhiányához vezet.
ábra 10.12 a felületi feszültség hatásai

forrás:” wet apple ” cristian ruberti alatt engedélyezett Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic.