Entalpia és kémiai reakciók
7.3 entalpia és kémiai reakciók
tanulási célok
- határozza meg az entalpiát.
- megfelelően fejezze ki a kémiai reakciók entalpia változását.
- magyarázza el, hogyan mérik az entalpia változásait kísérletileg.
most, hogy megmutattuk, hogyan kapcsolódik az energia, a munka és a hő, készen állunk arra, hogy figyelembe vegyük az energia változásait a kémiai reakciókban. Alapvető koncepció az, hogy minden kémiai reakció az energia egyidejű változásával történik. Most meg kell tanulnunk, hogyan kell megfelelően kifejezni ezeket az energiaváltozásokat.
a gázok 6.fejezet “gázok” című fejezetében és a munka 7.2 “munka és hő” című fejezetében szereplő munkameghatározásunk azt jelzi, hogy az olyan körülmények, mint a nyomás, a térfogat és a hőmérséklet, befolyásolják a rendszer energiatartalmát. Amire szükségünk van, az az energia definíciója, amely akkor áll fenn, ha ezek közül a feltételek közül néhányat meghatározunk (némileg hasonló a standard hőmérséklet és nyomás definíciójához a gázok vizsgálatában). Meghatározzuk az entalpia változásátegy folyamat hője állandó nyomáson; jelöli a CC-t. (A folyamat hője, amikor a nyomást állandó értéken tartják:
a H betű az “entalpia” – t jelenti, egyfajta energiát, míg a ++ a mennyiség változását jelenti. Mindig érdekel a H változása, nem pedig maga a H abszolút értéke.
amikor kémiai reakció következik be, az entalpia jellegzetes változása következik be. A reakció entalpia változását általában egy kiegyensúlyozott kémiai egyenlet után, ugyanazon a vonalon írják. Például, amikor két mól hidrogén reagál egy mól oxigénnel, hogy két mól vizet hozzon létre, a jellemző entalpia változás 570 kJ. Az egyenletet
2H2 (g) + O2(g) 2H2O(Caetlin) CETLINH = -570 kj
az entalpia változást tartalmazó kémiai egyenletet termokémiai egyenlőségnek nevezzük.egy kémiai egyenlet, amely entalpia változást tartalmaz.. Feltételezzük, hogy a termokémiai egyenlet moláris mennyiségben utal az egyenletre, ami azt jelenti, hogy mólok, nem pedig egyes molekulák szempontjából kell értelmezni.
5. példa
írja be a PCL3(g) és Cl2(g) reakciójának termokémiai egyenletét PCl5(g) előállításához, amelynek entalpia változása -88 kJ.
megoldás
a termokémiai egyenlet
PCl3 ( g) + Cl2(g) cl 5(g) CL = -88 kj
tesztelje magát
írja be a termokémiai egyenletet az N2(g) O2(g) reakciójára, hogy 2NO(g) legyen, amelynek entalpia változása 181 kJ.
válasz
N2(g) + O2(G Feltételezzük, hogy a szám pozitív, ha nincs jele; a + jel kifejezetten hozzáadható a félreértések elkerülése érdekében. Azt mondják, hogy az a kémiai reakció, amelynek pozitív a vesztesége, endotermikusegy kémiai reakció, amelynek pozitív változása van az entalpiában., míg egy negatív kémiai reakcióról azt mondják, hogy van egy oxigén exotermikémiai reakció, amelynek negatív változása van az entalpiában..
mit jelent az, ha EGY folyamat pozitív? Ez azt jelenti, hogy a rendszer, amelyben a kémiai reakció bekövetkezik, energiát nyer. Ha figyelembe vesszük, hogy egy rendszer energiája magasságként jelenik meg egy függőleges energiaterületen, akkor a reakciót kísérő entalpia-változás a 7.3.ábra “Reakcióenergia” a) részében ábrázolható: a reagensek energiájának van némi energiája, és a rendszer növeli energiáját, amikor a termékekhez megy. A termékek magasabbak a függőleges skálán, mint a reagensek. Az endoterm tehát azt jelenti, hogy a rendszer energiát nyer vagy elnyel.
ellentétes helyzet áll fenn egy exoterm folyamat esetében, amint azt a 7.3.ábra “Reakcióenergia”B) része mutatja. Ha egy reakció entalpia változása negatív, akkor a rendszer energiát veszít, így a termékek kevesebb energiával rendelkeznek, mint a reagensek, és a termékek alacsonyabbak a függőleges energiask-on, mint a reagensek. Az exoterm tehát azt jelenti, hogy a rendszer energiát veszít vagy bocsát ki.
7.3.ábra Reakcióenergia
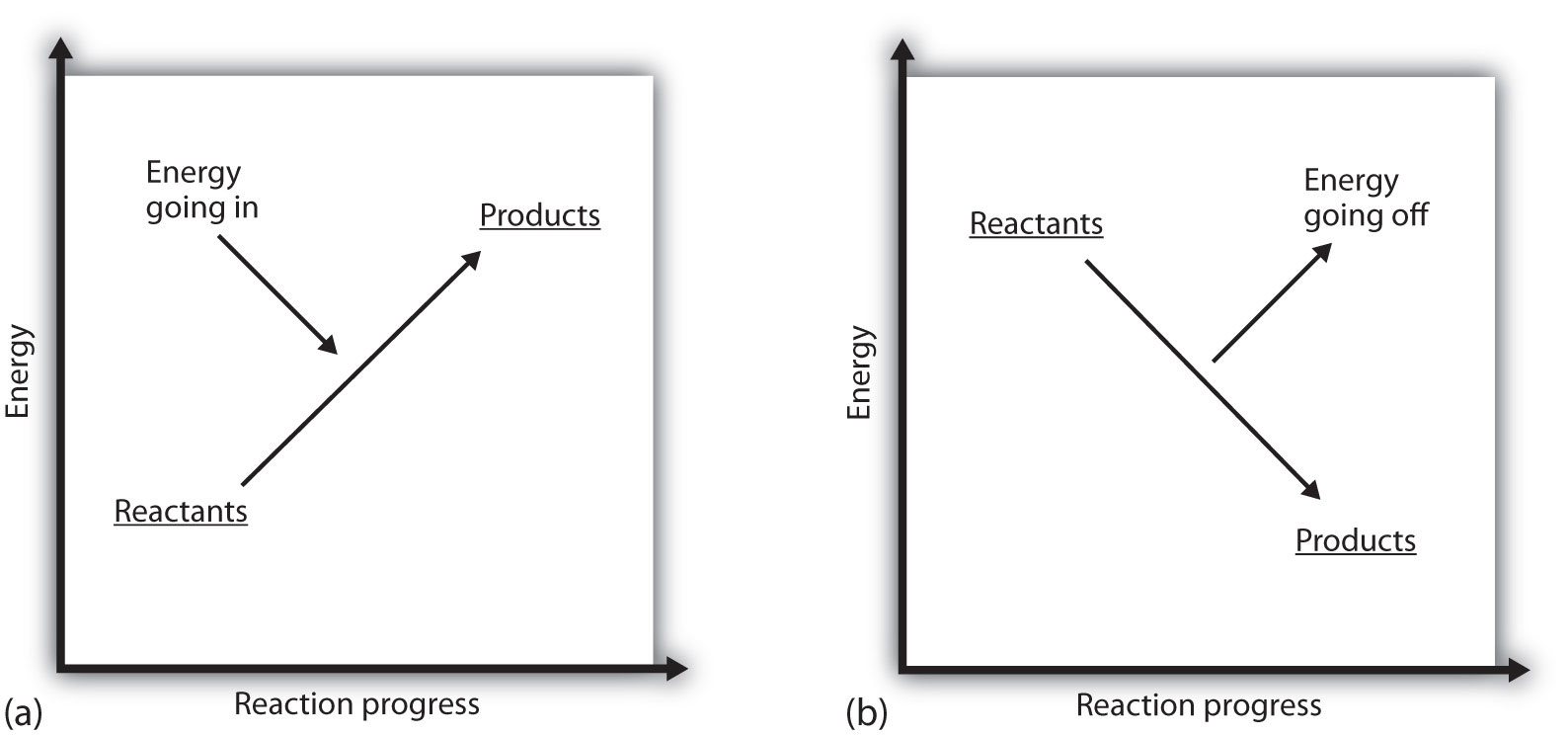
(a) egy endoterm reakcióban a rendszer energiája növekszik (azaz magasabbra mozog a függőleges energia skálán). (b) egy exoterm reakcióban a rendszer energiája csökken (azaz az energia függőleges skáláján alacsonyabban mozog).
6.példa
Tekintsük ezt a termokémiai egyenletet.
2CO ( g) + O2(g) ++ 2co2(g) ++ H = -565 kJ
exoterm vagy endoterm? Mennyi energiát bocsátanak ki vagy szívnak fel?
megoldás
definíció szerint egy kémiai reakció, amelynek negatívja van CGH exoterm, ami azt jelenti, hogy ennyi energiát—ebben az esetben 565 kJ—ad le a reakció.
tesztelje magát
fontolja meg ezt a termokémiai egyenletet.
CO2 ( g) + h2(g) CAC(g) + H2O (G) CC = 42 kj
exoterm vagy endoterm? Mennyi energiát bocsátanak ki vagy szívnak fel?
válasz
endoterm; 42 kJ felszívódik.
hogyan mérjük a kísérleti úton a CBH értékeket? Valójában nem a CC-t mérjük, hanem a Q-t. De a méréseket állandó nyomás mellett végezzük, így a CH egyenlő a mért q-val.
kísérletileg a q-t a
Q = MC) egyenlet előnyeinek kihasználásával mérjük meg a vegyi anyagok tömegét egy rendszerben. Ezután hagyjuk, hogy a kémiai reakció bekövetkezzen, és megmérjük a rendszer hőmérsékletváltozását (PPT). Ha ismerjük a rendszerben lévő anyagok fajlagos hőjét (általában ezt tesszük), akkor kiszámíthatjuk q. ez a q értéke számszerűen megegyezik a folyamat ANTIOXIDÁNSÁVAL, amelyet moláris skálára skálázhatunk. A tartály, amelyben a rendszer található, jellemzően szigetelt, így minden energiaváltozás a rendszer hőmérsékletének megváltoztatásába kerül, ahelyett, hogy kiszivárogna a rendszerből. A tartályt kaloriméternek nevezikegy kémiai reakció hőjének mérésére használt tartály. az entalpia változásainak mérési folyamatát kalorimetriának nevezikaz entalpia változásainak kémiai reakciókhoz való mérésének folyamata..
7.4.ábra Kaloriméterek
egyszerű kaloriméter készíthető néhány beágyazott habos kávéscsészéből, egy fedélből, egy hőmérőből és egy keverőből.
tegyük fel például, hogy 4,0 g NaOH – t vagy 0,10 mol NaOH-t feloldunk 100,0 mL vizes oldat előállításához, míg 3,65 g HCl-t vagy 0,10 mol HCl-t feloldunk, hogy további 100,0 mL vizes oldatot kapjunk. A két oldatot szigetelt kaloriméterben összekeverjük, hőmérőt helyezünk be, és a kalorimétert lefedjük (lásd a 7.4.ábrát “Kaloriméterek” egy példa beállításhoz). A hőmérő a következő kémiai reakció bekövetkezésekor méri a hőmérsékletváltozást:
NaOH (aq) + HCl(AQ) ++ NaCl(aq) + H2O ( ++ )
egy megfigyelő megjegyzi, hogy a hőmérséklet 22,4 C-ról 29,1 C-ra emelkedik. Az oldat teljes mennyisége 200,0 mL, 1,00 g/mL sűrűséggel tehát 200,0 g oldat van. A q egyenletét használva helyettesítjük a kísérleti méréseinket és a víz fajlagos hőjét (7.1.táblázat “különböző anyagok fajlagos Melegei”):
q=(200,0 g)(4.184 J G C)(6.7 C)
Q megoldása, a reakcióhoz
q=5600 J ++ h-t kapunk
A Q hő egyenlő a reakcióhoz tartozó Xiah-val, mert a kémiai reakció állandó nyomáson megy végbe. A reakció azonban ezt az energiamennyiséget bocsátja ki, tehát a tényleges jel a CC-n negatív:
Xiah = -5,600 J a reakcióhoz
így a kaloriméterben bekövetkezett kémiai reakcióra a következő termokémiai egyenlet áll rendelkezésre:
110 NaOH(aq)+110 HCl(aq) kb 110 NaCl(aq)+110 H2O(AQ)Xiah=-5,600 j
az 1/10 együtthatók arra emlékeztetnek minket, hogy minden reagens egy móljának tizedével kezdtük, ezért a következő kémiai egyenletet kapjuk: készítsen egy tized mólot minden termékből. Jellemzően azonban a termokémiai egyenleteket mólok, nem pedig egy mól tizede szempontjából jelentjük. A moláris mennyiségek növeléséhez meg kell szoroznunk az együtthatókat 10-gyel. Ha ezt tesszük, 10-szer annyi energiát kapunk. Így van
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
A ΔH alakítható kJ egységek, így a végső thermochemical egyenlet
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Mi volna a kísérleti adatok a kalorimetriával meghatározott, az entalpia változás, kémiai reakció. Más kémiai reakciók hasonló mérései meghatározhatják a tanulmányozni kívánt kémiai reakciókból származó összes kémiai reakció értékét.
7.példa
100 mL 0-s oldat.25 mól Ca2 + (aq)−t 0,50 mól F−(aq) – ionnal kevertünk, és CaF2-t kicsaptunk:
Ca2+(aq) + 2F – (AQ) – (AQ) CaF2 (s)
az oldat hőmérséklete 10,5 CC-vel nőtt. mi volt az entalpia változása a kémiai reakció során? Mi volt az entalpia változása 1 mol CaF2 előállításához? Tegyük fel, hogy az oldat sűrűsége és fajlagos hője megegyezik a vízével.
megoldás
mivel közvetlenül kapjuk az ACT-t, meg tudjuk határozni a reakció hőjét, amely egyenlő a CC-vel:
q=(100 g)(4,184 J G C)(10.5 C)
Q megoldása esetén
q = 4400 j
ezért a reakció sztöchiometriája szerint pontosan 0,25 mol CaF2 képződik, tehát ez a hőmennyiség 0,25 mol. 1 mól CaF2 esetében négyszeresére kell növelnünk a hőt:
q = 4400 J ++ 4 = 17 600 J 1 mól CaF2
moláris alapon, az entalpia változása
++ = -17 600 J = -17,6 kJ
tesztelje magát
kaloriméterben állandó nyomáson, 0,10 mól CH4(g) és 0,20 mól O2 g) reagáltak.
CH4(g) + 2O2(g) CAC CO2(g) + 2H2O (CAC)
a reakció felmelegszik 750.0 g H2O-t 28,4 CC-vel. mi az a reakció a moláris skálán?
válasz
-891 kJ
kulcs elvihető
- Minden kémiai reakció az energia egyidejű változásával történik.
- az entalpia változása egyenlő hő állandó nyomáson.
- az entalpia változásait termokémiai egyenletekkel lehet kifejezni.
- az entalpia változásait kalorimetriával mérjük.
gyakorlatok
-
milyen körülmények között azonos a Q és a CAC?
-
milyen körülmények között különbözik a Q és a CC?
-
a hidrogéngáz és a klórgáz reakcióba lépve hidrogén-klorid gázt állít elő -184 kJ entalpia-változással. Írjon egy megfelelően kiegyensúlyozott termokémiai egyenletet ehhez a folyamathoz.
-
propán (C3H8) elemi oxigéngázzal reakcióba lépve szén-dioxidot és folyékony vizet hoz létre -2220 kJ entalpia-változással. Írjon egy megfelelően kiegyensúlyozott termokémiai egyenletet ehhez a folyamathoz.
-
A nitrogéngáz reakcióba lép az oxigéngázzal, hogy NO(g) – t hozzon létre, miközben elnyeli a 180 kJ-t. Írjon egy megfelelően kiegyensúlyozott termokémiai egyenletet ehhez a folyamathoz.
-
a szilárd nátrium klórgázzal reagálva szilárd nátrium-kloridot képez, miközben 772 kJ-t bocsát ki. Írjon egy megfelelően kiegyensúlyozott termokémiai egyenletet ehhez a folyamathoz.
-
a hidrogéngáz és a klórgáz reakcióba lépve hidrogén-klorid gázt állít elő -184 kJ entalpia-változással. Ez a folyamat endoterm vagy exoterm?
-
propán (C3H8) reagál az elemi oxigéngázzal szén-dioxid előállítására, miközben 2220 kJ energiát bocsát ki. Ez a folyamat endoterm vagy exoterm?
-
A nitrogéngáz reakcióba lép az oxigéngázzal, hogy NO(g) – t hozzon létre, miközben elnyeli a 180 kJ-t. Ez a folyamat exoterm vagy endoterm?
-
a nátrium-fém nitrogénnel reagálva nátrium-azidot (NaN3) állíthat elő 21,72 kj-os inhibitorral. Ez a folyamat exoterm vagy endoterm?
-
Rajzolj egy energiaszint diagramot a kémiai reakcióhoz a 8.gyakorlatban. (Lásd a 7.3.ábrán a “Reakcióenergia” példát.)
-
Rajzolj egy energiaszint diagramot a 9. gyakorlat kémiai reakciójára. (Lásd a 7.3.ábrán a “Reakcióenergia” példát.)
-
250 mL-es oldatban 0,25 mol KOH(aq) és 0,25 mol HNO3(aq) kombináljuk. Az oldat hőmérséklete 22,5 C-ról 35,9 C-ra emelkedik.tegyük fel, hogy az oldat sűrűsége és hőkapacitása megegyezik a vízzel. Mekkora a reakció hője, és mekkora a reakciónak a moláris bázison mért vesztesége?
-
600 mL-es oldatban, 0.50 mol Ca(OH)2(aq) és 0,50 mol H2SO4(aq) kombináljuk. Az oldat hőmérséklete 22,3 cc-kal nő. mekkora a reakció hője, és mekkora a reakció moláris alapon mért vesztesége? Tegyük fel, hogy az oldat sűrűsége és hőkapacitása megegyezik a vízzel.
-
400,0 g H2O melegítéséhez 0,050 mol etanolt (C2H5OH) égetünk el. A víz 24,6 C-ról 65,6 cc-ra melegszik. mekkora a reakció hője, és mekkora a reakció moláris alapon mért vesztesége?
-
100,0 g H2O melegítéséhez 0,066 mol méhviaszt égetünk el. A víz felmelegszik 21,4 C-ról 25,5 cc-ra. mekkora a reakció hője, és mekkora a reakció moláris alapon mért vesztesége?
Válaszokat
-
körülmények között állandó nyomás
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exoterm
-
endoterm
-
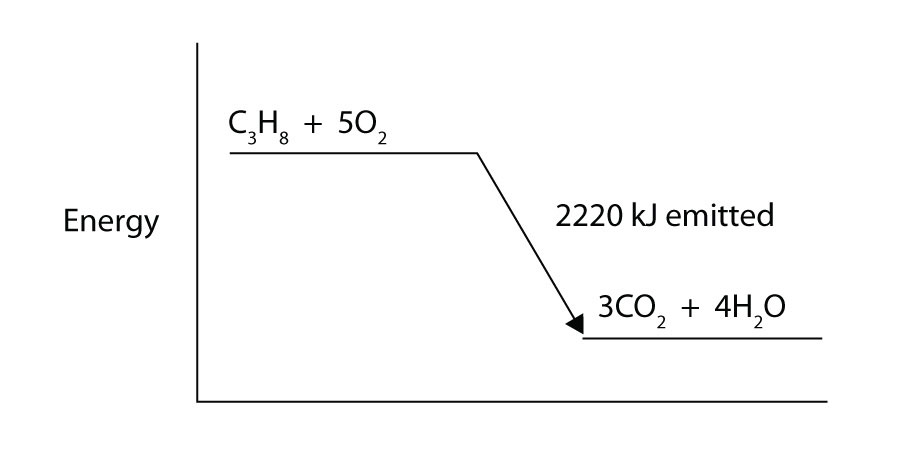
-
hő reakció = -14.0 kJ; A reakció hője = -68,6 kj; a reakció hője = -1,370 kJ/mol etanol
a reakció hője = -68,6 kj; a reakció hője = -1,370 kJ/mol etanol