vessen egy pillantást a legutóbbi cikkekre
absztrakt
az alacsony kimeneti szívelégtelenség (LoHF) a szívelégtelenség (HF) nem gyakori formája, de nagyon fejlett HF-t jelez. Baljós prognózissal, valamint jelentős morbiditással és mortalitással jár. A LoHF azonban továbbra is nagyrészt alulkutatott. A HF hagyományos leírása a pangásos szívelégtelenségre (CHF) összpontosított, amelyet alacsony szívteljesítmény jellemez, amelyet tüdő/perifériás torlódás kísér. Ez a hangsúly hozzájárult a lohf-betegek alulértékeléséhez, akiknek kevés vagy semmilyen bizonyítéka van a torlódásra. Ezenkívül a lohf-betegek nem rendelkeznek bizonyított terápiával, és a megfelelő kezelés kiválasztása az egyéni patofiziológiától és a mögöttes etiológiától függ. A lohf-betegek heterogén etiológiával és patofiziológiával rendelkeznek, kiemelve a klinikai jellemzők, a diagnózis és a klinikai kezelés mélyreható megértésének fontosságát, amely a jelen felülvizsgálat alapját képezi.
kulcsszavak
alacsony kimeneti szív szindróma, alacsony kimeneti szívelégtelenség, alacsony kimeneti állapot
Bevezetés
az orvosi és sebészeti terápiák figyelemre méltó fejlődése ellenére a szívelégtelenség (HF) hatékony kezelése továbbra is jelentős kihívásokat jelent az egészségügyi szolgáltatók számára. A kihívást a HF-hez kapcsolódó kórházi visszafogadások magas aránya, valamint a megnövekedett mortalitás és morbiditás tükrözi . A kihívás egy része nagyon heterogén etiológia, patofiziológia, valamint a HF különböző formáinak klinikai bemutatása, amelyekben egyes HF formák kevés klinikai vizsgálati adatot tartalmaznak, következésképpen korlátozott megértéssel rendelkeznek. Különösen a HF hagyományos leírása szinte szinonimája volt a pangásos szívelégtelenségnek (CHF), de a CHF kifejezés kizárja a HF betegek kisebbségét, akiknek alig vagy egyáltalán nincs kimutatható tünete a pulmonalis és/vagy perifériás torlódásnak . Az alacsony kimeneti HF (LoHF) szintén baljós prognózishoz kapcsolódik, és nagyon fejlett HF-t jelez. Ezenkívül a pangásos szívelégtelenség és a LoHF tüneti és patofiziológiai különbségei alátámasztják a különböző klinikai kezelési megközelítések szükségességét . E különbségek ellenére a hagyományos HF terápiákat a HF minden formájára általánosították, beleértve a CHF-et és a LoHF-et, ami klinikai igényt teremt a lohf patofiziológiájának, diagnózisának és klinikai kezelésének megértésére. Ebben a cikkben összesítjük a lohf-ről közzétett bizonyítékokat az epidemiológia, az etiológia, a patofiziológia, a diagnózis és a klinikai kezelés szempontjából. A cél a lohf klinikai állapotának ismereteinek megújítása, valamint a HF klinikai kezelésének javítása általában.
meghatározás
a szívelégtelenség egy komplex klinikai szindróma, amelyet strukturális és / vagy funkcionális myocardialis hibák jellemeznek, amelyek károsodott kamrai töltéshez vagy kilökődéshez vezetnek . A szindróma összetettsége heterogén osztályozásaiban nyilvánvaló: jobb -, bal-vagy bi-kamrai hibahely alapján; akut vagy krónikus a megjelenés ideje alapján; megőrzött, határvonalas vagy csökkentett ejekciós frakció a funkcionális állapot alapján; alacsony vagy magas kimenet a szívteljesítmény (CO) alapján, előre vagy hátra kudarc a véráramlás iránya alapján. Ezen osztályozások mindegyike jelentős a HF diagnosztizálása és kezelése szempontjából . A több osztályozás ellenére a CHF kifejezést hagyományosan felcserélhető módon használják a HF-vel, de ez nem írja le kellőképpen a lohf-et számos tüneti és patofiziológiai különbség miatt.
lohf, más néven alacsony CO akut dekompenzált HF-ben, a HF nagyélességű formáját írja le, amelyet csökkent előre CO jellemez (szívindex < 2.0 L/perc/m2 és szisztolés vérnyomás < 90 Hgmm) és szervvégi hypoperfúzió, tüdődugulásra alig vagy egyáltalán nem utaló jelekkel . A LoHF különbözik a CHF-től, amely a pulmonalis, illetve a dyspnoéhez, illetve a perifériás oedemához vezető perifériás torlódáshoz vezető csökkent CO által jellemzett HF-et írja le . Az Európai Kardiológiai Társaság (ESC) 2005-ös irányelvei a HF diagnózisáról és kezeléséről az alacsony szívteljesítmény szindrómától (LCOS) a lohf-en át a kardiogén sokkig terjedő folytonosságot javasolnak. Az ESC irányelvek a kardiogén sokkot a HF által kiváltott szöveti perfúzió bizonyítékaként határozzák meg az előterhelés korrekciója után, amelyet szisztolés BP jellemez < 90 Hgmm vagy az átlagos artériás nyomás csökkenése > 30 Hgmm; vizelet kimenet < 0,5 ml/kg/h; pulzusszám > 60 ütés / perc (BPM) torlódás bizonyítékával vagy anélkül . Az LCOS viszont gyakori a műtét utáni HF-ben szenvedő betegeknél, és úgy definiálják, hogy szükség van a műtét utáni intraortás ballonpumpára vagy inotrop támogatásra 30 percnél hosszabb ideig akut ellátásban .
Epidemiológia
a lohf pontos előfordulása és előfordulása az általános populációban teljesen ismeretlen. Jelenleg nincsenek a lohf-re jellemző populációalapú epidemiológiai adatok. Az egyetlen rendelkezésre álló adat egyközpontú klinikai vizsgálatokból származik, amelyek a szívműtéten átesett HF-betegek kiválasztott populációját vizsgálták. 1975-ben Parr et al. 25% – os incidenciáról számoltak be azoknál a gyermekeknél, akik szívműtéten estek át a csökkent CO alapján, amelyet CI < 2, 0 L/perc/m2-ként határoztak meg. Két évtizeddel később, Wernovsky et al. a műtét utáni LCO-k ugyanolyan előfordulási gyakoriságát mutatták ki azoknál a betegeknél, akiknél a műtét után 6-18 órán belül artériás kapcsoló műtét történt. A közelmúltban végzett klinikai vizsgálatok a prevalencia nagy eltéréséről számoltak be, 3,6% – ról (férfiak) és 5,9% – ról (nők) 9,1% – ra és 41% – ra, az incidencia pedig 14,7% volt . A közelmúltban hosszú távon (húsz év: 1990-2009) prospektív klinikai vizsgálat 25 176 egymást követő koszorúér-by-pass graft (CABG) műtéti beteg bevonásával, Algarni et al. számolt be a posztoperatív LCO-k prevalenciája jelentősen csökkent 9,1% – ról (1990-1994) 2,4% – ra (2005-2009) .
etiológia
a lohf etiológiája többtényezős. Általában ez a bal kamra (LV), a jobb kamra (RV) vagy a szisztémás kamra (egykamra anatómia) diszfunkció következménye, és magában foglalhatja a szisztolés és/vagy diasztolés diszfunkciót . A kamrai töltés vagy kilökődés zavarai LoHF-hez vezetnek, ami gyakori szövődmény azoknál a betegeknél, akik szívműtéten estek át vagy kardiogén sokkban vannak . Krónikus HF-ben szenvedő betegeknél akut állapotromlásként jelentkezhet, vagy átmeneti és reverzibilis epizód lehet az akut kiváltó ok megszűnésével. Ez egy klinikai szindróma, amelyet a szívműködést befolyásoló számos betegség végső útjának tekintnek. Nem elegendő a lohf diagnosztizálása, a kiváltó okot vagy kiváltó okot is meg kell határozni, és ha lehetséges, kezelni kell . Az 1. táblázat összefoglalja azokat az állapotokat, amelyek alacsony kimeneti állapotot okoznak HF-ben szenvedő betegeknél.
1. táblázat. Az alacsony kimeneti állapot etiológiája patofiziológia szerint
|
mechanizmusok |
okozati állapotok |
|
a szívizom kontraktilitásának elvesztése |
koszorúér-betegség, kardiomiopátia, szívizomgyulladás, dekompenzált krónikus HF, poszt-szívműtét, toxinok, táplálkozás (elhízás)m infiltratív betegségek, végstádiumú veseelégtelenség, Chagas-betegség vagy HIV-fertőzés |
|
károsodott kamrai töltés vagy kilökődés |
pericarditis, pericardialis folyadékgyülem, szívtamponád, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
a lohf patofiziológiájának jelenlegi megértése nagymértékben támaszkodik a műtét utáni CABG-betegeken végzett klinikai vizsgálatok bizonyítékaira. A kóros jellemző a túlzottan depressziós CO, amelyet a szerv végének hipoperfúziója kísér. Fiziológiailag a szív szivattyúként működik, hogy elegendő mennyiségben terjessze az oxigénezett vért a szövetek anyagcsere-igényeinek kielégítésére. Mivel a metabolikus szükségletek normál és stresszes helyzetekben változnak, a CO is változik, hogy kielégítse ezt a dinamikus igényt . A szívciklus diasztolés fázisa kritikus a LoHF-betegeknél, mivel a kamrai relaxáció során a koszorúér-töltés a szívizom oxigénellátását biztosítja . A pulzusszám (HR) szintén jelentős a diasztolában, mivel a túl gyors HR megakadályozza a szív teljes miokardiális relaxációját és perfúzióját. Így a szívműködési zavar strukturális (maradék szív anomália) vagy funkcionális szívbetegség (kamrai töltés vagy ürítés zavara vagy fokozott szisztémás érrendszeri ellenállás) következménye.
Patofiziológiailag a CO függ a HR-től és a stroke térfogatától (SV) (CO = HR * SV). A lökettérfogat viszont három egymással összefüggő keringési változó nettó szorzata: előterhelés, utóterhelés és kontraktilitás. Ha ezen összetevők közül egy vagy több károsodott, alacsony szívteljesítményű állapot alakulhat ki . Ezen túlmenően ezek az összetevők mind a szisztolés, mind a diasztolés fázisokat befolyásolják a szívciklus LV/RV szisztolés diszfunkciót és/vagy diasztolés diszfunkciót, más néven HF-t, tartósított ejekciós frakcióval (1.ábra). Más állapotok, mint például a szívbillentyű-betegség, a pulmonalis hypertonia (PH), a mechanikus szelep diszfunkció és a légzési elégtelenség kiválthatják vagy súlyosbíthatják a lohf kialakulását .
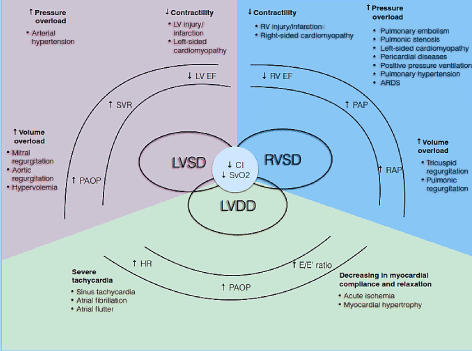
1.ábra. Az alacsony kibocsátású szívelégtelenség patofiziológiai mechanizmusai
gyakori okok és tipikus; a lohf tünetei szerepelnek. A lohf fő patofiziológiai mechanizmusai a kamrai diszfunkció: LV szisztolés és / vagy diasztolés dysfunctio és RV szisztolés dysfunctio, amelyek mindegyikének közös kóros jellemzői a csökkent cardialis index (CI) és a csökkent vegyes vénás oxigéntelítettség (SvO2). Az LV és RV szisztolés diszfunkció a megnövekedett nyomás-túlterhelés, a megnövekedett térfogat-túlterhelés és a csökkent kontraktilitás, míg az LV diasztolés diszfunkció súlyos tachycardia és csökkent myocardialis megfelelés és relaxáció eredménye. Adaptálva Lomivorotov et al. 2017, p. 293
LV ystolic diszfunkció
bal kamrai (LV) szisztolés diszfunkció (vagy depressziós LV ejekciós frakció ) a leggyakoribb patofiziológiai mechanizmus, amelyet LoHF betegeknél észleltek. Az LV szisztolés funkciót befolyásoló keringési változók az előterhelés, a terhelés után és a kontraktilitás . Általában az LV szisztolés diszfunkció a funkcionális cardiomyocyták veszteségének vagy csökkenésének következménye, amely a károsodott koszorúér-keringés és ischaemia, reperfúziós sérülés vagy a cardiomyocyta apoptosis kevésbé ismert természetes jelensége miatt bekövetkező nekrózis következtében alakul ki . A funkcionális cardiomyocyták elvesztése átmeneti lehet, amint azt a myocardialis kábítás során észlelték, amelyet életképes szívizomként határoztak meg, amelyet koronária reperfúzió mentett meg, amely a reperfúziót követően hosszan tartó ischaemiás diszfunkciót mutat . A funkcionális kardiomiocita elvesztése szintén refrakter lehet A visszafordításra olyan körülmények között, mint a fertőzés; tachycardia; szelepbetegség; anyagcserezavarok, például acidózis, hipoglikémia, hypocalcaemia; környezeti szív toxinoknak és vegyi anyagoknak való kitettség; idiopátiás dilatált kardiomiopátia (DCM); és genetikai rendellenességek, mint például a családi DCM, hipertrófiás kardiomiopátia és izomdisztrófiák . Az előterhelésre adott károsodott kardiális válasz drámai csökkenést okoz a CO és az oxigén szállításában más kulcsfontosságú szervekbe, emelkedett pitvari nyomás, kapilláris ék nyomás és kardiogén tüdőödéma. Bár az LV kompenzációs változásai viszonylag magas szisztémás artériás nyomáshoz alkalmazkodnak, az utóterhelés jelentős növekedése kiválthatja az LV szisztolés diszfunkcióját .
LV diasztolés diszfunkció
bár nem gyakori, a lohf kialakulhat LV diasztolés diszfunkcióban szenvedő betegeknél, megőrzött LVEF-vel. Az állapot abból adódik, hogy a kamrai kamra nem képes megfelelő mennyiségű vérrel feltölteni a normál előterhelés ellenére, ami diasztolés diszfunkcióként jelentkezik . Az olyan alapbetegségek, mint a súlyos tachycardia, a csökkent szívizom-megfelelés vagy a rendellenes kamrai relaxáció rontja az LV relaxációját és kitöltését a szívciklus diasztolés fázisában. Kardiomiocita szinten ezek az állapotok a citoszolból és a kalcium homeosztázisból történő kalciumeltávolítással, a kereszt-híd leválás megfelelőségével és a belső funkcionális citoszkeletális elem rendellenességgel járnak . A hídközi leválás hozzájárulhat a késleltetett izovolumikus relaxációs időhöz, ami csökkent LV lökettérfogatot eredményez, különösen magasabb HR esetén . Az LV relaxáció függ a szarkoplazmatikus retikuláris kalciumion újrafelvételétől és a nitrogén-monoxid jelzésétől is, ami szintén megkönnyíti a hídközi leválást. Mivel a hídközi leválás folyamata energiafogyasztó, a szívizom energiájának hiányát okozhatja, következésképpen lelassíthatja az LV szívizom relaxációját .
annak ellenére, hogy a diasztolés diszfunkció széles körben elterjedt jelenség a műtét utáni szívbetegek akár 70%-ánál , a diasztolés diszfunkció önmagában nem elegendő az akut HF kialakulásának magyarázatához. Más klinikai állapotok, például pitvarfibrilláció (Af), károsodott koszorúér-keringés és artériás hipertónia esetén a diasztolés diszfunkció dekompenzált állapotot eredményezhet, ezért úgy vélik, hogy ez a myocardialis ischaemia korai jele . Az LV diasztolés és szisztolés funkciók közötti dinamikus kapcsolat szintén hozzájárul a diasztolés diszfunkcióhoz LoHF betegeknél. Az inotrop katekolamin stimulálása mind a diasztolét, mind a szisztolét érinti, és fokozhatja a diasztolés diszfunkciót. A depressziós LVEF a végső szisztolés térfogat növekedéséhez vezet, és meghosszabbítja a szívciklus diasztolés fázisát .
RV diszfunkció
a LoHF-ben, különösen a koszorúér-műtét után, az RV diszfunkció fő patofiziológiai mechanizmusai közé tartozik a megnövekedett előterhelés, megnövekedett utóterhelés, károsodott jobb koszorúér perfúzió és csökkent kontraktilitás . A bal koszorúérrel ellentétben a jobb koszorúér perfúziója mind a diasztolé, mind a szisztolé során bekövetkezik. A PH jelenléte az RV nyomás növekedését okozza, ami a jobb koszorúér perfúziójának csökkenéséhez vezet, ami megmagyarázza az optimális bal és jobb koszorúér-keringés biztosításának fontosságát . A koszorúér-műtéten átesett betegeknél az RV diszfunkció mechanizmusok kombinációjának eredményeként alakulhat ki. A perioperatív RV ischaemia és az infarktus a károsodott RV kontraktilitás fő okai. Tricuspidalis vagy pulmonic regurgitation re gyakori oka a megnövekedett térfogat előterhelés, míg a bal oldali szelep betegség vagy kardiomiopátia, PH vagy tüdőembólia (PE), akut légzési distressz szindróma és a magas pozitív nyomású szellőzés gyakori oka a nyomás túlterhelés . Mivel az RV általában lehetővé teszi a pulmonalis érrendszer alacsony nyomású perfúzióját, nagyon érzékeny még a pulmonalis artériás nyomás (PAP) mérsékelt növekedésére is. Az RV meghibásodása kialakulhat a PH vagy a csökkent kontraktilitás beállításában, amely az RV dilatációjának gyors előrehaladásával jár, ami megnövekedett végdiasztolés RV nyomáshoz vezet . Ezek a fiziológiai változások a kamrai septum eltolódását okozhatják egy már alul töltött LV kamra felé, következésképpen az LV előterhelésének csökkenését és a CO csökkenését okozhatják .
kockázati tényezők
a Lohf kockázati tényezői továbbra is alul kutatott terület. A HF-en végzett klinikai vizsgálatokból és a műtét utáni LCOS-betegekből azonban kevés adat áll rendelkezésre értékes betekintést nyújt a lohf kockázati tényezőibe és előrejelzőibe. 452, dekompenzált HF-vel és alacsony szívteljesítménnyel kórházba került beteg analízisében a lohf jelentős kockázati tényezői a Chagas-kór (relatív kockázat : 3,66), a depressziós ejekciós frakció (RR: 2,41), a hyponatremia (RR: 1,62) és a veseműködési zavar (RR: 1,92) voltak . A műtét utáni lohf kockázati tényezői közé tartozik a károsodott LV funkció (< 50%), a pumpa CABG, sürgősségi vagy cardiopulmonalis bypass (CPB) műtét, hiányos revaszkularizáció, életkor > 65 év, valamint a diabetes mellitus és a műtét előtti veseműködési zavar együttes jelenléte . A betegek és az operáció kockázati tényezői mellett a lohf biokémiai prediktorai a műtét utáni betegekben az alacsony hemoglobinszintek , az összes lymphocytaszám < 2000 sejt/CBL , valamint a szérum natriuretikus peptidek műtét előtti szintje . Az elmúlt két évtizedben néhány elismert kockázati tényező trendjében változások történtek. Az olyan tényezők, mint a magas vérnyomás, a női nem, a hármas érbetegség és a bal fő betegség már nem statisztikailag szignifikánsak, míg a depressziós preoperatív ejekciós frakció kockázata megduplázódott .
diagnózis
nincs konszenzus Irányelvek vagy bizonyított diagnosztikai kritériumok a LoHF-betegek számára. Ezenkívül a klinikai tünetek nem specifikusak. Szabványosított Irányelvek hiányában a diagnózis általában a hemodinamikai és fiziológiai rendellenességek elfogadott gyűjteményére támaszkodik, amelyek hasznosak a lohf klinikai gyanújának felkeltésére . A lohf diagnosztizálása önmagában gyakran nem elegendő. Az alacsony kimeneti állapot okát is meg kell állapítani. Az alacsony kimeneti állapot egyes okaiban, például PE vagy MI, a kiváltó ok kezelése a legfontosabb szempont, ezért elengedhetetlen a diagnózis felállítása. Mivel a lohf-betegek gyakran instabilak, az is gyakori, hogy a klinikai értékelés, a diagnózis és a kezelés egyidejűleg fordul elő, sokkal inkább az akut ellátásban .
jelek és tünetek
alacsony szívteljesítmény, mint az akut dekompenzált HF bemutató jellemzője nem gyakori, a kórházi HF betegek mindössze 8,9-9,6% – át érinti . A LoHF számos klinikai jellemzőt oszthat meg a CHF-vel, de vannak figyelemre méltó különbségek, amelyek támogathatják vagy irányíthatják a későbbi diagnosztikai döntéseket. A túlzott fáradtság és a fokozott testmozgás intolerancia fontos kezdeti jelek, amelyeket a lohf-betegek már a diagnózis előtt észrevettek . Ezenkívül a lohf-betegeknél gyakran fordul elő izgatottság, zavartság és/vagy csökkent tudatszint; hideg/érszűkületes perifériák vagy késleltetett kapilláris utántöltési idő; hypotonia; tachycardia vagy bradycardia; gyenge pulzus; emelkedett jugularis vénás nyomás; légszomj és hypoxaemia; és oliguria/anuria . Ezek a jelek és tünetek eltérhetnek az alacsony perfúzió és a torlódás között HF-ben szenvedő betegeknél (2.táblázat).
2. táblázat. Az alacsony perfúzió tünetei és jelei vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: A HF diagnózisára és kezelésére vonatkozó 2016-os ESC-irányelvek hangsúlyozzák a részletes betegtörténet és a fizikális vizsgálat megszerzésének fontosságát minden olyan betegnél, akinek gyanúja van a HF-ről . A beteg részletes kórtörténetének, vagy rokonának és barátainak, ha a beteg túl rosszul van, a tünetekre, a korábbi és jelenlegi szív-és extraszív állapotokra, a HF vagy az alacsony kimeneti állapot kockázati tényezőinek való kitettségre, valamint a korábbi és jelenlegi orvosi állapotok gyógyszertörténetére kell összpontosítania . A beteg anamnézisén kívül minden lohf-beteg számára ajánlott fizikális vizsgálat a hemodinamikai, perifériás perfúzió, torlódás, a mögöttes etiológia és a szeleppatológia klinikai mutatóinak felmérése céljából. Az érdeklődésre számot tartó hemodinamikai paraméterek közé tartozik a vérnyomás, a HR és a szívritmus, a galopp ritmus, az oxigéntelítettség és a légzési sebesség . A perifériás perfúziós vizsgálatoknak magukban kell foglalniuk a tudatszintet, a perifériás bőr/központi hőmérsékletet, a kapilláris újratöltési időt és a vizeletürítést. A torlódási vizsgálatok közé tartozik az emelkedett jugularis vénás nyomás, perifériás / pulmonalis oedema, hepatomegalia, ascites és pleuralis folyadékgyülem. Az alapul szolgáló etiológiára vonatkozó vizsgálatoknak magukban kell foglalniuk a szív-és érrendszeri vizsgálatot, valamint a szívhangot és a zörejeket. Végül a szelep diszfunkciójának bizonyítékának tartalmaznia kell a pericardialis dörzsölést, valamint a pericardialis folyadékgyülem bizonyítékát szív tamponáddal vagy anélkül .
az anamnézis és a fizikális vizsgálat kombinációja felbecsülhetetlen értékűnek bizonyult a hemodinamikai állapot értékelésében és a LoHF felismerésében . 1976-ban Forrester et al. akut myocardialis infarctusban szenvedő betegek fizikális vizsgálata és négy hemodinamikai profil (a, B, L és C) azonosítása a 2.ábrán látható módon. A hemodinamikai profilok a pulmonalis torlódás (pulmonalis kapilláris éknyomás > vagy 18 Hgmm) és a perfúzió megfelelőségén (CI > 2,2 L/perc/m2) alapulnak. Az a profil nem jelent torlódást/hipoperfúziót; A B profil torlódást hipoperfúzió nélkül; a C profil hipoperfúziót torlódás nélkül; és az L profil torlódást és hipoperfúziót . A lohf-betegek az L és a C profil alá tartoznak(hypoperfusion xhamster torlódás Nohria et al. igazolása annak, hogy az L és C profil átlagos CI-értéke 1,6 L/perc/m2, illetve 1,9 L/perc/m2.
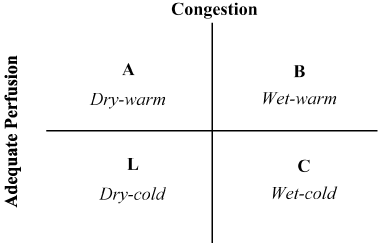
2. ábra. Az akut dekompenzált szívelégtelenség klinikai profiljának vázlatos bemutatása
a torlódást orthopnoe, jugularis vénás distensio, pulmonalis rales, hepatojugularis reflux, ascites, perifériás oedema, hasi reflux és Valsalva négyzethullám jelenléte alapján értékelik. Az alacsony perfúziót szűk pulzusnyomás, pulzusváltozások, hideg végtagok, esetleg álmosság, csökkenő szérum nátriumszint és romló vesefunkció alapján értékelték. Nohria-tól adaptálva, et al.
elektrokardiogram (EKG): mind az AHA, mind az ESC HF-re vonatkozó irányelvei azt javasolják, hogy az elektrokardiogramot (EKG) a lehető leghamarabb el kell végezni minden HF-gyanús betegnél. Az EKG számos rendellenességet mutathat, és nagyon valószínűtlen, hogy normális lenne a HF-ben szenvedő betegeknél. Bizonyítékkal szolgálhat továbbá a cardialis dysfunctio mögöttes etiológiájára, beleértve a bradycardiát, az atrioventricularis blokkot, a sinus tachycardiát, a pitvari vagy ventricularis tachyarrhythmiát, az ischaemiát, az LV hypertrophiát és az alacsony feszültségű komplexeket .
alapvető laboratóriumi vizsgálatok: az AHA és az ESC HF irányelvek a kezdeti klinikai értékelés során alapvető laboratóriumi vizsgálatokat is javasolnak a HF vagy az alacsony kimeneti állapot okának diagnosztizálására. Minden gyanús HF-ben szenvedő betegnél vérvizsgálatot kell végezni. Haemoglobin (Hb > 10 g/dL) a szövetekbe történő optimális oxigénszállítást jelzi), a krónikus HF-ben gyakori a krónikus anaemia, és a jelentősen megnövekedett fehérvérsejtek felvetik az alternatív diagnózis gyanúját. Szérum elektrolit vizsgálatok a kálium, magnézium és kalcium szintjének meghatározására. Karbamid és kreatinin tesztek a vese hypoperfúziójának és a HF-ben gyakori diszfunkciójának értékelésére. A károsodott májfunkcióra vonatkozó vizsgálatok, amelyek a RV és/vagy a máj torlódására utalnak. Glükózteszt a szívműködést károsító hypoglykaemia kimutatására. Pajzsmirigy funkció tesztek hipo-vagy hiper-tiroidizmusra, amely belső miokardiális infarktust okozhat. Végül a szérum natriuretikus peptidek tesztjei, amelyek emelkedett szintje megnövekedett kamrai falfeszültséget jelez, de hosszú felezési idejük miatt nem érzékeli a kamrai töltési nyomás hirtelen változásait .
szív képalkotó vizsgálatok: a szív képalkotás központi szerepet játszik a HF diagnózisában, valamint a monitorozásban és a terápia irányításában. Az echokardiográfia az előnyben részesített módszer a pontosság, a rendelkezésre állás, a biztonság és a költséghatékonyság érdekében . Kiegészíthető más képalkotó módszerekkel, amelyeket a specifikus klinikai kérdések megválaszolásának képessége alapján választanak ki, figyelembe véve az ellenjavallatokat és a kockázatokat .
echokardiográfia: az echokardiográfia erősen ajánlott minden gyanús beteg számára, mivel képes megerősíteni vagy kizárni a lohf klinikai diagnózisát, felmérni az SV-t és annak variációit, valamint meghatározni az alacsony kimeneti állapot okát . Az alacsony szívteljesítmény klinikai diagnózisát követően a transthoracalis echokardiográfiát a lehető leghamarabb el kell végezni. Nemcsak a szisztolés és diasztolés diszfunkció mértékét méri, hanem értékes információkat nyújt a kamrai morfológiáról, a szelep diszfunkciójáról, a szívizom-és perikardiális betegségről és a regionális falmozgási rendellenességekről is . Az echokardiográfia a szisztolés funkciót a LEVF mérésével értékeli, ahol> 45-50% normálisnak tekinthető. Másrészt a diasztolés funkciót a mitrális áramlási minták, a tüdővénás áramlás és a szöveti Doppler segítségével értékelik a mitrális gyűrűn, míg a CO és az SV-t a Doppler-elv alapján értékelik. A pulmonalis artériás nyomás (PAP) a regurgitate sugársebesség mérésével becsülhető meg. Magas PAP tágult RV jelenlétében, septum ellapítással vagy meghajlással az LV-be, jelezve az RV nyomás akut növekedését, amely növeli a PE klinikai gyanúját, mint az alacsony kimeneti állapot okát .
mellkasröntgen: Lohf-gyanús betegeknél mérlegelni lehet a mellkasröntgen-vizsgálatot. Az értékeléshez figyelembe veendő fontos mutatók közé tartozik a megnagyobbodott szív, amely kardiomegáliát vagy LV hipertrófiát jelez; pulmonalis vénás torlódás, amely emelkedett LV töltési nyomást jelez; pleurális folyadékgyülem, amely emelkedett LV nyomást, tüdőembóliát vagy szívműtétet jelez (.
coronaria angiográfia: a lohf-ben szenvedő betegeknél a coronaria angiográfia indikációinak összhangban kell lenniük a HF-re vonatkozó konszenzusos Irányelvek ajánlásával . Azoknál a HF-es betegeknél, akiknél mellkasi fájdalom és St-elevation myocardialis infarctus (STEMI) jelei mutatkoznak az EKG-n, a lehető leghamarabb el kell végezni a revaszkularizációt primer perkután coronaria beavatkozással. A szívkoszorúér angiográfiát olyan betegeknél is mérlegelni kell, akiknél ischaemiás etiológiájú poszt-szívmegállás áll fenn, ha HF-re utaló jelek vannak, valamint olyan betegeknél, akik felépültek az alacsony kimeneti állapotból, amikor az okot nem határozták meg .
klinikai kezelés
a LoHF jelenléte nagyon magas kockázatú állapotot jelent, amely azonnali kezelést igényel, de hiányzik a klinikai kezelésre vonatkozó szabványosított Irányelvek . Következésképpen a klinikusok általában az egyéni patofiziológiát veszik figyelembe a legmegfelelőbb kezelési stratégia kiválasztásához . Akut lohf betegeknél a 2016 .évi ESC HF Irányelvek hemodinamikai profilok használatát javasolják (a torlódás jelenléte vagy hiánya, valamint a perfúzió megfelelősége alapján) a klinikai kezelés irányításához. Az L profilban (nincs torlódás, de hipoperfúzió) és a C profilban (mind a torlódás, mind a hipoperfúzió) szenvedő betegek esetében, akik akut dekompenzációs állapotban vannak, a sürgősségi kezelési célok magukban foglalhatják a betegek újraélesztését, az oxigénellátás helyreállítását, a szerv perfúziójának javítását és a hemodinamikai (stroke volumen és CO) optimalizálását, valamint a tünetek megoldását. További további célok közé tartozik az optimális monitorozás és az alacsony szívteljesítmény kiváltó okának megállapítása, valamint az ok kezelése, ha visszafordítható . Jelenleg a lohf elérhető terápiás céljai a szövetek oxigénellátásának optimalizálása, a keringés stabilizálása és az alacsony kimeneti állapot reverzibilis okainak kezelése (3.ábra).
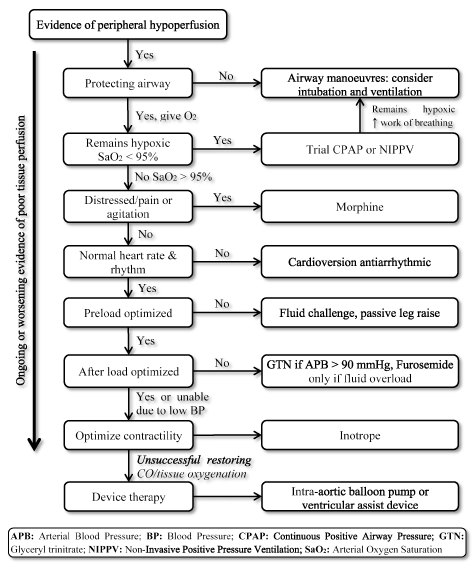
3.ábra. Kezelési algoritmus alacsony kimeneti szívelégtelenség
Lohf célok kezelése javítja a szövetek oxigénellátását és stabilizálja a keringést a szöveti perfúzió folyamatos vagy súlyosbodó tünete alapján. A kezelés a szellőzés javításával kezdődik nagy áramlású oxigén, folyamatos pozitív légúti nyomás (CPAP) vagy nem invazív pozitív nyomású szellőzés (NIPPV) alkalmazásával. Ha nem sikerül, kardioverzió vagy antiaritmiás gyógyszereket adnak a pulzusszám normalizálására, folyadék kihívás az előterhelés optimalizálására, és / vagy értágítók és inotropok a kontraktilitás manipulálására és javítására. Ha a korábbi szellőztetés és gyógyszeres kezelés sikertelen a szívteljesítmény és/vagy a szövetek oxigénellátásának helyreállításában, akkor az aortán belüli ballonpumpa vagy kamrai segédeszközök alkalmazásával végzett eszközterápia megfontolható
optimalizálja a szövetek oxigénellátását (lélegeztetési stratégiák)
a Lohf-betegek klinikai kezelése gyakran a légutak, a légzés és a keringés értékelésével kezdődik a perifériás hypoperfúzió bizonyítéka érdekében. A lélegeztetőgép-stratégiák, például az oropharyngealis vagy a nasopharyngealis légutak gyakori kiegészítők, amelyeket a légutak átjárhatóságának helyreállítására vagy fenntartására használnak lohf-betegeknél csökkent tudatszint a csökkent agyi perfúzió miatt. További endotracheális intubációt kell fontolóra venni, ha a beteg továbbra is beszűkült légutakkal rendelkezik . Ha a betegek továbbra is hipoxiásak maradnak (SaO2 < 95%), az oxigénellátás maximalizálása nagy áramlású oxigén alkalmazásával, folyamatos pozitív légúti nyomás (CPAP) vagy nem invazív pozitív nyomású szellőzés (NIPPV) mérlegelhető. Azoknál a betegeknél, akiknél nincs javulás, megfontolandó az intubáció vagy a szellőzés .
stabilizálja a keringést
a szívteljesítmény (CO) A HR és SV függvénye. Az SV viszont négy keringési változótól függ-pulzusszám, előterhelés, kontraktilitás és utóterhelés. Mindezen változók optimalizálása javítja a CO-t LoHF betegeknél . Klinikai körülmények között a CO növelésére irányuló stratégiák a kiváltó októl és az érintett keringési változótól függenek . A klinikai beavatkozások közé tartozik a térfogat beállítása, a farmakológiai támogatás és az eszközterápia.
pulzusszám / ritmus: A test fiziológiai válaszának részeként a növekvő HR növeli a CO-t. A túl gyors vagy lassú HR káros hatással van a CO-ra. Lohf tachycardia (túl gyors nyugalmi HR > 100 bpm) szenvedő, szorongó, nyugtalan és dyspnoeás betegeknél a morfin adható a dyspnoe, a fájdalom és az izgatottság enyhítésére, valamint enyhe venodilatátor az utóterhelés csökkentésére, különösen CPAP vagy NIPPV betegeknél . Ha HR < 40 bpm hemodinamikai kompromisszum és/vagy co-károsodás bizonyítékával, a HR-t növelő gyógyszereket (atropin és antikolinerg szerek ) vagy olyan beavatkozásokat kell végezni, mint a transzkután/transzvénás ingerlés. Sürgős elektromos kardioverziót kell mérlegelni a kiválasztott lohf-ben kamrai/szupraventrikuláris tachycardia vagy gyors AF esetén, kardiovaszkuláris kompromisszum bizonyítékával .
optimalizálja az előterhelést( Volume adjustments): az előterhelés mérése elengedhetetlen az optimalizáláshoz. Olyan betegeknél ajánlott, akiknél klinikai bizonyíték van a perifériás perfúzió károsodására. Az előterhelésre adott reakcióképesség felmérése érdekében folyadékvizsgálatot kell végezni. 250 ml folyadék (crystalloid vagy kolloid) gyors infúziója több mint öt percig, és objektíven értékeli az SV-re gyakorolt hatást. Ha a hatás növekedése vagy csökkenése > 10%, a betegnek folytatnia kell a folyékony bolusokat az előterhelés optimalizálása érdekében, amíg azok már nem reagálnak a folyadékra . Azoknál a betegeknél, akiknél torlódás és tüdőödéma jelei vannak, akiknek nincs szükségük folyékony bolusra, passzív lábemelés végezhető – a beteg lábát 45 fokra emelve, hogy kizárják a folyadék kihívás szükségességét. Ha a válasz kedvező, akkor valódi folyadék kihívás adható .
manipulálni az utóterhelést (farmakológiai támogatás): az utóterhelés az az ellenállás, amely ellen a kamra vért bocsát ki, időnként SVR-ként becsülve. Az utóterhelést csökkenteni kell azoknál a lohf-betegeknél, akiknél magas utóterhelés, alacsony CO, gyenge perifériás perfúzió és tüdőödéma áll fenn. Vazodilatátorokat alkalmazó farmakológiai támogatást kell adni a szisztolés BP-ben szenvedő lohf-betegeknek 110 Hgmm. Azoknál a betegeknél, akiknek szisztolés BP < 90 Hgmm és átlagos artériás nyomás < 65 Hgmm, az értágítók nem ajánlottak a hipotenzió kockázata miatt, ami megnehezítheti a szerv perfúzióját. Ezekben a betegekben az inotropok ajánlottak a kezelés első soraként .
javítja a kontraktilitást (farmakológiai támogatás): Ha a beteg a szívfrekvencia, az előterhelés és az utóterhelés beavatkozása ellenére továbbra is fennáll a szöveti hipoperfúzió vagy a csökkent oxigénszállítás bizonyítéka, mérlegelni kell a kontraktilitás javítását célzó kezelést. Eközben folytatni kell az oxigénszállítás optimalizálását a 10 g/dl hemoglobin cél elérése és az optimális oxigéntelítettség (SaO2) biztosítása érdekében. A myocardialis kontraktilitást hátrányosan befolyásoló tényezők a hyperkalaemia, hypomagnesemia, hypocalcaemia, súlyos acidosis, hypoxia és hypoglykaemia, amelyeket korrigálni kell. Inotropok ajánlottak a kontraktilitás, majd a CO javítására alacsony BP-vel és/vagy alacsony CI-vel rendelkező lohf-betegeknél a gyenge perifériás perfúzió vagy torlódás jeleinek jelenlétében . A dobutamint (inotróp) alkalmazó farmakológiai támogatást azonban óvatosan kell alkalmazni tachycardiában vagy AF-ben szenvedő betegeknél, mivel ez növeli az AV csomópont vezetőképességét és gyors kamrai ritmusokat válthat ki . Másrészt a levosimendan ajánlott akut myocardialis ischaemiás vagy szívműtét utáni LoHF-betegeknél, mivel nem növeli a szívizom oxigénigényét . Az inotropok hosszú távú hatása káros lehet, ezért használatukat a stabilitás elérése után le kell állítani. A vazopresszorok nem lehetnek az első vonalbeli gyógyszerek alacsony kimeneti állapotokban, mivel növelik az SVR-t, majd károsítják a CO-t. Azonban a vazopresszorok és az inotróp kettős kezelése ajánlott azoknál a betegeknél, akiknél a szepszis az alacsony kimeneti állapot kiváltó oka .
Eszközterápia: Lohf-ben szenvedő betegeknél mérlegelni kell az eszközkezelést, ha az optimális orvosi kezelés sikertelen volt a CO és a szövetek oxigénellátásának helyreállításában. A gyakori eszközterápiák közé tartozik az intra-aorta ballon pumpa (IABP) és a ventricularis assist device (VAD). Az IABP alkalmazása gyakori az iszkémiás szívbetegségben szenvedő lohf betegeknél, perkután beavatkozás előtt vagy után, vagy szívműtét után. Az IABP egy ballonból áll, amelyet az aortába helyeznek a femorális artérián keresztül. A ballon a diasztolé alatt felfújódik, a szisztolé alatt pedig leereszkedik, hogy növelje a diasztolés BP-t és következésképpen a koszorúér perfúzióját, és csökkenti az utóterhelést, ezáltal növelve a CO-t . Másrészt a VAD használata ritka. Csak speciális központokban használható. Gyakran használják hídként szívátültetés kedvező életminőségű betegeknél vagy gyógyuláshoz akut szívizomgyulladásban szenvedő betegeknél .
a mögöttes okok kezelése
a lohf-ben szenvedő betegek alacsony kimeneti állapotának néhány oka specifikus terápiákkal megfordítható. A reverzibilis okokat a kezdeti klinikai értékelés korai szakaszában kell azonosítani. Ezek az okok közé tartozik az akut miokardiális infarktus, szívtamponád, feszültség pneumothorax, tüdőembólia, akut szelephiba . (3. táblázat).
A diagnózis és a klinikai kezelés Meta-analízise
a lohf klinikai diagnózisának alapja az LV/RV szisztolés diszfunkció és/vagy LV diasztolés diszfunkció echokardiográfiás bizonyítéka, melyet a csökkent CO és SvO2 bizonyított . A torlódás és a perfúzió mérésén alapuló hemodinamikai profilokat használták az akut HF betegek négy profilba történő osztályozására: száraz-meleg (a), nedves-meleg (B), száraz-hideg (L) és nedves-hideg (C), és hasznos a lohf betegek azonosításában . A lohf-betegeket L) és C) profilokba sorolták a torlódás jelenléte/hiánya és/vagy a perifériás perfúzió elégtelensége alapján . Ez a két hemodinamikai profil képezte az alapot a lohf-ben szenvedő betegek kiválasztásához a klinikai vizsgálatokban, valamint egyszerű ágy melletti értékelést nyújt a betegek osztályozásához a bemutatás idején, valamint a kezdeti terápiák kiválasztásának irányításához . A jelen metaanalízis célja, hogy összesítse a lohf-ben szenvedő betegek közös diagnosztikai jellemzőinek és kezelési eredményeinek publikált bizonyítékait.
keresési stratégia
három fő online adatbázist (PubMed, EMBASE és Cochrane) szisztematikusan kerestek a kezdetektől 2018 decemberéig a lohf diagnózisát és klinikai kezelését vizsgáló tanulmányok céljából. Annak elkerülése érdekében, hogy figyelmen kívül hagyják azokat a tanulmányokat, amelyek nem említették a lohf-et a címben vagy az absztraktban, az első 200 relevanciával rangsorolt cikket, amelyeket teljes szövegű Google Scholar kereséssel töltöttek be. Nincs közzétételi idő vagy nyelvi korlátozás. További vizsgálatokat azonosítottak a referenciák listájának kézi keresésével a mellékelt tanulmányokból, valamint a vonatkozó áttekintő cikkekből, amelyekre aztán a felvételi kritériumok vonatkoztak. A keresési kritériumok között szerepelt az érdeklődésre számot tartó populáció (lohf-ben vagy LCOS-ban szenvedő betegek), az érdeklődésre számot tartó diagnosztikai tesztek (echokardiográfia és hemodinamikai profilok), valamint az érdeklődésre számot tartó beavatkozás (lélegeztető stratégiák, térfogatbeállítás, farmakológiai támogatás és eszközterápia). A vizsgálatokat akkor vonták be, ha azok megfelelnek a következő kritériumoknak: a) lohf-ben szenvedő betegek; (b) echokardiográfiával és hemodinamikai profilokkal diagnosztizálták; (c) kezelt betegek hemodinamikai stabilizáció céljából; és (d) jelentett kezelési eredmények. Azokban az esetekben, amikor a vizsgálatok ismétlődő adatokat jelentettek, csak azt a vizsgálatot vették figyelembe, amely a legtöbb beteget szolgáltatta. A konferencia kivonatait, esettanulmányait és áttekintő cikkeit kizárták.
vizsgálat kiválasztása
A 4.ábra szemlélteti a támogatható vizsgálatokhoz használt keresési és szűrési eljárást. Két recenzens egymástól függetlenül átvizsgálta a szisztematikus online Keresésből származó összes címet és kivonatot. A teljes szövegű kereséshez absztraktokat tartalmaztak, amelyek magukban foglalták a népességet, a beavatkozást és az érdekes eredményeket. Ezt követően a két recenzens önállóan is áttekintette a teljes szövegű cikkeket a felvételi kritériumok alapján. Ellentmondás esetén vita és konszenzus útján oldották meg.

4.ábra. Az irodalomkeresési és befogadási folyamat folyamatábrája
adatgyűjtés
két értékelő egymástól függetlenül vett ki adatokat a mellékelt vizsgálatokból, és az esetleges eltéréseket konszenzussal oldották meg. A kivont fő adatok az echokardiográfiás és hemodinamikai profiladatok, valamint az alkalmazott kezelés és a kezelés eredménye a hemodinamikai (cardialis index, PCWP) és mortalitás tekintetében. E fő adatokon kívül a két véleményező a vizsgálat jellemzőire, a betegek jellemzőire és a követés időtartamára vonatkozó adatokat is begyűjtött (4.táblázat).
statisztikai elemzés
egynél több vizsgálatban jelentett érdekes eredmények a szívindex, a PCWP és a mortalitás. Az egyes kimenetelek esetében az intervenció előtti és utáni összefoglaló statisztikákat (átlagok), illetve a kiindulási és a kezelés utáni különbséget vonták ki. Ezeket az összefoglaló statisztikákat külön-külön vonták ki a kezelésre és a kontroll/placebo csoportokra vonatkozóan. A diagnosztikai eredményeket és a kezelési hatásokat az intervenció előtti és utáni átlagkülönbséggel, valamint az ehhez kapcsolódó 95% – os konfidencia intervallummal mérték. Erdei parcellákat használtunk a heterogenitás (I2) vizuális vizsgálatára a vizsgálatok során. Az összesített diagnosztikai és kezelési hatást és a kapcsolódó 95% – os konfidencia intervallumot fix hatás (I2 < 49%) vagy random effect modell (I2 > 50%) alkalmazásával becsülték meg. P-érték> 0,05 statisztikailag szignifikánsnak tekinthető.
eredmények
vizsgálati jellemzők
tizenkét (12) randomizált kontrollos vizsgálat (RCT) teljesítette a felvételi kritériumokat. Hét (7) vizsgálatba vontak be LoHF-betegeket, a fennmaradó öt (5) pedig alacsony szívteljesítményű szívműtéten átesett HF-betegeket. A közzétett klinikai vizsgálatok többsége (10) olyan gyógyszereket vizsgált , amelyek összehasonlították a különböző típusú inotropok hemodinamikai és halálmegelőzési hatását: csak dobutamint , dobutamint és dopamint ; levosimendánt és dobutamint, valamint levosimendánt és placebót . A fennmaradó két klinikai vizsgálat közül mindegyik vasodilatátort (nitroprussid) és placebót , valamint eszközterápiát (iabp) és inotrópot (levosimendan) vizsgált önmagában vagy iapb-vel kombinálva . A 12 klinikai vizsgálatba összesen 3738 beteget vontak be, átlagéletkoruk 64 év (tartomány = 55-74 év), többségük férfi (78%).
az eredmények szintézise
a Lohf diagnosztikai adatai következetlenek voltak. A tizenkét klinikai vizsgálat során nem merült fel a LoHF közös meghatározása, amely hasznos lett volna a diagnózis irányításához. A vizsgálatokba bevont betegek hemodinamikai kritériumai a következők voltak: CI < 2,0 L/perc/m2 , CI < 2,2 L/perc/m2 vagy CI < 2,5 L/perc/m2 és PCWP > 15 Hgmm vagy 18 Hgmm . A meghatározás a vizsgálatok között is változott – műtét utáni állapot hipotenzióval (szisztolés BP < 90 Hgmm a > 30 perc), vagy inotrop támogatás szükségessége a szisztolés BP fenntartásához > 90 Hgmm és a szervvégi hipoperfúzió (hideg perifériák, vizeletmennyiség < 30 ml/óra) . A kardiogén sokkot komplex szindrómaként írták le, amely magában foglalja az akut LV diszfunkció kaszkádját, csökkent CO-t, hipotenziót és szöveti hipoperfúziót .
az 5.és a 6. ábra a szívindex standardizált átlagát mutatja a kiindulási, illetve az inotróp vagy értágító kezelést követően. A kiindulási cardialis index az 1,93-as átlagról (95%-os CI: 1,91-1,95) a kezelés utáni 2,82-es átlagra (95% – os CI: 2,80-2,84) emelkedett. A 7.ábra a levosimendánnal és dobutaminnal végzett kezelés után a szívindex standard átlagos különbségének (SMD) erdőtábláját mutatja. A Levosimendan magasabb szívindexet ér el a dobutaminhoz képest (SMD: 2,82; 95% CI: 2,54-3,10). Posztoperatív betegeknél a lohf elleni profilaktikus hatásként az anesztézia utáni levosimendan infúzió magasabb kardiális indexet (2, 57) ért el a műtét előtti IABP-hez (2, 3) vagy a levosimendan kombinációjához képest (2, 4). A 8. ábra a levosimendan és a placebo közötti halálozási arányt mutatja. A levozimendán halálozási aránya alacsonyabb volt a placebóhoz képest (esélyhányados : 0,83; 95%-os CI: 0,59-1,18), de a különbség statisztikailag nem volt szignifikáns (p=0,30). Végső, a 9. ábra továbbá azt mutatja, hogy a Levosimendán halálozási aránya alacsonyabb a dobutaminhoz képest (OR: 0,65; 95% CI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
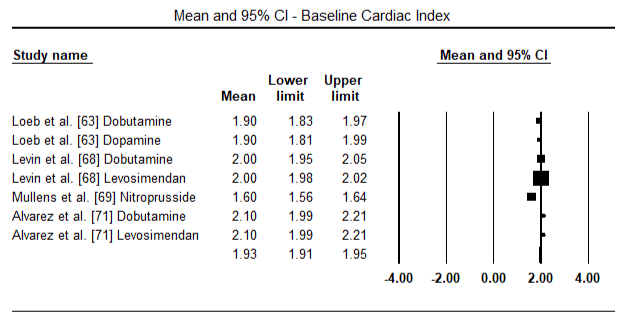
Figure 5. Mean baseline cardiac index
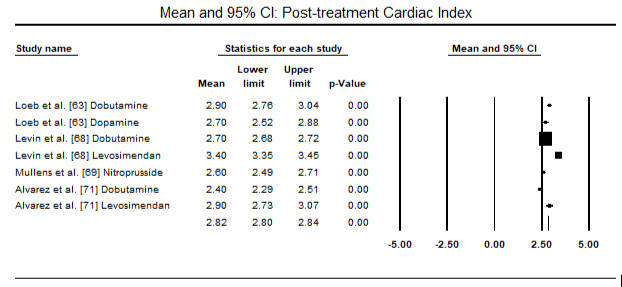
Figure 6. Mean post-treatment cardiac index
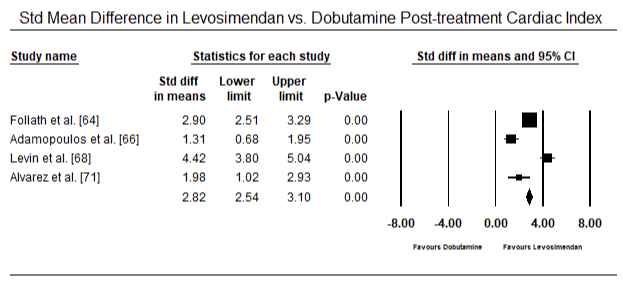
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
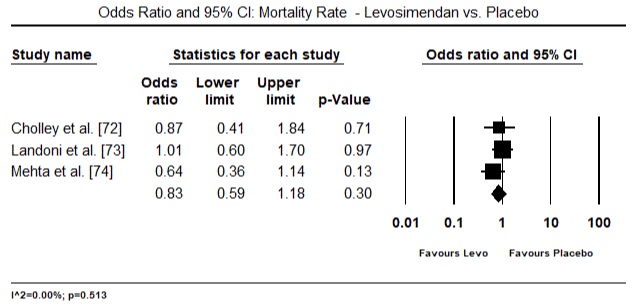
Figure 8. Mortality rate between levosimendan and placebo
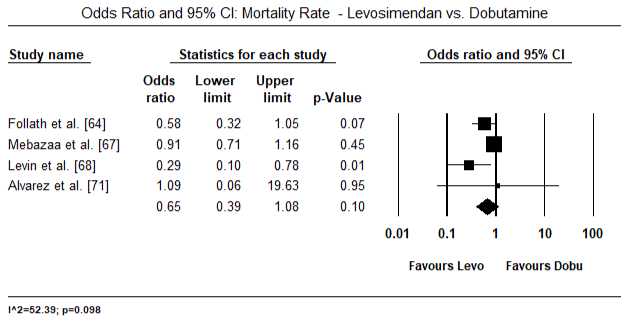
Figure 9. A levoszimendán és a dobutamin közötti halálozási arány
A megállapítások megvitatása
Ez a szisztematikus áttekintés és metaanalízis a lohf-betegek orvosi és eszközterápiájának (iabp) közös diagnosztikai jellemzőit és kezelési eredményeit értékelte. Az eredmények azt mutatják, hogy a lohf-betegek nem rendelkeznek széles körben elfogadott vagy szabványosított diagnosztikai jellemzőkkel. Bár a lohf-betegek számos jellemzőt mutathatnak, beleértve a szívindexet, a PCWP-t, a szisztolés BP-t és az SvO2-t, hogy javasolják vagy támogassák a klinikai diagnózist, ezek a jellemzők Különböző határértékekkel rendelkeznek a vizsgálatok során. A szívindex, amely a lohf-ben az alacsony kimeneti állapotot igazoló leggyakoribb klinikai jellemző, három határértékkel rendelkezik: < 2,0 L/perc/m2 , < 2,2 L/perc/m2 vagy < 2,5 L/perc/m2 . Az inotrop támogatás nagyon gyakori beavatkozásként jelent meg a perfúzió javítására és a szívteljesítmény normalizálására LoHF betegeknél.
az inotrop gyógyszerek, mint például a levozimendán, dobutamin, dopamin, értágító (nitroprusszid) és IABP jelentősen javították a CI-t a kezelés megkezdése és a kezelés után. Az inotropok tekintetében a levosimendan hatékonyabb a hemodinamikai stabilitás javításában és jobb profilaktikus a rövid távú halálozás (30 napos halálozás) ellen, mint a dobutamin. Ezenkívül az inotropok profilaktikusan működhetnek a műtét utáni LoHF kialakulása ellen. Másrészt, míg az inotrópok javítják a hemodinamikát és normalizálják a szívteljesítményt, nem nyújtanak szignifikánsan jobb védelmet a halálozás ellen, függetlenül az alkalmazott inotróp típusától.
az inotropok szerepét a lohf kezelésében az inotrop szerek és az értágító stratégiák korábbi áttekintése támasztotta alá a kardiogén sokk és az LCOS kezelésére . A felülvizsgálat szerint az inotropok javítják a hemodinamikát, a posztoperatív LCO-k nemkívánatos eseményeit és csökkentik a mortalitást. Újabb inotropok, mint a levosimendan (kalcium szenzibilizáló és inodilatátor) egy pozitív inotróp van néhány értágító tulajdonságait . Szelektív máj értágítónak is tekinthető, amely javíthatja a portális vénás áramlást a máj artérián keresztül és a portális vénás áramlást a dobutaminhoz képest, amely csak a portális vénás áramlást javíthatja a máj artériájának értágítása nélkül . A Levosimendan szintén nem növeli a szívizom oxigénigényét, és a dobutamin felett ajánlott akut myocardialis ischaemiás vagy szívműtét utáni LoHF betegeknél . A műtét utáni LoHF esetében az inotropok védő hatása a rövid távú halálozási arány (30 napos halálozás) ellen továbbra is jelentéktelen a placebóhoz képest .
a jelenlegi szisztematikus áttekintésnek és metaanalízisnek van néhány fontos korlátja. Lohf előfordulhat másodlagos mögöttes szívbetegség, mint például akut miokardiális infarktus vagy műtét utáni. A legtöbb vizsgálat magában foglalta a műtét utáni lohf-et, a lohf kevesebb bemutatásával más okokból. A legtöbb tanulmány két inotropra (Levosimendan és dobutamin) összpontosított, korlátozva más inotropok, valamint más terápiák, például eszközterápiák megértését. Egyes vizsgálatokban az elemzés a téves osztályozási torzítás kockázatának volt kitéve, mivel a betegek jelentős száma elvesztette a nyomon követést. Mivel a vizsgálatok többsége nem számol be páronkénti beavatkozás előtti és utáni különbségről a kapcsolódó szórással, az intervenció előtti és utáni különbség a szórással, az intervenció előtti és utáni eredmények függetlenek, ez sider konfidencia intervallumokat kap a kezelés hatására egy kapcsolódó szórással.
következtetés
az alacsony kimenetű szívelégtelenség (LoHF) egy klinikai szindróma, amelyet a csökkent szívteljesítmény jellemez, amelyet szervi hipoperfúzió kísér. Ez a szívelégtelenség ritka formája az általános populációban, de a műtét utáni HF betegeknél elterjedt. Etiológiája heterogén, különböző állapotokból áll, amelyek alacsony kimeneti állapotot és szívműtétet okoznak. A fő patofiziológiai mechanizmusok az LV szisztolés és/vagy diasztolés diszfunkció, valamint a pulzus, az előterhelés, az utóterhelés és / vagy a kontraktilitás változásai által okozott RV diszfunkció. A lohf általános kockázati tényezői közé tartozik a Chagas-kór, a depressziós ejekciós frakció és a veseműködési zavar, míg a műtét utáni betegeknél a károsodott LV funkció, a hiányos revaszkularizáció, az idősebb életkor, valamint a cukorbetegség és a veseműködési zavar jelenléte. A diagnózis nem rendelkezik szabványosított irányelvekkel, és a hemodinamikai és fiziológiai rendellenességek elfogadott gyűjteményétől függ, beleértve az alacsony kimeneti állapotot okozó feltételeket is. A beteg története és a fizikai vizsgálat segít a hemodinamikai állapot felmérésében és az alacsony kimeneti állapot felismerésében, míg az echokardiográfia megerősíti a kamrai diszfunkciót (HF) és az alacsony szívteljesítményt. A diagnózis alátámasztására vagy az alacsony kimeneti állapot okának megállapítására szolgáló egyéb vizsgálatok közé tartozik az elektrokardiogram és az alapvető laboratóriumi vizsgálatok (vér, szérum elektrolit, karbamid és kreatinin, májvizsgálat, pajzsmirigyfunkció és szérum natriuretikus peptidek) és a szív képalkotása (mellkasröntgen vagy koszorúér angiográfia). A kezelésből hiányoznak a megállapított Irányelvek, de az egyéni patofiziológia értékelésétől függ a legmegfelelőbb kezelési stratégia kiválasztása. A kezelés magában foglalja a lélegeztetőgép stratégiákat a pulzus és a ritmus javítására; a térfogat beállítása az előterhelés optimalizálása érdekében; farmakológiai támogatás (inotropok és értágítók) az utóterhelés manipulálására és a kontraktilitás javítására; és eszközterápia (intra-aorta ballonpumpa vagy kamrai segédeszköz), amikor ezek a stratégiák nem állítják vissza a szívteljesítményt. Kiválasztott betegeknél az alapbetegség visszafordítására szolgáló terápiák visszaállíthatják a szívteljesítményt.
- Inamdar A, Inamdar A (2016) szívelégtelenség diagnózisa, kezelése és hasznosítása. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) A szívelégtelenség legújabb fejleményei. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio a, Bohm M, et al. (2012) iránymutatások az akut és krónikus szívelégtelenség diagnosztizálásához és kezeléséhez 2012: Az Európai Kardiológiai Társaság akut és krónikus szívelégtelenség diagnosztizálásával és kezelésével foglalkozó munkacsoportja 2012. Az ESC szívelégtelenség egyesületével (HFA) együttműködve fejlesztették ki. Eur J Szív Nem 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey de, et al. (2013) 2013 ACCF/AHA iránymutatás a szívelégtelenség kezelésére: az American College of Cardiology Foundation/American Heart Association munkacsoport jelentése a gyakorlati Irányelvekről. J am Coll Cardiol 62: e147-239.
- Ponikowski P, VOORS AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 Esc iránymutatások az akut és krónikus szívelégtelenség diagnosztizálására és kezelésére: Az Európai Kardiológiai Társaság (ESC) akut és krónikus szívelégtelenség diagnosztizálásával és kezelésével foglalkozó munkacsoportja az ESC szívelégtelenség Egyesületének (HFA) külön hozzájárulásával alakult ki. Eur Szív J 37: 2129-2200.
- Massse l, Antonacci M (2005) alacsony szívteljesítmény szindróma: azonosítás és kezelés. Crit Ellátás Nurs Clin 17: 375-383.
- Poppas A, S forduló (2002) pangásos szívelégtelenség. Am J Respir Crit Care Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Az akut szívelégtelenség diagnosztizálására és kezelésére vonatkozó iránymutatások összefoglalása: Az Európai Kardiológiai Társaság akut szívelégtelenséggel foglalkozó munkacsoportja. Eur Szív J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) szívteljesítmény és mortalitás korai intrakardiális műtét után csecsemőknél és kisgyermekeknél. Keringés 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) posztoperatív tanfolyam és hemodinamikai profil az artériás kapcsoló műtét után újszülötteknél és csecsemőknél: az alacsony áramlású cardiopulmonalis bypass és a keringési leállás összehasonlítása. Forgalom 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, D) A szív-és neurológiai szövődmények azonosítják a halálozás kockázatát mind a férfiak, mind a nők számára, akik koszorúér bypass graft műtéten esnek át. Aneszteziológia 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis js, Christakis GT, et al. (1996) az alacsony szívteljesítmény szindróma előrejelzői a koszorúér bypass után. J Thorac Cardiovasc Surg 112: 38-51. Arriibas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) epidemiológia és az alacsony szívteljesítmény szindróma új előrejelzői izolált koszorúér bypass oltás után. Eur Szív J 31: 68-69.
- S MP, Nogueira JR, Ferraz PE, Figueiredo HL, Cavalcante WC, et al. (2012) Az alacsony szívteljesítmény szindróma kockázati tényezői a koszorúér bypass oltási műtét után. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Az alacsony szívteljesítmény szindróma előrejelzői izolált koszorúér bypass műtét után: trendek 20 év alatt. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) az alacsony szívteljesítmény szindróma kezelése veleszületett szívbetegség műtétét követően. Kurr Cardiol Jel 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) alacsony szív-kimeneti szindróma szívműtét után. J Cardiothorac Vasc Anesztezi31: 291-308.
- Tibby SM., Murdoch IA (2003) a szívműködés monitorozása az intenzív ellátásban. Arch Dis Gyermek 88: 46-52.
- Carcello JA, Field AI (2002) klinikai gyakorlati paraméterek gyermek-és újszülött betegek hemodinamikai támogatására szeptikus sokkban. Crit Ellátás Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) Kardiomiocita halál: mechanizmusok és transzlációs következmények. Sejthalál & betegség 2: e244.
- Tavernarakis N (2007) Kardiomiocita nekrózis: alternatív mechanizmusok, hatékony beavatkozások. Biochimica et Biophysica Acta (BBA)-molekuláris sejtkutatás 1773: 480-482.
- Dorn GW (2008) apoptotikus és nem apoptotikus programozott kardiomiocita halál a kamrai remodellációban. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) a döbbent és hibernáló szívizom: rövid áttekintés. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) diasztolés szívelégtelenség szívműtét után. A koszorúér-betegség-a jelenlegi fogalmak Epidemiológia, patofiziológia, diagnosztika és kezelés 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) milyen mechanizmusok állnak a diasztolés diszfunkció hátterében a szívelégtelenségben? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) szívelégtelenség tartósított ejekciós frakcióval: patofiziológia, diagnózis és kezelés. Eur Szív J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) a Foszfolambán vagy a Troponin I a “Primadonna” az antioxidánsok által kiváltott Lusitropiában? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) a nitrogén-monoxid akut hatásai a bal kamrai relaxációra és a diasztolés distenzibilitásra emberben. Értékelés bicoronáris nátrium-nitroprussid infúzióval. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) A bal kamrai diasztolés töltési Abnorrnalitások prevalenciája felnőtt Szívsebészeti betegeknél: intraoperatív Echo kardiográfiai vizsgálat. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru a, Carrier M, et al. (2006) biventrikuláris diasztolés töltési minták koszorúér bypass graft műtét után. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) pulmonalis artériás hipertónia: az echokardiográfia kulcsszerepe. Mellkas 127: 1836-1843.
- Zochios V, Jones N (2014) akut jobb szív szindróma a kritikus betegben. Szív tüdőedény 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) kezdeti klinikai tapasztalat miniatürizált transzesophagealis echokardiográfiás szondával egy szív intenzív osztályon. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) A jobb kamra teljesítménye stressz alatt: kapcsolat a jobb koszorúér-áramlással. J Clin Invest 50: 2176-2183.
- Ár LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) pulmonalis vascularis és jobb kamrai diszfunkció felnőtt kritikus ellátásban: jelenlegi és feltörekvő kezelési lehetőségek: szisztematikus irodalmi áttekintés. Crit Ellátás 14: R169.
- Pfisterer M (2003) jobb kamrai részvétel miokardiális infarktusban és kardiogén sokkban. Lancet 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Az alacsony szívteljesítmény előrejelzői dekompenzált súlyos szívelégtelenségben. Klinikák 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) a sürgős koszorúér bypass oltás klinikai eredménye. J Koreai Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) az alacsony szívteljesítmény szindróma előrejelzői izolált aorta szelep műtét után. Forgalom 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) táplálkozási szűrési eszközök értékelése szívműtétre tervezett betegek számára. Táplálkozás 29: 436-442.
- Hern XXL, Dennis R, Isaza D, Uma a JP (2013) Hemoglobin és B-típusú natriuretikus peptid preoperatív értékek, de nem gyulladásos markerek, a posztoperatív morbiditással társulnak szívsebészet: prospektív kohorsz analitikus vizsgálat. J Cardiothorac Surg 8:170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) preoperatív teljes limfocita szám a perifériás vérben, mint a rossz eredmény előrejelzője felnőtt szívműtét. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminális pro-B típusú natriuretikus peptidszintek és korai kimenetel a szívműtét után: prospektív kohorsz vizsgálat. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) A B-típusú natriuretikus peptid hasznossága a posztoperatív szövődmények és eredmények előrejelzésében szívműtéten átesett betegeknél. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) kapcsolat a felvételi szérum nátriumkoncentráció és a szívelégtelenség miatt kórházba került betegek klinikai eredményei között: elemzés az OPTIMIZE-HF nyilvántartásból. Eur Szív J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo Úr, Berkowitz RL, et al. (2005) kórházi halálozás akut dekompenzált szívelégtelenségben szenvedő betegeknél, amelyek intravénás vazoaktív gyógyszereket igényelnek: elemzés az akut dekompenzált szívelégtelenség Nemzeti nyilvántartásából (Tape). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) szívelégtelenségben szenvedő betegek Csapatmenedzsmentje: nyilatkozat az egészségügyi szakemberek számára az American Heart Association kardiovaszkuláris ápolási Tanácsától. Forgalom 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) a fizikai jelek korlátozott megbízhatósága a hemodinamika becsléséhez krónikus szívelégtelenségben. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) a klinikai értékelés azonosítja azokat a hemodinamikai profilokat, amelyek megjósolják a szívelégtelenségben befogadott betegek kimenetelét. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) akut miokardiális infarktus orvosi kezelése hemodinamikai részhalmazok alkalmazásával. N Engl J Med 295: 1356-1362.
- Nohria a, Lewis e, Stevenson LW (2002) az előrehaladott szívelégtelenség orvosi kezelése. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) echokardiográfia a szívelégtelenségben: alkalmazások, hasznosság és új távlatok. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo Rp, Krim SR, Sarvari SI, et al. (2011) a hemodinamika echokardiográfiai értékelése dekompenzált szisztolés szívelégtelenségben szenvedő betegeknél. Circ Cardiovasc Képalkotás 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) ajánlások a szívkamra mennyiségi meghatározására echokardiográfiával felnőtteknél: frissítés az American Society of Echocardiography-tól és az Európai cardiovascularis képalkotó Szövetségtől. Eur Szív J Cardiovasc Képalkotás 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) A szívelégtelenségben a kardiovaszkuláris képalkotás megfelelőségi kritériumai: irodalmi áttekintés jelentése. Eur Szív J Cardiovasc Képalkotás 16: 147-153.
- Gimelli a, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) krónikus szisztolés szívelégtelenségben szenvedő betegek nem invazív szív képalkotó értékelése: az Európai kardiovaszkuláris képalkotó Szövetség (EACVI) jelentése. Eur Szív J 35: 3417-3425.
- Vazir a, Cowie MR (2012) Az akut dekompenzált szívelégtelenség értékelése: stratégiák és eszközök. Eur Cardiol 8: 128-133.
- Gray a, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) nem invazív szellőzés akut kardiogén tüdőödémában. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) hemodinamikai monitorozás akut szívelégtelenségben. Crit Ellátás Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) az intra-aorta léggömb szivattyú a szívelégtelenség kezelésében: az ápolási gyakorlat következményei. Aust Crit Ellátás 22: 125-131.
- Slaughter MS, Singh R (2012) a kamrai segédeszközök szerepe előrehaladott szívelégtelenségben. Revista Espa Cardiologia 65: 982-985.
- Shah Úr, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) az előrehaladott szívelégtelenség hemodinamikai profiljai: összefüggés a klinikai jellemzőkkel és a hosszú távú eredményekkel. J Kártya Sikertelen 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) a dobutamin fölénye a dopamin felett a szívteljesítmény növelése érdekében krónikus alacsony kimeneti szívelégtelenségben szenvedő betegeknél. Keringés 55: 375-378.
- Follath F, Cleland JG, csak H, Papp JG, Scholz H, et al. (2002) az intravénás levozimendán hatásossága és biztonságossága dobutaminnal összehasonlítva súlyos, alacsony kibocsátású szívelégtelenségben (LIDO-vizsgálat): randomizált kettős-vak vizsgálat. A Lancet 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) alacsony teljesítményű, alacsony gradiensű aorta stenosis depressziós bal kamrai szisztolés funkciójú betegeknél: a dobutamin kihívás klinikai hasznossága a katéterezési laboratóriumban. Forgalom 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) a levosimendan versus dobutamin hatása gyulladásos és apoptotikus utakra akut dekompenzált krónikus szívelégtelenségben. Am J Cardiol 98: 102-106.
- Mebazaa a, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007) Túlélők. Levosimendan vs dobutamin akut dekompenzált szívelégtelenségben szenvedő betegek számára: A SURVIVE randomizált vizsgálat. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) a kalcium-szenzibilizáló levosimendan kiváló eredményeket ad a dobutaminnak posztoperatív alacsony szívteljesítmény-szindrómában. Revista Espa Xiaola de Cardiologist (Angol kiadás) 61: 471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) nátrium-nitroprussid előrehaladott alacsony kibocsátású szívelégtelenség esetén. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan versus intra-aorta ballon pumpa magas kockázatú szívbetegekben. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) a doubutamin és a levosimendan n máj véráramának összehasonlítása alacsony szívteljesítményű betegeknél szívműtét után: randomizált, kontrollos vizsgálat. Anaesth Intenzív Ellátás 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara a, et al. (2017) A levosimendan hatása az alacsony szívteljesítmény-szindrómára alacsony ejekciós frakcióval rendelkező betegeknél szívkoszorúér bypass oltás kardiopulmonalis bypass-szal: a LICORN randomizált klinikai vizsgálat. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan hemodinamikai támogatáshoz szívműtét után. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, van Diepen S, Meza J, Wang a, et al. (2017) Levosimendan szívműtéten átesett bal kamrai diszfunkcióban szenvedő betegeknél. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) inotrop szerek és értágító stratégiák kardiogén sokk vagy alacsony szívteljesítmény szindróma kezelésére. A Cochrane Könyvtár. 2 : 1-10.