2.1: Evolution of Atomic Theory
Atomic Theory after the Nineteenth Century
Se la materia fosse composta da atomi, di cosa erano composti gli atomi? Erano le particelle più piccole o c’era qualcosa di più piccolo? Alla fine del 1800, un certo numero di scienziati interessati a domande come queste ha studiato le scariche elettriche che potrebbero essere prodotte nei gas a bassa pressione, con la scoperta più significativa fatta dal fisico inglese JJ Thomson utilizzando un tubo a raggi catodici. Questo apparecchio consisteva in un tubo di vetro sigillato da cui era stata rimossa quasi tutta l’aria; il tubo conteneva due elettrodi metallici. Quando l’alta tensione veniva applicata attraverso gli elettrodi, un raggio visibile chiamato raggio catodico appariva tra di loro. Questo fascio è stato deviato verso la carica positiva e lontano dalla carica negativa, ed è stato prodotto nello stesso modo con proprietà identiche quando sono stati utilizzati metalli diversi per gli elettrodi. In esperimenti simili, il raggio è stato contemporaneamente deviato da un campo magnetico applicato e le misurazioni dell’estensione della deflessione e dell’intensità del campo magnetico hanno permesso a Thomson di calcolare il rapporto carica-massa delle particelle del raggio catodico. I risultati di queste misurazioni hanno indicato che queste particelle erano molto più leggere degli atomi (Figura \ (\PageIndex{1}\)).
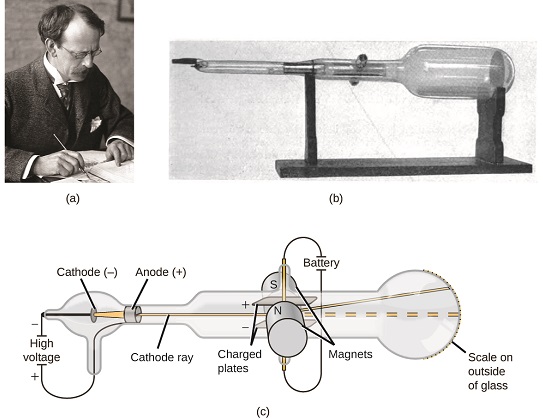
Figura \(\PageIndex{5}\): (a) J. J. Thomson ha prodotto un fascio visibile in un tubo catodico. (b) Questo è un tubo a raggi catodici precoce, inventato nel 1897 da Ferdinand Braun. (c) Nel raggio catodico, il fascio (mostrato in giallo) proviene dal catodo e viene accelerato oltre l’anodo verso una scala fluorescente all’estremità del tubo. Le deflessioni simultanee dei campi elettrici e magnetici applicati hanno permesso a Thomson di calcolare il rapporto massa-carica delle particelle che compongono il raggio catodico. (credito a: modifica dell’opera della Fondazione Nobel; credito b: modifica dell’opera di Eugen Nesper; credito c: modifica dell’opera di “Kurzon”/Wikimedia Commons).
Sulla base delle sue osservazioni, ecco cosa propose Thomson e perché: Le particelle sono attratte da cariche positive (+) e respinte da cariche negative ( − ), quindi devono essere caricate negativamente (come le cariche respingono e a differenza delle cariche attraggono); sono meno massicce degli atomi e indistinguibili, indipendentemente dal materiale sorgente, quindi devono essere costituenti subatomici fondamentali di tutti gli atomi. Anche se controverso al momento, l’idea di Thomson è stato gradualmente accettato, e la sua particella a raggi catodici è quello che ora chiamiamo un elettrone, una carica negativa, particella subatomica con una massa più di mille volte inferiore a quella di un atomo. Il termine “elettrone” fu coniato nel 1891 dal fisico irlandese George Stoney, da ” electric ion.”
Nel 1909, ulteriori informazioni sull’elettrone furono scoperte dal fisico americano Robert A. Millikan attraverso i suoi esperimenti” oil drop”. Millikan ha creato goccioline di olio microscopiche, che potrebbero essere caricate elettricamente per attrito durante la formazione o utilizzando i raggi X. Queste goccioline inizialmente cadevano a causa della gravità, ma il loro progresso verso il basso poteva essere rallentato o addirittura invertito da un campo elettrico più basso nell’apparecchio. Regolando l’intensità del campo elettrico e effettuando misurazioni accurate e calcoli appropriati, Millikan è stato in grado di determinare la carica su singole gocce (Figura \(\PageIndex{2}\)).
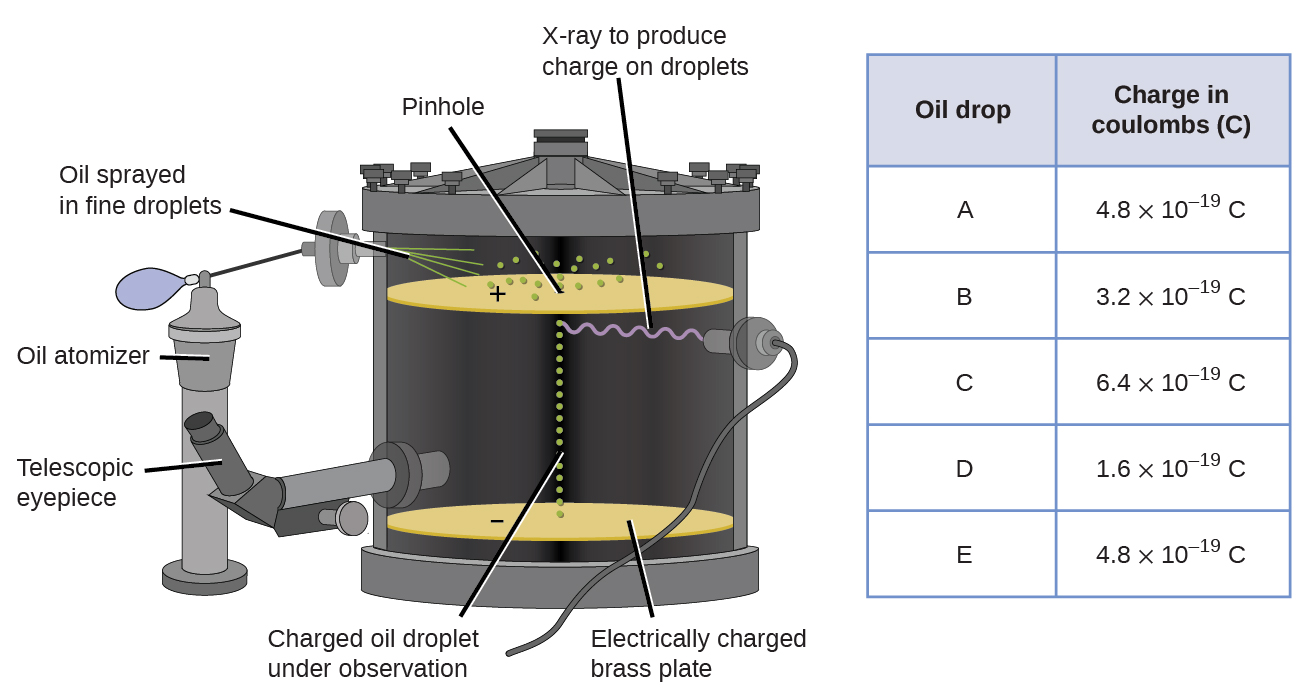
Figura \(\PageIndex{6}\): L’esperimento di Millikan ha misurato la carica delle singole gocce di olio. I dati tabulati sono esempi di alcuni valori possibili.
Guardando i dati che Millikan raccolti, si può avere riconosciuto che la carica di una goccia di olio è sempre un multiplo di una tassa specifica, 1.6 \(\times\) 10-19 C. Millikan ha concluso che questo valore deve essere, pertanto, un compito fondamentale—la carica di un singolo elettrone—con la sua misurata oneri a causa di un eccesso di un elettrone (1 volte 1.6 \(\volte\) 10-19 C), due elettroni (2 volte 1.6 \(\volte\) 10-19 C), tre elettroni (3 volte 1.6 \(\volte\) 10-19 C), e così via, su una determinata goccia d’olio. Poiché la carica di un elettrone era ormai nota a causa della ricerca di Millikan, e il rapporto carica-massa era già noto a causa della ricerca di Thomson (1.759 \(\times\) 1011 C/kg), richiedeva solo un semplice calcolo per determinare anche la massa dell’elettrone.
\
Gli scienziati avevano ora stabilito che l’atomo non era indivisibile come Dalton aveva creduto, e grazie al lavoro di Thomson, Millikan e altri, la carica e la massa delle particelle subatomiche negative—gli elettroni—erano noti. Tuttavia, la parte caricata positivamente di un atomo non era ancora ben compresa. Nel 1904, Thomson propose il modello di atomi “plum pudding”, che descriveva una massa caricata positivamente con una quantità uguale di carica negativa sotto forma di elettroni incorporati in essa, poiché tutti gli atomi sono elettricamente neutri. Un modello concorrente era stato proposto nel 1903 da Hantaro Nagaoka, che postulava un atomo simile a Saturno, costituito da una sfera carica positivamente circondata da un alone di elettroni (Figura \(\PageIndex{3}\)).
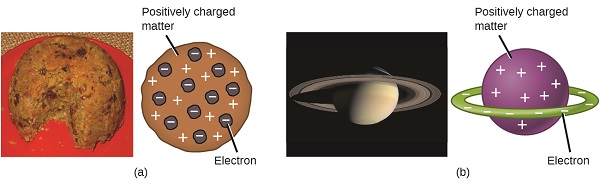
Figura \(\PageIndex{7}\): (a) Thomson suggerì che gli atomi assomigliavano al plum pudding, un dolce inglese composto da torta umida con uvetta incorporata (“prugne”). (b) Nagaoka propose che gli atomi assomigliassero al pianeta Saturno, con un anello di elettroni che circondava un pianeta positivo.”(credito a: modifica del lavoro di”Man vyi ” /Wikimedia Commons; credito b: modifica del lavoro di “NASA”/Wikimedia Commons).
Il successivo importante sviluppo nella comprensione dell’atomo venne da Ernest Rutherford, un fisico neozelandese che in gran parte trascorse la sua carriera scientifica in Canada e in Inghilterra. Ha eseguito una serie di esperimenti utilizzando un fascio di particelle alfa cariche positivamente ad alta velocità (particelle α) prodotte dal decadimento radioattivo del radio; le particelle α sono costituite da due protoni e due neutroni (imparerai di più sul decadimento radioattivo nel capitolo sulla chimica nucleare). Rutherford e i suoi colleghi Hans Geiger (in seguito famoso per il contatore Geiger) e Ernest Marsden puntarono un fascio di particelle α, la cui sorgente era incorporata in un blocco di piombo per assorbire la maggior parte della radiazione, su un sottilissimo pezzo di lamina d’oro e esaminarono la dispersione risultante delle particelle α usando uno schermo luminescente che brillava brevemente dove colpito da una particella α.
Cosa hanno scoperto? La maggior parte delle particelle passava attraverso il foglio senza essere deviata affatto. Tuttavia, alcuni sono stati deviati leggermente e un numero molto piccolo è stato deviato quasi dritto verso la fonte (Figura \(\PageIndex{4}\)). Rutherford ha descritto questi risultati: “È stato l’evento più incredibile che mi sia mai capitato in vita mia. Era quasi incredibile come se avessi sparato un guscio da 15 pollici contro un pezzo di carta velina e fosse tornato indietro e ti avesse colpito”1 (p. 68).
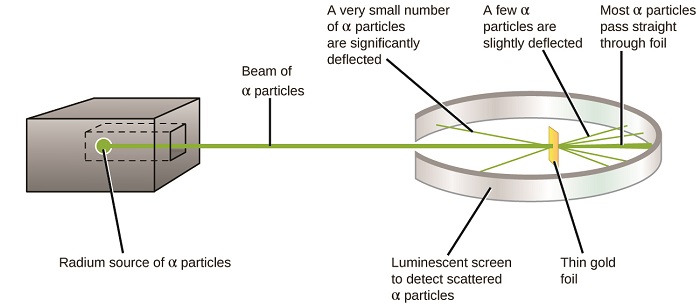
Figura \(\PageIndex{8}\): Geiger e Rutherford hanno sparato particelle α su un pezzo di lamina d’oro e hanno rilevato dove sono andate quelle particelle, come mostrato in questo diagramma schematico del loro esperimento. La maggior parte delle particelle passavano direttamente attraverso il foglio, ma alcune erano leggermente deviate e un numero molto piccolo era significativamente deviato.
Ecco cosa ha dedotto Rutherford: Poiché la maggior parte delle particelle α in rapido movimento sono passate attraverso gli atomi d’oro non deflected, devono aver viaggiato attraverso lo spazio essenzialmente vuoto all’interno dell’atomo. Le particelle alfa sono caricate positivamente, quindi le deflessioni si sono verificate quando hanno incontrato un’altra carica positiva (come le cariche si respingono a vicenda). Poiché cariche simili si respingono l’un l’altro, le poche particelle α cariche positivamente che hanno cambiato percorso bruscamente devono aver colpito, o avvicinato da vicino, un altro corpo che aveva anche una carica positiva altamente concentrata. Poiché le deflessioni si sono verificate una piccola frazione del tempo, questa carica occupava solo una piccola quantità di spazio nella lamina d’oro. Analizzando una serie di tali esperimenti in dettaglio, Rutherford trasse due conclusioni:
- Il volume occupato da un atomo deve essere costituito da una grande quantità di spazio vuoto.
- Un corpo piccolo, relativamente pesante, caricato positivamente, il nucleo, deve essere al centro di ogni atomo.
Questa analisi led Rutherford a proporre un modello in cui un atomo è costituito da un piccolo nucleo carico positivamente, in cui la maggior parte della massa dell’atomo è concentrata, circondato da elettroni di carica negativa, in modo che l’atomo è elettricamente neutro (Figura \(\PageIndex{5}\)).
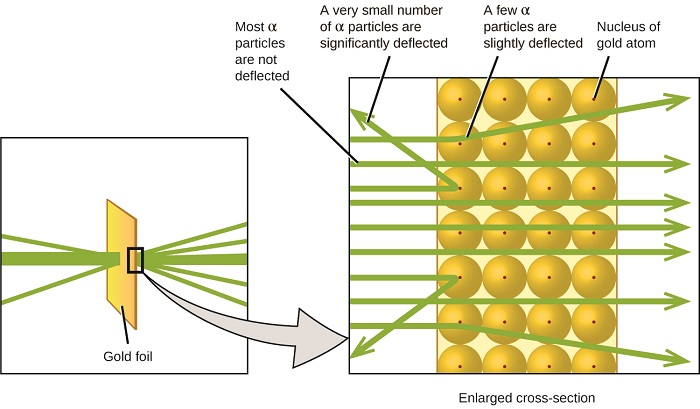
Figura \(\PageIndex{9}\): Le particelle α vengono deviate solo quando si scontrano con o passano vicino al nucleo d’oro molto più pesante, caricato positivamente. Poiché il nucleo è molto piccolo rispetto alle dimensioni di un atomo, pochissime particelle α sono deviate. La maggior parte passa attraverso la regione relativamente grande occupata dagli elettroni, che sono troppo leggeri per deviare le particelle in rapido movimento.
Dopo molti altri esperimenti, Rutherford scoprì anche che i nuclei di altri elementi contengono il nucleo di idrogeno come un “blocco di costruzione”, e chiamò questa particella più fondamentale il protone, la particella subatomica caricata positivamente trovata nel nucleo. Con un’aggiunta, che imparerete dopo, questo modello nucleare dell’atomo, proposto oltre un secolo fa, è ancora usato oggi.
Un’altra scoperta importante è stata la scoperta degli isotopi. Durante i primi anni del 1900, gli scienziati hanno identificato diverse sostanze che sembravano essere nuovi elementi, isolandoli dai minerali radioattivi. Ad esempio, un” nuovo elemento ” prodotto dal decadimento radioattivo del torio è stato inizialmente dato il nome di mesotorio. Tuttavia, un’analisi più dettagliata ha mostrato che il mesotorio era chimicamente identico al radio (un altro prodotto di decadimento), nonostante avesse una massa atomica diversa. Questo risultato, insieme a risultati simili per altri elementi, ha portato il chimico inglese Frederick Soddy a rendersi conto che un elemento potrebbe avere tipi di atomi con masse diverse che erano chimicamente indistinguibili. Questi diversi tipi sono chiamati isotopi-atomi dello stesso elemento che differiscono in massa. Soddy ha ricevuto il premio Nobel per la chimica nel 1921 per questa scoperta.
Rimase un enigma: il nucleo era noto per contenere quasi tutta la massa di un atomo, con il numero di protoni che forniva solo la metà, o meno, di quella massa. Sono state fatte diverse proposte per spiegare cosa costituiva la massa rimanente, inclusa l’esistenza di particelle neutre nel nucleo. Come ci si potrebbe aspettare, rilevare particelle non caricate è molto impegnativo, e non è stato fino al 1932 che James Chadwick ha trovato prove di neutroni, particelle subatomiche non caricate con una massa approssimativamente uguale a quella dei protoni. L’esistenza del neutrone ha anche spiegato gli isotopi: differiscono in massa perché hanno un numero diverso di neutroni, ma sono chimicamente identici perché hanno lo stesso numero di protoni. Questo sarà spiegato più in dettaglio più avanti in questa unità.