Chimica introduttiva-1st Canadian Edition
Obiettivi formativi
- Definire la pressione di vapore dei liquidi.
- Spiegare l’origine sia della tensione superficiale che dell’azione capillare.
Ci sono alcune proprietà che tutti i liquidi hanno. Il liquido con cui abbiamo più familiarità è probabilmente l’acqua e ha queste proprietà. Altri liquidi li hanno pure, che è qualcosa da tenere a mente.
Tutti i liquidi hanno una certa parte delle loro particelle con energia sufficiente per entrare nella fase gassosa, e se queste particelle si trovano sulla superficie del liquido, lo fanno (Figura 10.6 “Evaporazione”). La formazione di un gas da un liquido a temperature inferiori al punto di ebollizione è chiamata evaporazione. A queste temperature, il materiale nella fase gassosa è chiamato vapore, piuttosto che gas; il termine gas è riservato per quando la fase gassosa è la fase stabile.
Figura 10.6 Evaporazione

Alcune particelle di un liquido hanno energia sufficiente per sfuggire alla fase liquida per diventare un vapore.
Se il volume disponibile è abbastanza grande, alla fine tutto il liquido diventerà vapore. Ma se il volume disponibile non è sufficiente, alla fine alcune particelle di vapore rientreranno nella fase liquida (Figura 10.7 “Equilibrio”). Ad un certo punto, il numero di particelle che entrano nella fase di vapore sarà uguale al numero di particelle che escono dalla fase di vapore, quindi non vi è alcuna variazione netta nella quantità di vapore nel sistema. Diciamo che il sistema è all’equilibrio. La pressione parziale del vapore all’equilibrio è chiamata pressione di vapore del liquido.
Figura 10.7 Equilibrio

Ad un certo punto, il numero di particelle che entrano nella fase di vapore sarà bilanciato dal numero di particelle che ritornano al liquido. Questo punto è chiamato equilibrio.
Capire che il liquido non ha smesso di evaporare. Il processo inverso-la condensazione – si verifica tanto velocemente quanto l’evaporazione, quindi non vi è alcuna variazione netta nella quantità di vapore nel sistema. Il termine equilibrio dinamico rappresenta una situazione in cui un processo si verifica ancora, ma il processo opposto si verifica anche alla stessa velocità in modo che non vi sia alcun cambiamento netto nel sistema.
La pressione di vapore di una sostanza dipende dalla temperatura della sostanza; all’aumentare della temperatura, aumenta anche la pressione di vapore. Figura 10.8 “Diagrammi di pressione di vapore contro temperatura per parecchi liquidi” è un diagramma di pressione di vapore contro temperatura per parecchi liquidi. Dopo aver definito la pressione di vapore, possiamo anche ridefinire il punto di ebollizione di un liquido: la temperatura alla quale la pressione di vapore di un liquido è uguale alla pressione ambientale circostante. La pressione di vapore normale, quindi, è la temperatura alla quale la pressione di vapore è 760 torr, o esattamente 1 atm. Quindi i punti di ebollizione variano con la pressione circostante, un fatto che può avere grandi implicazioni sulla cottura degli alimenti a quote inferiori o superiori al normale. La pressione atmosferica varia significativamente con l’altitudine.
Figura 10.8 Grafici della pressione di vapore rispetto alla temperatura per diversi liquidi
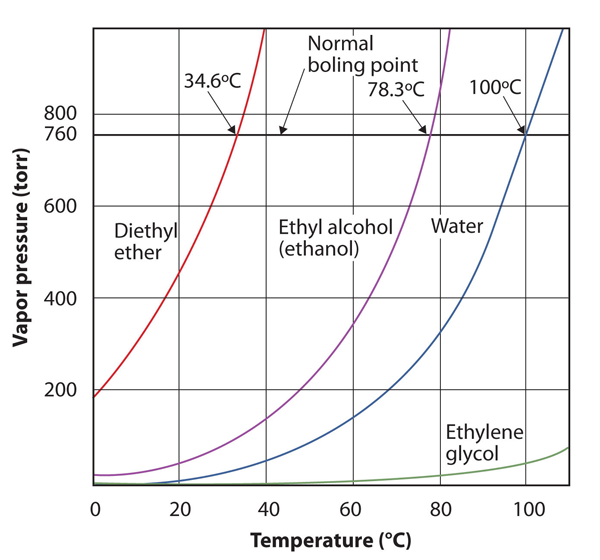
La pressione di vapore di un liquido dipende dall’identità del liquido e dalla temperatura, come mostra questo grafico.
Esempio 4
Utilizzare la figura 10.8 “Trame di pressione di vapore contro temperatura per diversi liquidi” per stimare il punto di ebollizione dell’acqua a 500 torr, che è la pressione atmosferica approssimativa in cima al monte Everest.
Soluzione
Vedere la figura di accompagnamento. Cinquecento torr è tra 400 e 600, quindi estendiamo una linea da quel punto sull’asse y fino alla curva per l’acqua e poi la abbassiamo sull’asse x per leggere la temperatura associata. Sembra che il punto sulla curva della pressione del vapore acqueo corrisponda a una temperatura di circa 90°C, quindi concludiamo che il punto di ebollizione dell’acqua a 500 torr è di 90°C.
Figura 10.9 Usando la figura 10.8 “Diagrammi di pressione di vapore rispetto alla temperatura per diversi liquidi” per rispondere all’esempio 4
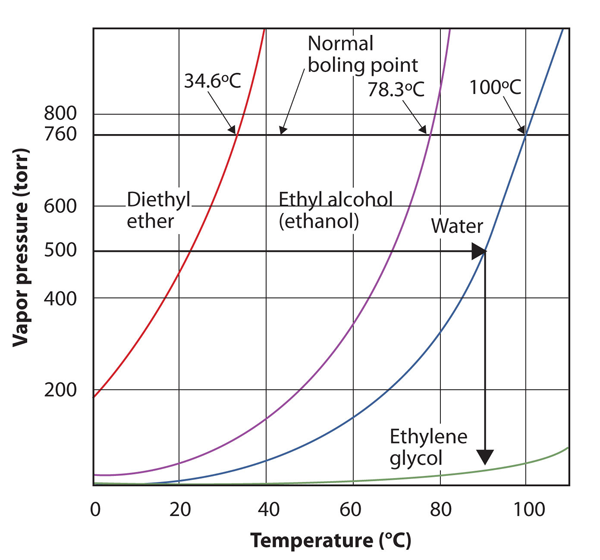
Leggendo correttamente il grafico, è possibile stimare il punto di ebollizione di un liquido a diverse temperature.
Mettiti alla prova
Usa la figura 10.8 “Trame di pressione di vapore contro temperatura per diversi liquidi” per stimare il punto di ebollizione dell’etanolo a 400 torr.
Risposta
circa 65°C
La curva della pressione di vapore per l’acqua non è esattamente zero al punto di fusione-0°C. Anche il ghiaccio ha una pressione di vapore; ecco perché sublima nel tempo. Tuttavia, le pressioni di vapore dei solidi sono in genere molto inferiori a quelle dei liquidi. A -1°C, la pressione di vapore del ghiaccio è 4.2 torr. Ad una temperatura del congelatore di 0 ° F (-17°C), la pressione di vapore del ghiaccio è solo 1,0 torr; i cosiddetti surgelatori possono scendere a -23°C, dove la pressione di vapore del ghiaccio è solo 0,6 torr.
Diagrammi di fase
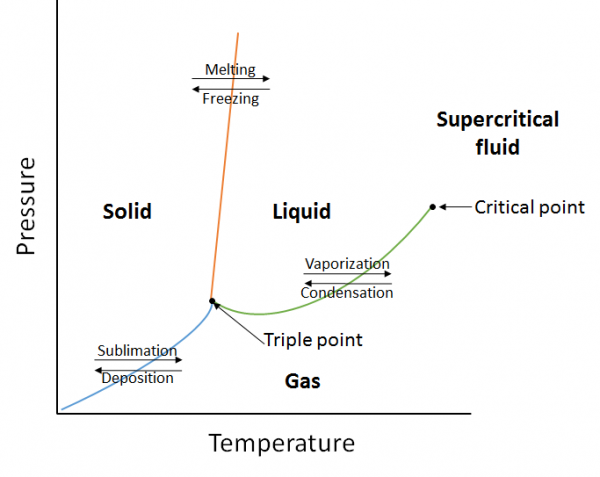
Un diagramma di fase è una rappresentazione grafica delle relazioni di equilibrio esistenti tra le fasi di una sostanza sotto pressioni e temperature specificate (Figura 10.10). Il diagramma di fase è una combinazione di tre curve: la curva della pressione di vapore, la curva di fusione e la curva di sublimazione. Abbiamo già visto che le curve di pressione di vapore rappresentano l’equilibrio tra la fase liquida e gassosa, e il punto in cui la pressione è uguale a 1 atm è il normale punto di ebollizione. Una caratteristica aggiuntiva di questa curva nel diagramma di fase (verde), è che termina nel punto critico. Il punto critico è il punto alla massima temperatura e pressione in cui liquidi e gas rimangono distinguibili. A temperature e pressioni oltre questo punto la materia esiste in una fase con proprietà sia dei liquidi che dei gas nota come fluido supercritico.
La curva di fusione (arancione) rappresenta l’equilibrio tra solido e liquido e il punto in cui la pressione è uguale a 1 atm è il normale punto di fusione. La curva di sublimazione (blu) rappresenta l’equilibrio che esiste tra solido e gas. Infine, il punto in cui tutte e tre le curve si incontrano è noto come il punto triplo. A questo punto, tre fasi (solido, liquido e gas) esistono tutte all’equilibrio.
Esempio:
Utilizzando il seguente diagramma di fase, determinare cosa accadrebbe se:
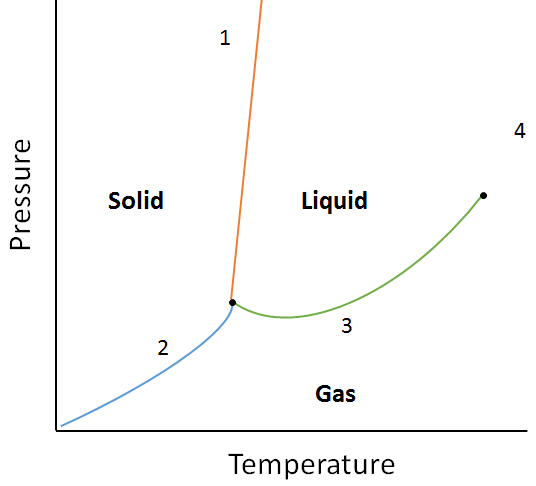
a. La temperatura viene aumentata per la materia al punto 1.
b. La pressione viene aumentata per la materia al punto 3.
Soluzione:
a. La materia al punto 1 si scioglierà (cambia fase da solido a liquido) se la temperatura viene aumentata.
b. La materia al punto 3 si condenserà (cambia fase da gas a liquido) se la temperatura viene aumentata.
Tensione superficiale e azione capillare
Tutti i liquidi condividono anche altre proprietà. La tensione superficiale è un effetto causato da uno squilibrio di forze sugli atomi sulla superficie di un liquido, come mostrato nella Figura 10.11 “Tensione superficiale”. La particella blu nella maggior parte del liquido sperimenta forze intermolecolari da tutto intorno, come illustrato dalle frecce. Tuttavia, la particella gialla sulla superficie non sperimenta alcuna forza sopra di essa perché non ci sono particelle sopra di essa. Ciò porta a uno squilibrio di forze che chiamiamo tensione superficiale.
Figura 10.11 Tensione superficiale

La tensione superficiale deriva dal fatto che le particelle sulla superficie di un liquido non sperimentano interazioni da tutte le direzioni, portando ad uno squilibrio delle forze sulla superficie.
Figura 10.12 Effetti della tensione superficiale

Fonte:” wet apple ” di cristian ruberti è distribuito sotto licenza Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic.