Chimica introduttiva-1st Canadian Edition
Obiettivi formativi
- Definire buffer.
- Identificare correttamente i due componenti di un buffer.
Come indicato nella Sezione 12.4 “Acidi e basi forti e deboli e loro sali”, gli acidi deboli sono relativamente comuni, anche negli alimenti che mangiamo. Ma occasionalmente incontriamo un acido forte o una base, come l’acido dello stomaco, che ha un pH fortemente acido di 1,7. Per definizione, acidi e basi forti possono produrre una quantità relativamente grande di ioni H+ o OH e di conseguenza hanno attività chimiche marcate. Inoltre, quantità molto piccole di acidi e basi forti possono cambiare il pH di una soluzione molto rapidamente. Se 1 mL di acido dello stomaco sono stati aggiunti al flusso sanguigno e nessun meccanismo di correzione erano presenti, il pH del sangue diminuirebbe da circa 7,4 a circa 4,7—un pH che non è favorevole alla vita continua. Fortunatamente, il corpo ha un meccanismo per minimizzare tali cambiamenti drammatici di pH.
Il meccanismo comporta un buffer, una soluzione che resiste a cambiamenti drammatici nel pH. I buffer lo fanno essendo composti da alcune coppie di soluti: un acido debole più un sale derivato da quell’acido debole o una base debole più un sale di quella base debole. Ad esempio, un buffer può essere composto da HC2H3O2 disciolto (un acido debole) e NaC2H3O2 (il sale derivato da quell’acido debole). Un altro esempio di buffer è una soluzione contenente NH3 (una base debole) e NH4Cl (un sale derivato da quella base debole).
Usiamo un buffer HC2H3O2 / NaC2H3O2 per dimostrare come funzionano i buffer. Se una base forte—una fonte di ioni OH−(aq)—viene aggiunta alla soluzione tampone, quegli ioni OH reagiranno con l’HC2H3O2 in una reazione acido− base:
HC2H3O2(aq) + OH-(aq) → H2O(ℓ) + C2H3O2−(aq)
Invece di cambiare drasticamente il pH rendendo la soluzione basica, gli ioni OH aggiunti reagiscono per creare H2O, quindi il pH non cambia molto.
Se un acido forte—una fonte di ioni H+—viene aggiunto alla soluzione tampone, gli ioni H+ reagiranno con l’anione dal sale. Poiché HC2H3O2 è un acido debole, non è ionizzato molto. Ciò significa che se molti ioni H+ e ioni C2H3O2 sono presenti nella stessa soluzione, si uniranno per rendere HC2H3O2:
H+(aq) + C2H3O2− (aq) → HC2H3O2(aq)
Invece di cambiare drasticamente il pH e rendere la soluzione acida, gli ioni H+ aggiunti reagiscono per creare molecole di un acido debole. Figura 12.2 “Le azioni dei buffer” illustra entrambe le azioni di un buffer.
Figura 12.2 Le azioni dei buffer
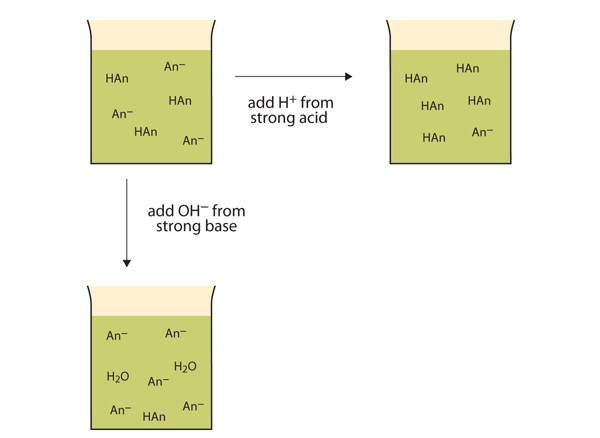
I buffer possono reagire sia con acidi forti (in alto) che con basi forti (laterali) per ridurre al minimo grandi cambiamenti nel pH.
I buffer costituiti da basi deboli e sali di basi deboli agiscono in modo simile. Per esempio, in un tampone contenente NH3 e NH4Cl, NH3 molecole in grado di reagire con qualsiasi eccesso di ioni H+ introdotte da acidi forti:
NH3(aq) + H+(aq) → NH4+(aq)
mentre la NH4+(aq) ioni in grado di reagire con qualsiasi ioni OH− introdotto da basi forti:
NH4+(aq) + OH−(aq) → NH3(aq) + H2O(ℓ)
Esempio 15
le combinazioni di composti può fare una soluzione tampone?
- HCHO2 e NaCHO2
- HCl e NaCl
- CH3NH2 e CH3NH3Cl
- NH3 e NaOH
Soluzione
- HCHO2 è acido formico, acido debole, mentre NaCHO2 è il sale effettuati dall’anione di un acido debole (formiato di ioni ). La combinazione di questi due soluti renderebbe una soluzione tampone.
- HCl è un acido forte, non un acido debole, quindi la combinazione di questi due soluti non renderebbe una soluzione tampone.
- CH3NH2 è metilammina, che è come NH3 con uno dei suoi atomi H sostituito con un gruppo CH3. Perché non è elencato nella Tabella 12.2 “Acidi e basi forti”, possiamo supporre che sia una base debole. Il composto CH3NH3Cl è un sale fatto da quella base debole, quindi la combinazione di questi due soluti renderebbe una soluzione tampone.
- NH3 è una base debole, ma NaOH è una base forte. La combinazione di questi due soluti non renderebbe una soluzione tampone.
Mettiti alla prova
Quali combinazioni di composti possono creare una soluzione tampone?
- NaHCO3 e NaCl
- H3PO4 e NaH2PO4
- NH3 e (NH4)3PO4
- NaOH e NaCl
Risposte
- no
- sì
- sì
- no
Buffer funziona bene solo per una limitata quantità di aggiunta di acido forte o una base. Una volta che il soluto è completamente reagito, la soluzione non è più un buffer e possono verificarsi rapidi cambiamenti nel pH. Diciamo che un buffer ha una certa capacità. I buffer che hanno più soluto disciolto in essi per iniziare hanno capacità maggiori, come ci si potrebbe aspettare.
Il sangue umano ha un sistema tampone per ridurre al minimo i cambiamenti estremi nel pH. Un tampone nel sangue si basa sulla presenza di HCO3− e H2CO3 . Con questo tampone presente, anche se qualche acido dello stomaco dovesse trovare la sua strada direttamente nel flusso sanguigno, la variazione del pH del sangue sarebbe minima. All’interno di molte delle cellule del corpo, c’è un sistema di buffering basato su ioni fosfato.
Cibo e bevande App: L’acido che allevia il dolore
Sebbene i farmaci non siano esattamente “cibo e bevande”, li ingeriamo, quindi diamo un’occhiata a un acido che è probabilmente la medicina più comune: l’acido acetilsalicilico, noto anche come aspirina. L’aspirina è ben noto come un antidolorifico e antipiretico (riduttore di febbre).
La struttura dell’aspirina è mostrata nella figura di accompagnamento. La parte acida è cerchiata; è l’atomo H in quella parte che può essere donato poiché l’aspirina agisce come un acido di Brønsted-Lowry. Poiché non è indicato nella Tabella 12.2 “Acidi e basi forti”, l’acido acetilsalicilico è un acido debole. Tuttavia, è ancora un acido, e dato che alcune persone consumano relativamente grandi quantità di aspirina al giorno, la sua natura acida può causare problemi nel rivestimento dello stomaco, nonostante le difese dello stomaco contro il proprio acido dello stomaco.
Figura 12.3 La struttura molecolare dell’aspirina

Gli atomi cerchiati sono la parte acida della molecola.
Poiché le proprietà acide dell’aspirina possono essere problematiche, molte marche di aspirina offrono una forma di “aspirina tamponata” del medicinale. In questi casi, l’aspirina contiene anche un agente tampone-di solito MgO-che regola l’acidità dell’aspirina per minimizzare i suoi effetti collaterali acidi.
Utile e comune come l’aspirina è, è stato formalmente commercializzato come farmaco a partire dal 1899. La Food and Drug Administration (FDA), l’agenzia governativa incaricata di supervisionare e approvare i farmaci negli Stati Uniti, non fu costituita fino al 1906. Alcuni hanno sostenuto che se la FDA fosse stata formata prima dell’introduzione dell’aspirina, l’aspirina potrebbe non aver mai ottenuto l’approvazione a causa del suo potenziale di effetti collaterali—sanguinamento gastrointestinale, ronzio nelle orecchie, sindrome di Reye (un problema al fegato) e alcune reazioni allergiche. Tuttavia, recentemente l’aspirina è stata propagandata per i suoi effetti nella diminuzione di infarti e ictus, quindi è probabile che l’aspirina sia qui per rimanere.
Key Takeaways
- Un buffer è una soluzione che resiste a cambiamenti improvvisi nel pH.
Esercizi
-
Definisci buffer. Quali due componenti chimici correlati sono necessari per creare un buffer?
-
È possibile creare un buffer combinando un acido forte con una base forte? Perché o perché no?
-
Quali combinazioni di composti possono creare un buffer? Assumere soluzioni acquose.
a) HCl e NaCl
b) HNO2 e NaNO2
c) NH4NO3 e HNO3
d) NH4NO3 e NH3
4. Quali combinazioni di composti possono creare un buffer? Assumere soluzioni acquose.
a) H3PO4 e Na3PO4
b) NaHCO3 e Na2CO3
c) NaNO3 e Ca(NO3)2
d) HN3 e NH3
5. Per ogni combinazione nell’esercizio 3 che è un buffer, scrivere le equazioni chimiche per le reazioni dei componenti del buffer quando viene aggiunto un acido forte e una base forte.
6. Per ogni combinazione nell’esercizio 4 che è un buffer, scrivere le equazioni chimiche per le reazioni dei componenti del buffer quando viene aggiunto un acido forte e una base forte.
7. Il sistema tampone fosfato completo si basa su quattro sostanze: H3PO4, H2PO4 -, HPO42-e PO43 -. Quali diverse soluzioni tampone possono essere fatte da queste sostanze?
8. Spiegare perché NaBr non può essere un componente in un buffer acido o di base.
9. Due soluzioni sono fatte contenenti le stesse concentrazioni di soluti. Una soluzione è composta da H3PO4 e Na3PO4, mentre l’altra è composta da HCN e NaCN. Quale soluzione dovrebbe avere la maggiore capacità come buffer?
10. Due soluzioni sono fatte contenenti le stesse concentrazioni di soluti. Una soluzione è composta da NH3 e NH4NO3, mentre l’altra è composta da H2SO4 e Na2SO4. Quale soluzione dovrebbe avere la maggiore capacità come buffer?
Risposte
Un buffer è la combinazione di un acido debole o base e un sale di quell’acido debole o base.
a) no
b) sì
c) no
d) sì
3b: acido forte: NO2− + H+ → HNO2; base forte: HNO2 + OH− → NO2− + H2O; 3d: base forte: NH4+ + OH− → NH3 + H2O; acido forte: NH3 + H+ → NH4+7.
I buffer possono essere costituiti da tre combinazioni: (1) H3PO4 e H2PO4−, (2) H2PO4− e HPO42−, e (3) HPO42− e PO43−. (Tecnicamente, un buffer può essere fatto da due componenti.)
Il tampone fosfato dovrebbe avere la capacità maggiore.