Chimica per i non-Majors
Come cambia l’energia di questo lavoratore mentre sale su e giù per la scala?
Salire una scala richiede energia. Ad ogni passo, ti stai spingendo contro la gravità e accumuli energia potenziale. Tornando giù rilascia quell’energia potenziale mentre scendi passo dopo passo. Se non stai attento, puoi rilasciare quell’energia potenziale tutto in una volta quando cadi dalla scala (mai una buona idea). Inoltre, si prende la salita o la discesa a gradini. Non c’è una posizione” intermedia ” sulla scala: il tuo piede colpisce un gradino o colpisce uno spazio vuoto e sei nei guai finché non trovi un gradino su cui stare.

In seguito alle scoperte degli spettri di emissione dell’idrogeno e dell’effetto fotoelettrico, il fisico danese Niels Bohr (1885-1962) propose un nuovo modello dell’atomo nel 1915. Bohr propose che gli elettroni non irradiano energia mentre orbitano attorno al nucleo, ma esistono in stati di energia costante che chiamò stati stazionari. Ciò significa che gli elettroni orbitano a distanze fisse dal nucleo (vedi Figura sotto). Il lavoro di Bohr si basava principalmente sugli spettri di emissione dell’idrogeno. Questo è anche indicato come il modello planetario dell’atomo. Spiegava il funzionamento interno dell’atomo di idrogeno. Bohr ha ricevuto il Premio Nobel per la fisica nel 1922 per il suo lavoro.
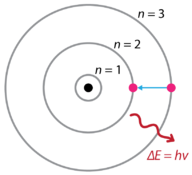
Figura 1. Modello atomico di Bohr spettri di emissione di idrogeno.
Bohr ha spiegato che gli elettroni possono essere spostati in orbite diverse con l’aggiunta di energia. Quando l’energia viene rimossa, gli elettroni ritornano al loro stato fondamentale, emettendo una quantità corrispondente di energia – un quanto di luce o fotone. Questa era la base per quella che in seguito divenne nota come teoria quantistica . Questa è una teoria basata sul principio che la materia e l’energia hanno le proprietà sia delle particelle che delle onde. Rappresenta una vasta gamma di fenomeni fisici, tra cui l’esistenza di pacchetti discreti di energia e materia, il principio di indeterminazione e il principio di esclusione.
Secondo il modello di Bohr, spesso definito come un modello planetario, gli elettroni circondano il nucleo dell’atomo in percorsi specifici consentiti chiamati orbite. Quando l’elettrone si trova in una di queste orbite, la sua energia è fissa. Lo stato fondamentale dell’atomo di idrogeno, dove la sua energia è più bassa, è quando l’elettrone si trova nell’orbita più vicina al nucleo. Le orbite che sono più lontane dal nucleo sono tutte di energia successivamente maggiore. L’elettrone non è autorizzato a occupare nessuno degli spazi tra le orbite. Un’analogia quotidiana con il modello Bohr sono i gradini di una scala. Mentre ti muovi su o giù per una scala, puoi occupare solo pioli specifici e non puoi stare negli spazi tra i pioli. Salire la scala aumenta la tua energia potenziale, mentre scendere la scala diminuisce la tua energia.
Il lavoro di Bohr ha avuto una forte influenza sulla nostra moderna comprensione del funzionamento interno dell’atomo. Tuttavia, il suo modello ha funzionato bene per una spiegazione per le emissioni dell’atomo di idrogeno, ma è stato seriamente limitato quando applicato ad altri atomi. Poco dopo Bohr ha pubblicato il suo modello planetario dell’atomo, diverse nuove scoperte sono state fatte, che ha portato, ancora una volta, una visione rivista dell’atomo.
Sommario
- Il modello di Bohr postula che gli elettroni orbitano attorno al nucleo a livelli di energia fissi.
- Orbite più lontano dal nucleo esistono a livelli di energia più elevati.
- Quando gli elettroni ritornano a un livello di energia inferiore, emettono energia sotto forma di luce.
Pratica
Usa il link sottostante per rispondere alle seguenti domande:
- Come cambia l’orbita di un elettrone?
- Su cosa si basava il modello Bohr?
- Cosa credeva Bohr riguardo alle orbite?
- Il modello di Bohr funziona per tutti gli atomi?
Recensione
- Quando Bohr propose il suo modello dell’atomo?
- Che cos’è uno stato stazionario?
- Qual è lo stato fondamentale?
- L’elettrone può occupare uno spazio tra le orbite?
Glossario
- modello planetario: un modo per descrivere il modello dell’atomo di Bohr.
- teoria quantistica: la materia e l’energia hanno le proprietà sia delle particelle che delle onde.
- stato stazionario: gli elettroni orbitano a distanza fissa dal nucleo.