Dai un’occhiata agli articoli recenti
Abstract
L’insufficienza cardiaca a bassa uscita (LoHF) è una forma non comune di insufficienza cardiaca (HF) ma che segnala HF molto avanzato. È associato con la prognosi minacciosa come pure la morbilità e la mortalità sostanziali. Tuttavia, LoHF rimane in gran parte sotto-ricercato. La descrizione tradizionale di HF si è concentrata sull’insufficienza cardiaca congestizia (CHF) caratterizzata da bassa gittata cardiaca e accompagnata da congestione polmonare/periferica. Questa attenzione ha contribuito alla sottovalutazione dei pazienti con LoHF che hanno poca o nessuna evidenza di congestione. Inoltre, i pazienti con LoHF non hanno una terapia comprovata e la scelta del trattamento appropriato dipende dalla fisiopatologia individuale e dall’eziologia sottostante. I pazienti con LoHF hanno eziologia e fisiopatologia eterogenea che evidenziano l’importanza di una comprensione approfondita delle sue caratteristiche cliniche, diagnosi e gestione clinica, che costituisce la base della presente revisione.
Parole chiave
sindrome cardiaca a bassa uscita, insufficienza cardiaca a bassa uscita, stato di bassa uscita
Introduzione
Nonostante i notevoli progressi nelle terapie mediche e chirurgiche, una gestione efficace dell’insufficienza cardiaca (HF) continua a rappresentare sfide significative per gli operatori sanitari. La sfida è riflessa da alti tassi di riammissioni ospedaliere correlate all’HF insieme ad un aumento della mortalità e della morbilità . Parte della sfida è l’eziologia molto eterogenea, la fisiopatologia e le presentazioni cliniche di diverse forme di HF, in cui alcune forme di HF hanno una scarsità di dati degli studi clinici e di conseguenza una comprensione limitata. In particolare, la descrizione tradizionale di HF è stata quasi sinonimo di insufficienza cardiaca congestizia (CHF), ma il termine CHF esclude una minoranza di pazienti affetti da HF che hanno sintomi poco o nessun dimostrabile di congestione polmonare e/o periferica . HF a basso rendimento (LoHF) inoltre è stato collegato con una prognosi inquietante e segnala HF molto avanzato. Inoltre, le differenze sintomatiche e fisiopatologiche in CHF e LoHF supportano la necessità di diversi approcci di gestione clinica . Nonostante queste differenze, le terapie HF tradizionali sono state generalizzate a tutte le forme di HF incluso CHF e LoHF, creando una necessità clinica di comprendere la fisiopatologia, la diagnosi e la gestione clinica di LoHF. In questo articolo, aggreghiamo le prove pubblicate su LoHF in termini di epidemiologia, eziologia, fisiopatologia, diagnosi e gestione clinica. L’intenzione è quella di rinnovare la conoscenza dello stato clinico di LoHF, nonché migliorare la gestione clinica di HF in generale.
Definizione
L’insufficienza cardiaca è una sindrome clinica complessa caratterizzata da difetti strutturali e / o funzionali del miocardio che portano a una compromissione del riempimento o dell’espulsione ventricolare . La complessità della sindrome è evidente nelle sue classificazioni eterogenee: destra, sinistra o bi-ventricolare in base alla posizione del difetto; acuta o cronica in base al tempo di insorgenza; frazione di eiezione conservata, borderline o ridotta in base allo stato funzionale; basso o alto rendimento in base alla gittata cardiaca (CO) e guasto in avanti o indietro in base alla direzione del flusso sanguigno. Ciascuna di queste classificazioni è significativa per la diagnosi e il trattamento dell’HF . Nonostante le diverse classificazioni, il termine CHF è stato tradizionalmente usato in modo intercambiabile con HF ma che non descrive sufficientemente LoHF a causa di diverse differenze sintomatiche e fisiopatologiche.
LoHF, noto anche come basso CO nell’HF scompensato acuto, descrive una forma di HF ad alta acuità caratterizzata da una diminuzione del CO in avanti (indice cardiaco< 2.0 L/min/m2 e pressione arteriosa sistolica < 90 mmHg) e ipoperfusione end-organo con poca o nessuna evidenza di congestione polmonare . LoHF è distinto da CHF, che descrive HF caratterizzato da CO ridotto causando congestione polmonare e periferica che porta rispettivamente a dispnea ed edema periferico . Le linee guida della Società Europea di Cardiologia (ESC) del 2005 sulla diagnosi e la gestione dell’HF suggeriscono un continuum dalla sindrome da bassa gittata cardiaca (LCOS) alla LoHF allo shock cardiogeno. Le linee guida ESC definire shock cardiogeno come prova di perfusione tissutale indotta da HF dopo la correzione del pre-carico, caratterizzata da BP sistolica < 90 mmHg o riduzione della pressione arteriosa media > 30 mmHg; la produzione di urina < 0,5 ml/kg/h; la frequenza del polso > 60 battiti al minuto (bpm) con o senza evidenza di congestione . LCOS d’altra parte è comune nei pazienti HF post-operatorio e definito come la necessità di pompa a palloncino intra-aortica post-operatoria o supporto inotropico per più di 30 minuti in un ambiente di cura acuta .
Epidemiologia
L’esatta prevalenza e incidenza di LoHF nella popolazione generale è completamente sconosciuta. Al momento, non ci sono dati epidemiologici basati sulla popolazione specifici per LoHF. Gli unici dati disponibili provengono da studi clinici a singolo centro che hanno esaminato una popolazione selezionata di pazienti affetti da HF sottoposti a chirurgia cardiaca. Nel 1975, Parr et al. ha fatto la descrizione seminale dell’entità clinica di LCOS e ha riportato un’incidenza del 25% nei bambini sottoposti a chirurgia cardiaca in base alla diminuzione del CO definito come CI < 2,0 L/min/m2. Due decenni dopo, Wernovsky et al. ha dimostrato la stessa incidenza di LCO post-operatorio in pazienti che erano stati sottoposti a operazione di commutazione arteriosa che si è verificata entro 6-18 ore dall’intervento. Studi clinici molto recenti riportano un’ampia variazione nella prevalenza, dal 3,6% (uomini) e dal 5,9% (donne) al 9,1% e al 41% e un’incidenza del 14,7%. In un recente a lungo termine (vent’anni: 1990-2009) studio clinico prospettico che ha coinvolto 25.176 pazienti chirurgici consecutivi con innesto di by-pass coronarico (CABG), Algarni et al. la prevalenza di LCO post-operatorio è diminuita significativamente dal 9,1% (1990-1994) al 2,4% (2005-2009) .
Eziologia
L’eziologia del LoHF è multifattoriale. Generalmente, è una conseguenza della disfunzione del ventricolo sinistro (LV), del ventricolo destro (RV) o del ventricolo sistemico (anatomia del ventricolo singolo) e può includere una o entrambe le disfunzioni sistoliche e/o diastoliche . Le perturbazioni nel riempimento ventricolare o nell’espulsione portano a LoHF, che è una complicanza frequente nei pazienti sottoposti a chirurgia cardiaca o in stato di shock cardiogeno . Può presentarsi come un peggioramento acuto nei pazienti con HF cronica o può essere un episodio transitorio e reversibile con risoluzione del trigger acuto. È una sindrome clinica considerata la via finale di una moltitudine di malattie che colpiscono la funzione cardiaca. Non è sufficiente fare diagnosi di LoHF, la causa sottostante o trigger deve anche essere determinata e, se possibile, trattata . La tabella 1 fornisce un riassunto delle condizioni che causano uno stato di bassa produzione nei pazienti con HF.
Tabella 1. L’eziologia di basso-stato di output da fisiopatologia
|
Meccanismi |
Causale Condizioni |
|
la Perdita di contrattilità del miocardio |
malattia Coronarica, miocardiopatia miocardite cronica scompensata HF, post-chirurgia cardiaca, tossine, l’alimentazione (obesità)m malattie a carattere infiltrante, fine insufficienza renale, la malattia di Chagas o infezione da HIV |
|
Alterato riempimento ventricolare o l’espulsione |
Pericardite, versamento pericardico, il tamponamento cardiaco, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
L’attuale comprensione della fisiopatologia del LoHF si basa in gran parte sull’evidenza degli studi clinici su pazienti CABG post-operatori . Il segno distintivo patologico è CO eccessivamente depresso accompagnato da ipoperfusione end-organo. Fisiologicamente, il cuore funziona come una pompa per distribuire il sangue ossigenato in quantità sufficiente a soddisfare i bisogni metabolici dei tessuti. Poiché le esigenze metaboliche variano in situazioni normali e stressanti, anche la CO varia per soddisfare questa domanda dinamica . La fase diastolica del ciclo cardiaco è fondamentale nei pazienti con LoHF perché è durante il rilassamento ventricolare che si verifica il riempimento coronarico per fornire ossigenazione miocardica . La frequenza cardiaca (HR) è anche significativa nella diastole perché HR troppo rapido impedisce al cuore di raggiungere il completo rilassamento e perfusione miocardica. Pertanto, la disfunzione cardiaca deriva da un disturbo cardiaco strutturale (anomalia cardiaca residua) o funzionale (disturbi del riempimento o dello svuotamento ventricolare o aumento della resistenza vascolare sistemica).
Fisiopatologicamente, CO dipende dall’HR e dal volume della corsa (SV) (CO = HR * SV). Il volume della corsa a sua volta è il prodotto netto di tre variabili di circolazione correlate tra loro: precarico, postcarico e contrattilità. Se uno o più di questi componenti è compromesso, può svilupparsi uno stato di gittata cardiaca bassa . Inoltre, questi componenti influenzano sia le fasi sistoliche che diastoliche del ciclo cardiaco causando disfunzione sistolica LV/RV e/o disfunzione diastolica nota anche come HF con frazione di eiezione conservata (Figura 1). Altre condizioni come la cardiopatia valvolare, l’ipertensione polmonare (PH), la disfunzione meccanica della valvola e l’insufficienza respiratoria possono precipitare o aggravare lo sviluppo di LoHF .
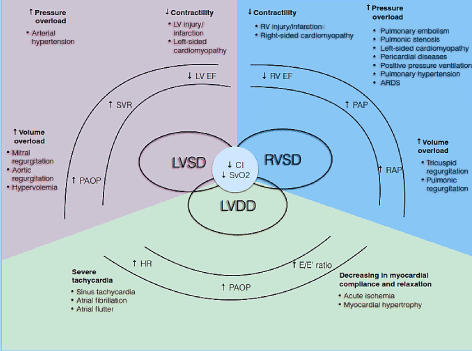
Figura 1. Meccanismi fisiopatologici di insufficienza cardiaca a bassa uscita
Cause comuni e tipiche; i sintomi di LoHF sono inclusi. I principali meccanismi fisiopatologici di LoHF è la disfunzione ventricolare: Disfunzione sistolica LV e / o diastolica e disfunzione sistolica RV, tutte caratteristiche patologiche comuni di indice cardiaco ridotto (CI) e ridotta saturazione di ossigeno venoso misto (SvO2). La disfunzione sistolica LV e RV deriva da un aumento del sovraccarico di pressione, da un aumento del sovraccarico di volume e da una diminuzione della contrattilità, mentre la disfunzione diastolica LV deriva da una grave tachicardia e da una diminuzione della compliance e del rilassamento del miocardio. Adattato da Lomivorotov et al. 2017, pag.
Disfunzione ventricolare sinistra
La disfunzione sistolica ventricolare sinistra (o frazione di eiezione ventricolare sinistra depressa) è il meccanismo fisiopatologico più comune osservato nei pazienti con LoHF. Le variabili di circolazione che influenzano la funzione sistolica del ventricolo sinistro sono precarico, dopo carico e contrattilità . Generalmente, la disfunzione sistolica LV è una conseguenza della perdita o riduzione dei cardiomiociti funzionali derivanti da necrosi a causa di alterata circolazione coronarica e ischemia, lesioni da riperfusione o il fenomeno naturale meno compreso dell’apoptosi cardiomiocitaria . La perdita di cardiomiociti funzionali può essere transitoria come visto durante lo stordimento miocardico definito come un miocardio vitale recuperato dalla riperfusione coronarica, che presenta una disfunzione post-ischemica prolungata dopo la riperfusione . La perdita di cardiomiociti funzionali può anche essere refrattaria all’inversione in condizioni come infezione; tachicardia; malattia valvolare; disturbi metabolici come acidosi, ipoglicemia, ipocalcemia; esposizione a tossine cardiache ambientali e sostanze chimiche; cardiomiopatia dilatativa idiopatica (DCM); malattie genetiche come DCM familiare, cardiomiopatia ipertrofica e distrofie muscolari . La risposta cardiaca alterata al precarico causa una drastica diminuzione della CO e della consegna di ossigeno ad altri organi chiave del corpo, pressione atriale elevata, pressione del cuneo capillare ed edema polmonare cardiogeno. Sebbene i cambiamenti compensatori nel LV si adattino alla pressione arteriosa sistemica relativamente alta, un aumento significativo del postcarico può indurre disfunzione sistolica del LV .
Disfunzione diastolica ventricolare sinistra
Sebbene non comune, LoHF può svilupparsi in pazienti con disfunzione diastolica ventricolare sinistra con LVEF conservato. La condizione deriva dall’incapacità della camera ventricolare di riempire con un adeguato volume di sangue nonostante il normale precarico, che si presenta come disfunzione diastolica . Condizioni di base come tachicardia grave, diminuzione della compliance miocardica o rilassamento ventricolare anormale compromettono il rilassamento e il riempimento del ventricolo sinistro durante la fase diastolica del ciclo cardiaco. A livello di cardiomiociti, queste condizioni sono associate alla rimozione del calcio dal citosol e dall’omeostasi del calcio, all’adeguatezza del distacco del ponte incrociato e al disturbo intrinseco funzionale dell’elemento citoscheletrico . Il distacco del ponte trasversale può contribuire al tempo di rilassamento isovolumico ritardato, che si traduce in una diminuzione del volume della corsa del ventricolo sinistro, specialmente a un’ora più alta . Il rilassamento di LV inoltre dipende dalla ricaptazione reticolare sarcoplasmica dello calcium del calcio e dalla segnalazione dell’ossido nitrico, che inoltre facilitano il distacco del ponte trasversale. Poiché il processo di distacco del ponte incrociato consuma energia, può causare un deficit di energia miocardica e di conseguenza rallentare il rilassamento del miocardio LV .
Nonostante la disfunzione diastolica sia un fenomeno diffuso visto in fino al 70% dei pazienti cardiaci post-operatori , la disfunzione diastolica da sola non è sufficiente a spiegare lo sviluppo di HF acuto. Nell’impostazione di altre condizioni cliniche come la fibrillazione atriale (AF), alterata circolazione coronarica, e ipertensione arteriosa, disfunzione diastolica può provocare stato scompensato, e quindi creduto di essere un segno precoce di ischemia miocardica . La relazione dinamica tra le funzioni diastolica e sistolica LV contribuisce anche alla disfunzione diastolica nei pazienti con LoHF. La stimolazione della catecolamina inotropa colpisce sia la diastole che la sistole e può migliorare la disfunzione diastolica. La LVEF depressa porta ad un aumento del volume sistolico finale e prolunga la fase diastolica del ciclo cardiaco .
Disfunzione di RV
In LoHF, particolarmente dopo chirurgia dell’arteria coronaria, i meccanismi patofisiologici principali di disfunzione di RV includono il precarico aumentato, il postcarico aumentato, la perfusione destra alterata dell’arteria coronaria e la contrattilità diminuita . In contrasto con l’arteria coronaria sinistra, la perfusione dell’arteria coronaria destra si verifica sia durante la diastole che durante la sistole. La presenza di PH provoca un aumento della pressione RV che porta alla diminuzione della perfusione dell’arteria coronaria destra, il che spiega l’importanza di fornire una circolazione coronarica sinistra e destra ottimale . Nei pazienti sottoposti a chirurgia coronarica, la disfunzione RV può svilupparsi come risultato di una combinazione di meccanismi. Ischemia RV perioperatoria e infarto sono le principali cause di ridotta contrattilità RV. Tricuspide o rigurgito polmonare re cause comuni di aumento del volume precarico mentre la malattia valvolare sinistra o cardiomiopatia, PH o embolia polmonare (PE), sindrome da distress respiratorio acuto e ventilazione ad alta pressione positiva sono cause comuni di sovraccarico di pressione . Poiché il RV consente normalmente la perfusione a bassa pressione del sistema vascolare polmonare, è altamente sensibile anche a moderati aumenti della pressione arteriosa polmonare (PAP). Il fallimento di RV può svilupparsi nell’impostazione del PH o della contrattilità compromessa associata a una rapida progressione della dilatazione RV che porta ad un aumento della pressione RV diastolica . Queste alterazioni fisiologiche possono causare lo spostamento del setto inter-ventricolare verso una camera LV già sotto-riempita e di conseguenza causare una riduzione del precarico LV e una diminuzione di CO .
Fattori di rischio
I fattori di rischio per LoHF rimangono un’area poco ricercata. Tuttavia, pochi dati disponibili da studi clinici su HF e da pazienti LCOS post-operatori forniscono preziose informazioni sui fattori di rischio e sui predittori di LoHF. Nell’analisi di 452 pazienti ospedalizzati con HF scompensata e bassa gittata cardiaca, fattori di rischio significativi per LoHF sono stati la malattia di Chagas (rischio relativo : 3,66), la frazione di eiezione depressa (RR: 2,41), l’iponatriemia (RR: 1,62) e la disfunzione renale (RR: 1,92) . I fattori di rischio per LoHF post-operatorio includono compromissione della funzione LV (< 50%), CABG alla pompa, intervento chirurgico di emergenza o bypass cardiopolmonare (CPB), rivascolarizzazione incompleta, età > 65 anni e una presenza combinata di diabete mellito e disfunzione renale pre-operatoria . Oltre ai fattori di rischio del paziente e dell’operazione, i predittori biochimici di LoHF nei pazienti post-operatori sono bassi livelli di emoglobina ,conta linfocitaria totale < 2000 cellule / µL e livelli preoperatori di peptidi natriuretici sierici . Negli ultimi due decenni, ci sono stati cambiamenti nelle tendenze di alcuni fattori di rischio riconosciuti. Fattori come l’ipertensione, il sesso femminile, la malattia a tre vasi e la malattia principale sinistra non sono più statisticamente significativi mentre il rischio associato alla frazione di eiezione preoperatoria depressa è raddoppiato .
Diagnosi
Non esistono linee guida di consenso o criteri diagnostici comprovati per i pazienti con LoHF. Inoltre, i segni e i sintomi clinici non sono specifici. In assenza di linee guida standardizzate, la diagnosi di solito si basa sulla raccolta accettata di aberrazioni emodinamiche e fisiologiche utili per aumentare il sospetto clinico di LoHF . La diagnosi di LoHF da sola spesso non è sufficiente. Anche la causa dello stato di bassa uscita deve essere stabilita. In alcune cause di stato a basso rendimento come PE o MI, trattare la causa sottostante è la considerazione più importante e quindi è imperativo fare la diagnosi. Poiché i pazienti con LoHF sono spesso instabili, è anche comune che la valutazione clinica, la diagnosi e il trattamento si verifichino contemporaneamente più nelle impostazioni di cura acuta .
Segni e sintomi
La bassa gittata cardiaca come caratteristica presentante dell’HF scompensata acuta è rara, interessando solo l ‘ 8,9-9,6% dei pazienti ospedalizzati con HF . LoHF può condividere molte caratteristiche cliniche con CHF, ma ci sono differenze notevoli che possono supportare o guidare le decisioni diagnostiche successive. Eccessivo affaticamento e aumento dell’intolleranza all’esercizio fisico sono importanti segni iniziali notati dai pazienti con LoHF anche prima della diagnosi . Inoltre, i pazienti con LoHF presentano comunemente agitazione, confusione e/o livelli ridotti di coscienza; periferie fredde/vasocostritte o tempo di ricarica capillare ritardato; ipotensione; tachicardia o bradicardia; polso debole; aumento della pressione venosa giugulare; dispnea e ipossiemia; e oliguria/anuria . Questi segni e sintomi possono differire tra bassa perfusione e congestione nei pazienti con HF (Tabella 2).
Tabella 2. Sintomi e segni di bassa perfusione vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Le linee guida ESC 2016 sulla diagnosi e la gestione dell’HF sottolineano l’importanza di ottenere una storia dettagliata del paziente e un esame fisico su tutti i pazienti sospettati di avere HF . Storia dettagliata dal paziente, o parenti e amici se il paziente è troppo malato, dovrebbe concentrarsi su come ottenere informazioni sui sintomi, precedenti e attuali condizioni cardiache ed extra-cardiache in grado di precipitare o aggravare HF, esposizione a fattori di rischio di HF o di stato a bassa uscita, e la storia del farmaco per le condizioni mediche precedenti e attuali . Oltre alla storia del paziente, si raccomanda l’esame fisico a tutti i pazienti con LoHF per valutare gli indicatori clinici per emodinamica, perfusione periferica, congestione, eziologia sottostante e patologia valvolare. I parametri emodinamici di interesse includono la pressione sanguigna, il ritmo HR e cardiaco, il ritmo galoppo, la saturazione di ossigeno e la frequenza respiratoria . I test per la perfusione periferica dovrebbero includere i livelli di coscienza, la temperatura periferica della pelle / centrale, il tempo di ricarica capillare e la produzione di urina. I test per la congestione comprendono aumento della pressione venosa giugulare, edema periferico/polmonare, epatomegalia, ascite e versamenti pleurici. I test per l’eziologia sottostante dovrebbero includere l’esame cardiovascolare e il suono e i mormorii del cuore. Infine, l’evidenza di disfunzione valvolare dovrebbe includere lo sfregamento pericardico e l’evidenza di versamento pericardico con o senza tamponamento cardiaco .
La combinazione della storia del paziente e dell’esame fisico si è dimostrata preziosa nella valutazione dello stato emodinamico e del riconoscimento di LoHF . Nel 1976, Forrester et al. condotto esame fisico di pazienti con infarto miocardico acuto e identificato quattro profili emodinamici (A, B, L e C) come illustrato nella Figura 2. I profili emodinamici si basano sulla presenza o assenza di congestione polmonare (pressione polmonare a cuneo capillare > o ≤ 18 mmHg) e sull’adeguatezza della perfusione (CI > 2,2 L/min/m2). Profilo A rappresenta nessuna congestione / ipoperfusione; Profilo B congestione senza ipoperfusione; Profilo C ipoperfusione senza congestione; e Profilo L congestione e ipoperfusione . I pazienti con LoHF rientrano nei profili L e C (ipoperfusione ± congestione basata su Nohria et al. dimostrazione che i profili L e C hanno un CI medio di 1,6 L/min/m2 e 1,9 L/min/m2 rispettivamente.
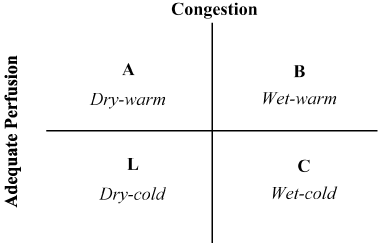
Figura 2. Presentazione schematica del profilo clinico di insufficienza cardiaca scompensata acuta
La congestione è valutata dalla presenza di ortopnea, distensione venosa giugulare, rantoli polmonari, reflusso epatojugulare, ascite, edema periferico, reflusso addominale e onda quadra di Valsalva. La bassa perfusione è stata valutata dalla presenza di una pressione del polso ristretta, alterazioni del pulsus, estremità fredde, forse assonnate, diminuzione dei livelli sierici di sodio e peggioramento della funzionalità renale. Adattato da Nohria, et al.
Elettrocardiogramma (ECG): sia le linee guida AHA che ESC sull’HF raccomandano che l’elettrocardiogramma (ECG) debba essere eseguito il prima possibile in tutti i pazienti sospettati di avere HF. L’ECG può dimostrare una varietà di anomalie ed è molto improbabile che sia normale nei pazienti con HF. Può anche fornire evidenza di una eziologia sottostante di disfunzione cardiaca, tra cui bradicardia, blocco atrioventricolare, tachicardia sinusale, tachiaritmia atriale o ventricolare, ischemia, ipertrofia ventricolare sinistra e complessi a bassa tensione .
Test di laboratorio di base: Le linee guida AHA e ESC HF raccomandano anche test di laboratorio di base nella valutazione clinica iniziale per supportare la diagnosi di HF o della causa dello stato di bassa uscita. Gli esami del sangue devono essere eseguiti in tutti i pazienti con sospetta HF. Emoglobina (Hb > 10 g / dL) indica un apporto ottimale di ossigeno ai tessuti), l’anemia cronica è comune nell’HF cronico e un marcato aumento dei globuli bianchi fa sospettare una diagnosi alternativa. Test per elettrolita sierico per determinare i livelli di potassio, magnesio e calcio. Test di urea e creatinina per valutare l’ipoperfusione renale e la disfunzione comune nell’HF. Test per compromissione della funzionalità epatica, che suggeriscono compromissione della RV e / o congestione epatica. Test del glucosio per valutare l ‘ eventuale ipoglicemia che può compromettere la funzionalità cardiaca. Test di funzionalità tiroidea per ipo-o iper-tiroidismo che può causare infarto miocardico intrinseco. Infine, i test per i peptidi natriuretici sierici i cui livelli elevati indicano un aumento dello stress della parete ventricolare ma che non rileva bruschi cambiamenti nelle pressioni di riempimento ventricolare a causa della loro lunga emivita .
Test di imaging cardiaco: l’imaging cardiaco svolge un ruolo centrale nella diagnosi di HF, nonché nel monitoraggio e nella terapia guida. L’ecocardiografia è la modalità preferita per ragioni di accuratezza, disponibilità, sicurezza ed economicità . Può essere integrato da altre modalità di imaging selezionate in base alla capacità di rispondere a specifiche domande cliniche considerando controindicazioni e rischi .
Ecocardiografia: L’ecocardiografia è fortemente raccomandata per tutti i pazienti sospetti a causa della sua capacità di confermare o escludere la diagnosi clinica di LoHF, di valutare SV e le sue variazioni e di determinare la causa dello stato di bassa uscita . L’ecocardiografia transtoracica deve essere eseguita il prima possibile dopo la diagnosi clinica di bassa gittata cardiaca. Non solo misura l’estensione della disfunzione sistolica e diastolica, ma fornisce anche preziose informazioni sulla morfologia ventricolare, disfunzione valvolare, malattia miocardica e pericardica e anomalie del movimento della parete regionale . L’ecocardiografia valuta la funzione sistolica misurando LEVF, dove > 45-50% è considerato normale. D’altra parte, la funzione diastolica viene valutata utilizzando mitrale nei modelli di flusso, flusso venoso polmonare e Doppler tissutale all’anello mitrale, mentre CO e SV vengono valutati utilizzando il principio Doppler. La pressione dell’arteria polmonare (PAP) può essere stimata misurando la velocità del getto di rigurgito. Alto PAP in presenza di RV dilatato con appiattimento del setto o inchinandosi nel LV che indica un aumento acuto della pressione RV che solleva il sospetto clinico di PE come causa di uno stato di uscita basso .
Radiografia del torace: la radiografia del torace potrebbe essere presa in considerazione nei pazienti sospettati di avere LoHF. Gli indicatori importanti che dovrebbero considerare per la valutazione includono il cuore allargato che indica cardiomegalia o ipertrofia di LV; congestione venosa polmonare che indica la pressione di riempimento elevata di LV; e versamento pleurico che indica elevata pressione ventricolare sinistra, embolia polmonare o chirurgia post-cardiaca (.
Angiografia coronarica: Le indicazioni per l’angiografia coronarica nei pazienti con LoHF devono essere in accordo con la raccomandazione delle pertinenti linee guida di consenso per l’HF . Nei pazienti affetti da HF che presentano dolore toracico ed evidenza di infarto miocardico con elevazione di ST (STEMI) all’ECG, la rivascolarizzazione mediante intervento coronarico percutaneo primario deve essere eseguita il prima possibile. L’angiografia coronarica deve essere presa in considerazione anche in pazienti con arresto post-cardiaco di eziologia ischemica, quando vi è evidenza di HF e in pazienti che si sono ripresi da uno stato di bassa produzione quando la causa non è stata determinata .
Gestione clinica
La presenza di LoHF rappresenta una condizione ad alto rischio che richiede un trattamento tempestivo, ma manca di linee guida standardizzate per la gestione clinica . Di conseguenza, i medici normalmente considerano la fisiopatologia individuale per selezionare la strategia di trattamento più appropriata . Nei pazienti con LoHF acuto, le linee guida ESC HF del 2016 raccomandano l’uso di profili emodinamici (basati sulla presenza o assenza di congestione e adeguatezza della perfusione) per guidare la gestione clinica . Per i pazienti con LoHF nel profilo L (senza congestione ma ipoperfuso) e nel profilo C (sia congestione che ipoperfuso) in stato di scompenso acuto, gli obiettivi del trattamento di emergenza possono includere la rianimazione dei pazienti, il ripristino dell’ossigenazione, il miglioramento della perfusione degli organi e l’ottimizzazione dell’emodinamica (volume dell’ictus e CO) e la risoluzione dei sintomi. Altri obiettivi successivi includono il monitoraggio ottimale e stabilire la causa sottostante della bassa gittata cardiaca e trattare la causa se reversibile . Attualmente, gli obiettivi terapeutici disponibili per LoHF stanno ottimizzando l’ossigenazione tissutale, stabilizzando la circolazione e trattando le cause reversibili dello stato a basso rendimento (Figura 3).
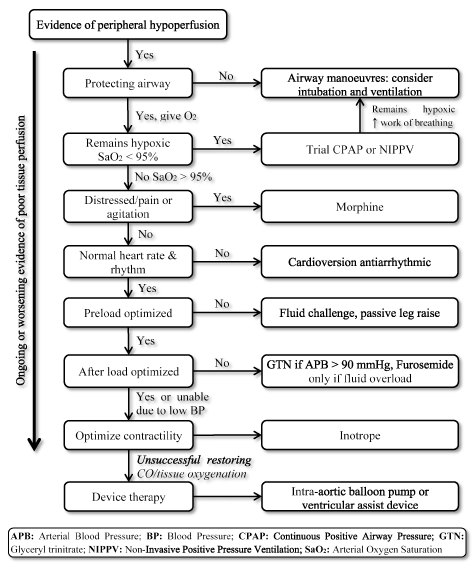
Figura 3. Algoritmo di trattamento per insufficienza cardiaca a bassa uscita
Trattamento degli obiettivi LoHF migliorare l’ossigenazione tissutale e stabilizzare la circolazione sulla base di sintomi in corso o peggioramento della perfusione tissutale. Il trattamento inizia migliorando la ventilazione utilizzando l’erogazione di ossigeno ad alto flusso, la pressione positiva continua delle vie aeree (CPAP) o la ventilazione non invasiva a pressione positiva (NIPPV). Se non ha successo, cardioversione o farmaci antiaritmici sono dati per normalizzare la frequenza cardiaca, fluido sfida per ottimizzare pre-carico, e / o vasodilatatori e inotropi per manipolare e migliorare la contrattilità rispettivamente. Se la ventilazione e i farmaci precedenti non sono riusciti a ripristinare la gittata cardiaca e/o l’ossigenazione tissutale, la terapia con dispositivi con pompa a palloncino intra-aortica o dispositivi di assistenza ventricolare può essere considerata
Ottimizzare l’ossigenazione tissutale (strategie ventilatorie)
La gestione clinica dei pazienti con LoHF inizia spesso con la valutazione delle vie aeree, della respirazione e della Le strategie del ventilatore quali le vie aeree orofaringee o nasofaringee sono aggiunte comuni usate per ristabilire o mantenere la pervietà delle vie aeree in pazienti di LoHF con i livelli diminuiti di coscienza dovuto perfusione cerebrale diminuita. Deve essere presa in considerazione un’ulteriore intubazione endotracheale se il paziente rimane con vie aeree compromesse . Se i pazienti continuano a rimanere ipossici (SaO2 < 95%), si può considerare la massimizzazione dell’erogazione di ossigeno utilizzando ossigeno ad alto flusso, pressione positiva continua delle vie aeree (CPAP) o ventilazione non invasiva a pressione positiva (NIPPV). Nei pazienti senza miglioramento, può essere presa in considerazione l’intubazione o la ventilazione .
Stabilizzare la circolazione
La gittata cardiaca (CO) è una funzione di HR e SV. A sua volta, SV dipende da quattro variabili di circolazione: frequenza cardiaca, precarico, contrattilità e postcarico. L’ottimizzazione di tutte queste variabili migliorerà la CO nei pazienti con LoHF . In ambito clinico, le strategie per aumentare la CO dipendono dalla causa sottostante e dalla variabile di circolazione interessata . Gli interventi clinici comprendono la regolazione del volume, il supporto farmacologico e la terapia del dispositivo.
Frequenza cardiaca / Ritmo: Come parte della risposta fisiologica del corpo, aumentando HR aumenta CO. Troppo veloce o lento HR ha un effetto negativo sulla CO. Nei pazienti con LoHF con tachicardia (HR a riposo troppo veloce > 100 bpm) che sono afflitti, irrequieti e dispnoici, la morfina può essere somministrata per alleviare la dispnea, il dolore e l’agitazione, nonché è un venodilatatore lieve per ridurre il postcarico, specialmente nei pazienti CPAP o NIPPV . Se HR < 40 bpm con evidenza di compromissione emodinamica e/o compromissione della CO, devono essere eseguiti farmaci che aumentano l’HR (atropina e anticolinergici ) o interventi come la stimolazione transcutanea / transvenosa. La cardioversione elettrica urgente deve essere presa in considerazione in LoHF selezionato con tachicardia ventricolare/sopraventricolare o AF rapida con evidenza di compromissione cardiovascolare .
Ottimizza il precarico (regolazioni del volume): La misurazione del precarico è essenziale per la sua ottimizzazione. È raccomandato nei pazienti con evidenza clinica di alterata perfusione periferica. Una sfida fluida dovrebbe essere eseguita per valutare la reattività del precarico. Infusione rapida di 250 ml di liquido (cristalloide o colloide) per oltre cinque minuti e valutazione obiettiva dell’effetto su SV. Se l’effetto è un aumento o una diminuzione > 10%, il paziente deve continuare a ricevere boli fluidi per ottimizzare il precarico fino a quando non risponde più al fluido . Per i pazienti con segni di congestione ed edema polmonare che non richiedono il bolo fluido, un aumento passivo della gamba può essere fatto – sollevando la gamba del paziente a 45 gradi per escludere la necessità di sfida fluida. Se la risposta è favorevole, si può dare una vera sfida fluida .
Manipolare postcarico (supporto farmacologico): Postcarico è la resistenza contro la quale il ventricolo sta espellendo il sangue, a volte stimato come SVR. Il postcarico deve essere ridotto nei pazienti con LoHF che presentano un elevato postcarico, bassa CO, evidenza di scarsa perfusione periferica ed edema polmonare. Il supporto farmacologico che utilizza vasodilatatori deve essere somministrato a pazienti con LoHF con BP sistolica ≥110 mmHg. Nei pazienti con pressione sistolica < 90 mmHg e pressione arteriosa media< 65 mmHg, i vasodilatatori non sono raccomandati a causa del rischio di ipotensione, che può complicare la perfusione d’organo. In questi pazienti, gli inotropi sono raccomandati come prima linea di trattamento .
Migliorare la contrattilità (supporto farmacologico): Se il paziente persiste con evidenza di ipoperfusione tissutale o ridotta erogazione di ossigeno nonostante interventi per frequenza cardiaca, precarico e postcarico, deve essere preso in considerazione un trattamento per migliorare la contrattilità. Nel frattempo, si deve continuare ad ottimizzare l’erogazione di ossigeno per ottenere emoglobina ≥10 g/dl e garantire una saturazione ottimale di ossigeno (SaO2). I fattori che influenzano negativamente la contrattilità miocardica sono iperkaliemia, ipomagnesiemia, ipocalcemia, acidosi grave, ipossia e ipoglicemia, che devono essere corretti. Gli inotropi sono raccomandati per migliorare la contrattilità e successivamente CO in pazienti con LoHF con BP bassa e / o IC basso in presenza di segni di scarsa perfusione periferica o congestione . Tuttavia, il supporto farmacologico con Dobutamina (un inotropo) deve essere usato con cautela nei pazienti che hanno tachicardia o AF perché aumenta la conduzione del nodo AV e può precipitare ritmi ventricolari veloci . D’altra parte, levosimendan è raccomandato nei pazienti con LoHF con ischemia miocardica acuta o post cardiochirurgia poiché non aumenta la domanda di ossigeno miocardico . L’effetto a lungo termine degli inotropi potrebbe essere dannoso e quindi il loro uso dovrebbe essere interrotto una volta raggiunta la stabilità. I vasopressori non dovrebbero essere il farmaco di prima linea negli stati a basso rendimento in quanto aumentano la SVR e successivamente compromettono la CO. Tuttavia, una terapia doppia dei vasopressori e dell’inotropo è raccomandata in pazienti che hanno sepsi come la causa di fondo dello stato di basso-uscita .
Terapia con dispositivi: la terapia con dispositivi deve essere presa in considerazione nei pazienti con LoHF quando le terapie mediche ottimali non hanno avuto successo nel ripristino della CO e dell’ossigenazione tissutale. Le terapie comuni del dispositivo includono la pompa a palloncino intra-aortica (IABP) e il dispositivo di assistenza ventricolare (VAD). L’uso di IABP è comune nei pazienti con LoHF con cardiopatia ischemica, intervento pre o post-percutaneo o chirurgia post-cardiaca. IABP comprende un palloncino inserito nell’aorta attraverso l’arteria femorale. Il palloncino si gonfia durante la diastole e si sgonfia durante la sistole per aumentare la pressione diastolica e di conseguenza la perfusione coronarica, e riduce il postcarico aumentando così la CO . D’altra parte, l’uso di VAD è raro. Può essere utilizzato solo in centri specializzati. È comunemente usato come ponte al trapianto cardiaco in pazienti con qualità di vita favorevole o al recupero in pazienti con miocardite acuta .
Trattamento delle cause sottostanti
Alcune cause di stato di bassa produzione nei pazienti con LoHF possono essere invertite con terapie specifiche. Le cause reversibili devono essere identificate precocemente durante la valutazione clinica iniziale. Queste cause includono infarto miocardico acuto, tamponamento cardiaco, pneumotorace da tensione, embolia polmonare e insufficienza valvolare acuta . (Tabella 3).
Meta-analisi della diagnosi e della gestione clinica
La base della diagnosi clinica di LoHF è stata l’evidenza ecocardiografica di disfunzione sistolica LV/RV e / o disfunzione diastolica LV accompagnata da evidenza di ridotta CO e SvO2 . Profili emodinamici basati su misure di congestione e perfusione sono stati utilizzati per classificare i pazienti HF acuti in quattro profili: secco-caldo (A), umido-caldo (B), secco-freddo (L) e umido-freddo (C) e utili nell’identificazione dei pazienti con LoHF . I pazienti con LoHF sono stati classificati in Profili (L) e (C) in base alla presenza/assenza di congestione e/o all’inadeguatezza della perfusione periferica . Questi due profili emodinamici hanno costituito la base per la selezione dei pazienti con LoHF negli studi clinici e forniscono una semplice valutazione sul posto letto per aiutare a classificare i pazienti al momento della presentazione e per guidare la selezione delle terapie iniziali . L’obiettivo della presente meta-analisi è quello di aggregare le prove pubblicate delle caratteristiche diagnostiche comuni e dei risultati del trattamento per i pazienti con LoHF.
Strategia di ricerca
Tre importanti database online (PubMed, EMBASE e Cochrane) sono stati sistematicamente ricercati dall’inizio a dicembre 2018 per studi che indagano la diagnosi e la gestione clinica di LoHF. Per evitare di trascurare gli studi che non menzionavano LoHF nel titolo o nell’abstract, sono stati inclusi i primi 200 articoli classificati come pertinenti recuperati con una ricerca di Google Scholar a testo intero. Non sono stati applicati limiti di tempo di pubblicazione o di lingua. Ulteriori studi sono stati identificati attraverso una ricerca manuale dell’elenco di riferimenti dagli studi inclusi e da articoli di revisione pertinenti, che sono stati poi sottoposti ai criteri di inclusione. I criteri di ricerca includevano popolazione di interesse (pazienti con LoHF o LCOS), test diagnostici di interesse (ecocardiografia e profili emodinamici) e intervento di interesse (strategie del ventilatore, regolazione del volume, supporto farmacologico e terapia del dispositivo). Gli studi sono stati inclusi se soddisfacevano i seguenti criteri: a) includevano pazienti con LoHF; (b) diagnosticati utilizzando ecocardiografia e profili emodinamici; (c) pazienti trattati per la stabilizzazione emodinamica; e (d) risultati del trattamento segnalati. Nei casi di studi che riportavano dati duplicati, è stato incluso solo lo studio che ha fornito il maggior numero di pazienti. Sono stati esclusi gli abstract della conferenza, le relazioni sui casi e gli articoli di revisione.
Selezione dello studio
La figura 4 illustra il processo di ricerca e screening utilizzato per includere gli studi ammissibili. Due revisori hanno esaminato in modo indipendente tutti i titoli e gli abstract recuperati dalla ricerca sistematica online. Gli abstract che includevano popolazione, intervento e risultati di interesse sono stati inclusi per la ricerca full-text. Successivamente, i due revisori hanno anche esaminato in modo indipendente gli articoli full-text rispetto ai criteri di inclusione. In caso di discrepanza, è stato risolto attraverso la discussione e il consenso.

Figura 4. Diagramma di flusso del processo di ricerca e inclusione della letteratura
Raccolta dei dati
Due revisori hanno estratto in modo indipendente i dati dagli studi inclusi e qualsiasi discrepanza è stata risolta attraverso il consenso. I principali dati estratti sono stati i dati del profilo ecocardiografico ed emodinamico e il trattamento utilizzato e l’esito del trattamento sull’emodinamica (indice cardiaco, PCWP) e sulla mortalità. Oltre a questi dati principali, i due revisori hanno anche estratto i dati sulle caratteristiche dello studio, le caratteristiche dei pazienti e la durata del follow-up (Tabella 4).
Analisi statistica
I risultati di interesse riportati in più di uno studio sono indice cardiaco, PCWP e mortalità. Per ciascun risultato, sono state estratte statistiche riassuntive (media ± deviazione standard) prima e dopo l’intervento o la differenza tra il basale e dopo il trattamento. Queste statistiche riassuntive sono state estratte separatamente per il trattamento e per i gruppi di controllo/placebo. Gli esiti diagnostici e gli effetti del trattamento sono stati misurati in base alla differenza di mezzi prima e dopo l’intervento e all’intervallo di confidenza del 95% associato. I terreni forestali sono stati utilizzati per esaminare visivamente l’eterogeneità (I2) tra gli studi. L’effetto diagnostico e terapeutico combinato e l’intervallo di confidenza associato al 95% sono stati stimati utilizzando un effetto fisso (I2 < 49%) o un modello di effetto casuale (I2 > 50%). Il valore P > 0,05 è stato considerato significativo dal punto di vista statistico.
Risultati
Caratteristiche dello studio
Dodici (12) studi randomizzati controllati (RCT) hanno soddisfatto i criteri di inclusione. Sette (7) studi hanno arruolato pazienti con LoHF e i restanti cinque (5) hanno arruolato pazienti con HF sottoposti a chirurgia cardiaca con bassa gittata cardiaca. La maggior parte degli studi clinici pubblicati (10) ha studiato il farmaco confrontando l’effetto di diversi tipi di inotropi sull’emodinamica e sulla prevenzione della morte: solo dobutamina , dobutamina e dopamina ; levosimendan e dobutamina e levosimendan e placebo . Dei restanti due studi clinici, ciascuno ha studiato vasodilatatore (nitroprussiato) e placebo , e terapia dispositivo (IABP) e inotropo (levosimendan) da solo o in combinazione con IAPB . Complessivamente, i 12 studi clinici hanno arruolato 3.738 pazienti, età media 64 anni (range = 55-74 anni), con una maggioranza di sesso maschile (78%).
Sintesi dei risultati
I dati diagnostici su LoHF erano incoerenti. Attraverso i dodici studi clinici, non è emersa alcuna definizione comune di LoHF che sarebbe stata utile per guidare la diagnosi. Emodinamica criteri di inclusione dei pazienti in studi incluso CI < 2.0 L/min/m2 , CI < 2.2 L/min/m2 o CI < 2,5 L/min/m2 e PCWP > 15 mmHg o ≥18 mmHg . La definizione, inoltre, varia tra gli studi post-condizione operativa con ipotensione (pa sistolica < 90 mmHg per > 30 minuti) o la necessità di inotropi di supporto per mantenere la pa sistolica > 90 mmHg e la fine di ipoperfusione d’organo (freddo periferie, la produzione di urina < 30 ml/ora) . Lo shock cardiogeno è stato descritto come una sindrome complessa che coinvolge una cascata di disfunzione ventricolare sinistra acuta, diminuzione della CO, ipotensione e ipoperfusione tissutale .
Le figure 5 e 6 mostrano trame forestali per la media standardizzata dell’indice cardiaco al basale e dopo la terapia inotropo o vasodilatatrice rispettivamente. L ‘ indice cardiaco basale è aumentato da una media di 1,93 (95% IC: 1,91-1,95) a una media post-trattamento di 2,82 (95% IC: 2,80-2,84). La figura 7 mostra una trama forestale per la differenza media standard (SMD) dell’indice cardiaco dopo il trattamento con levosimendan e dobutamina. Levosimendan raggiungere più alto indice cardiaco rispetto alla dobutamina (SMD: 2.82; 95% CI: 2.54-3.10). Come profilassi contro LoHF nei pazienti postoperatori, l’infusione di levosimendan dopo anestesia ha raggiunto un indice cardiaco più alto (2,57) rispetto alla IABP preoperatoria (2,3) o con una combinazione di levosimendan (2,4). La figura 8 mostra un appezzamento forestale del tasso di mortalità tra levosimendan e placebo. Levosimendan aveva un tasso di mortalità più basso rispetto al placebo (Odds Ratio : 0,83; IC al 95%: 0,59-1,18) ma la differenza non era statisticamente significativa (p=0,30). Finale, Figura 9 mostra ulteriormente Levosimendan ha un tasso di mortalità inferiore rispetto alla dobutamina (O: 0,65; 95% CI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
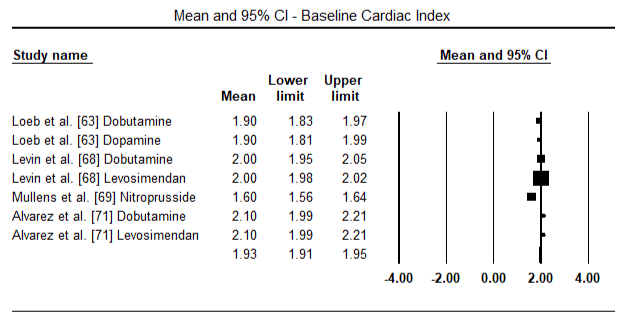
Figure 5. Mean baseline cardiac index
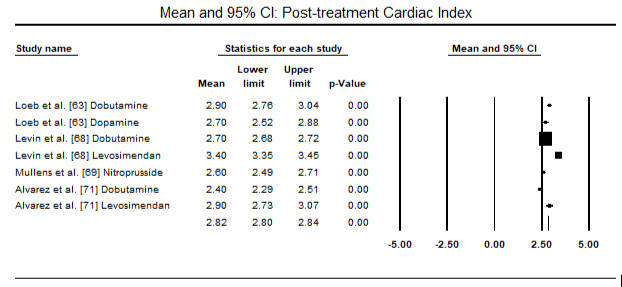
Figure 6. Mean post-treatment cardiac index
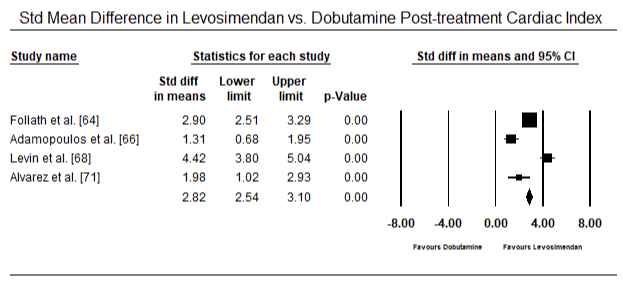
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
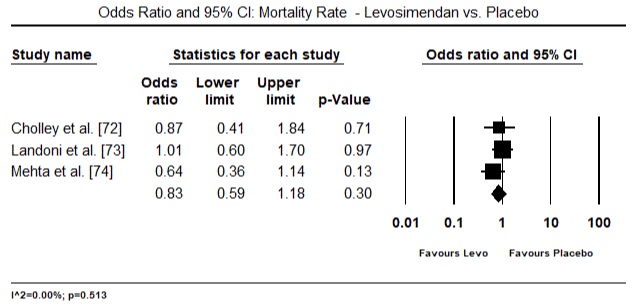
Figure 8. Mortality rate between levosimendan and placebo
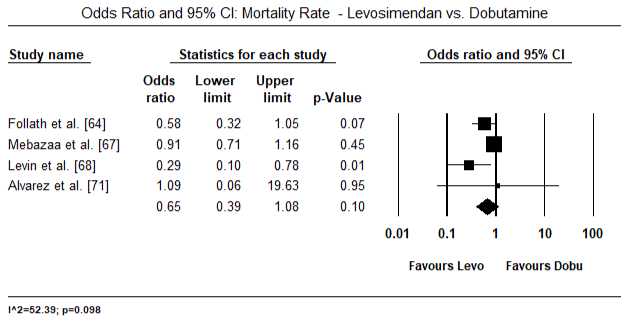
Figure 9. Tasso di mortalità tra levosimendan e dobutamina
Discussione dei risultati
Questa revisione sistematica e meta-analisi hanno valutato le caratteristiche diagnostiche comuni e gli esiti del trattamento della terapia medica e dei dispositivi (IABP) su pazienti con LoHF. I risultati indicano che i pazienti con LoHF non hanno caratteristiche diagnostiche ampiamente accettate o standardizzate. Sebbene i pazienti con LoHF possano presentare diverse caratteristiche tra cui indice cardiaco, PCWP, BP sistolica e SvO2 per suggerire o supportare la diagnosi clinica, tutte queste caratteristiche hanno valori di cut-off diversi tra gli studi. L’indice cardiaco, che è la caratteristica clinica più comune che dimostra lo stato a basso rendimento in LoHF, ha tre valori di cut-off: < 2,0 L/min/m2, < 2,2 L/min/m2 o < 2,5 L/min/m2 . Il supporto inotropico è emerso come un intervento molto comune per migliorare la perfusione e normalizzare la gittata cardiaca nei pazienti con LoHF.
I farmaci inotropi come levosimendan, dobutamina, dopamina, vasodilatatore (nitroprussiato) e IABP hanno migliorato significativamente l’IC tra il basale e il post-trattamento. In termini di inotropi, levosimendan è più efficace nel migliorare la stabilità emodinamica e una migliore profilassi contro la morte a breve termine (mortalità a 30 giorni) rispetto alla dobutamina. Inoltre, gli inotropi possono agire come profilattici contro lo sviluppo di LoHF post-operatorio. D’altra parte, mentre gli inotropi migliorano l’emodinamica e normalizzano la gittata cardiaca, non forniscono alcuna protezione significativamente migliore contro la mortalità indipendentemente dal tipo di inotropo utilizzato.
Il ruolo degli inotropi nel trattamento del LoHF è stato supportato da una precedente revisione degli agenti inotropi e delle strategie vasodilatatrici per il trattamento dello shock cardiogeno e dell’LCOS . La revisione ha riportato inotropi migliorare emodinamica, eventi avversi in LCO post-operatorio e ridotta mortalità. Inotropi più recenti come levosimendan (un sensibilizzatore di calcio e inodilatatore) è un inotropo positivo ha alcune proprietà vasodilatatorie . Può anche essere considerato come un vasodilatatore selettivo del fegato, che può migliorare il flusso venoso portale attraverso l’arteria epatica e il flusso venoso portale rispetto alla dobutamina che può solo migliorare il flusso venoso portale senza vasodilatare l’arteria epatica . Levosimendan inoltre non aumenta la domanda di ossigeno del miocardio e raccomandato sopra dobutamina in pazienti LoHF con infarto ischemico acuto o post cardiochirurgia . Per LoHF post-operatorio, l’effetto protettivo degli inotropi contro il tasso di mortalità a breve termine (mortalità a 30 giorni) rimane insignificante rispetto al placebo .
La presente revisione sistematica e meta-analisi ha alcune importanti limitazioni. LoHF può verificarsi in secondaria alla malattia cardiaca sottostante come infarto miocardico acuto o post-operatorio. La maggior parte degli studi ha incluso LoHF post-operatorio studiato con una minore presentazione di LoHF da altre cause. La maggior parte degli studi si è concentrata su due inotropi (Levosimendan e dobutamina), limitando la comprensione di altri inotropi e di altre terapie come le terapie del dispositivo. In alcuni studi, le analisi erano a rischio di errori di classificazione a causa di un numero significativo di pazienti persi al follow-up. Poiché la maggior parte degli studi non riporta la differenza pre-e post – intervento in coppia con la deviazione standard associata, la differenza pre e post-intervento con la deviazione standard, i risultati pre-e post – intervento misurano come indipendenti, ottenendo così intervalli di confidenza sider per l’effetto del trattamento con una deviazione standard associata.
Conclusione
L’insufficienza cardiaca a bassa uscita (LoHF) è una sindrome clinica caratterizzata da una diminuzione della gittata cardiaca accompagnata da ipoperfusione dell’organo terminale. Si tratta di una forma non comune di insufficienza cardiaca nella popolazione generale, ma prevalente nei pazienti con HF post-operatorio. La sua eziologia è eterogenea, costituita da varie condizioni che causano lo stato di bassa produzione e la chirurgia cardiaca. I principali meccanismi fisiopatologici sono la disfunzione sistolica e/o diastolica LV e la disfunzione RV causata da cambiamenti nella frequenza cardiaca, precarico, postcarico e/o contrattilità. I fattori di rischio generali per LoHF includono la malattia di Chagas, la frazione di eiezione depressa e la disfunzione renale mentre nei pazienti postoperatori includono la funzione LV alterata, la rivascolarizzazione incompleta, l’età avanzata e la presenza di diabete e disfunzione renale. La diagnosi manca di linee guida standardizzate e dipende dalla raccolta accettata di aberrazioni emodinamiche e fisiologiche, comprese le condizioni che causano uno stato di bassa uscita. L’anamnesi del paziente e l’esame fisico aiutano a valutare lo stato emodinamico e riconoscere lo stato di bassa uscita mentre l’ecocardiografia conferma la disfunzione ventricolare (HF) e la bassa gittata cardiaca. Altri test per supportare la diagnosi o stabilire la causa dello stato di bassa uscita includono elettrocardiogramma e test di laboratorio di base (sangue, elettrolita sierico, urea e creatinina, test epatico, funzione tiroidea e peptidi natriuretici sierici) e imaging cardiaco (radiografia del torace o angiografia coronarica). Il trattamento manca di linee guida stabilite, ma dipende dalla valutazione della fisiopatologia individuale per selezionare la strategia di trattamento più appropriata. Il trattamento comprende strategie di ventilazione per migliorare la frequenza cardiaca e del ritmo; la regolazione del volume per ottimizzare il precarico; supporto farmacologico (farmaci inotropi e vasodilatatori) per manipolare il postcarico e migliorare la contrattilità; e dispositivo di terapia (contropulsazione aortica o dispositivo di assistenza ventricolare) quando queste strategie non ripristinare la gittata cardiaca. In pazienti selezionati, le terapie per invertire la malattia di base, possono ripristinare la gittata cardiaca.
- Inamdar A, Inamdar A (2016) Diagnosi, gestione e utilizzo dello scompenso cardiaco. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) Recenti sviluppi nell’insufficienza cardiaca. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Linee guida per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica 2012: La Task Force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica 2012 della Società europea di Cardiologia. Sviluppato in collaborazione con la Heart Failure Association (HFA) del CES. Eur J Cuore fallire 14: 803-869.il nostro sito utilizza cookie tecnici e di terze parti. (2013) 2013 Linea guida ACCF/AHA per la gestione dell’insufficienza cardiaca: un rapporto dell’American College of Cardiology Foundation/American Heart Association Task Force sulle linee guida pratiche. J Am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 Linee guida ESC per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica: La Task Force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica della Società europea di Cardiologia (ESC) Si è sviluppata con il contributo speciale della Heart Failure Association (HFA) dell’ESC. Eur Cuore J 37: 2129-2200.
- Masse L, Antonacci M (2005) Sindrome da bassa gittata cardiaca: identificazione e gestione. Crit Cura Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) Insufficienza cardiaca congestizia. Am J Respir Crit Cura Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Sintesi delle linee guida sulla diagnosi e il trattamento dell’insufficienza cardiaca acuta: La Task Force sull’insufficienza cardiaca acuta della Società europea di Cardiologia. Eur Cuore J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) Prestazioni cardiache e mortalità precoce dopo chirurgia intracardiaca nei neonati e nei bambini piccoli. Circolazione 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) Decorso postoperatorio e profilo emodinamico dopo l’operazione di commutazione arteriosa nei neonati e nei neonati: un confronto tra bypass cardiopolmonare a basso flusso e arresto circolatorio. Circolazione 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) Le complicanze cardiache e neurologiche identificano i rischi di mortalità per uomini e donne sottoposti a intervento chirurgico di bypass coronarico. Anestesiologia 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) Predittori della sindrome da bassa gittata cardiaca dopo bypass coronarico. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) Epidemiologia e nuovi predittori della sindrome da bassa gittata cardiaca dopo l’innesto isolato di bypass coronarico. Eur Cuore J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo GU, Cavalcante WC, et al. (2012) Fattori di rischio per la sindrome da bassa gittata cardiaca dopo intervento chirurgico di bypass coronarico. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Predittori della sindrome da bassa gittata cardiaca dopo un intervento di bypass coronarico isolato: tendenze negli anni 20. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Gestione della sindrome da bassa gittata cardiaca dopo un intervento chirurgico per cardiopatia congenita. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) Sindrome da bassa gittata cardiaca dopo chirurgia cardiaca. J Cardiothorac Vasc Anesth31: 291-308.
- Tibby SM., Murdoch IA (2003) Monitoraggio della funzione cardiaca in terapia intensiva. Arch Dis Bambino 88: 46-52.
- Carcillo JA, Field AI (2002) Parametri di pratica clinica per il supporto emodinamico di pazienti pediatrici e neonatali in shock settico. Crit Cura Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) Morte cardiomiocitaria: meccanismi e implicazioni traslazionali. Morte cellulare& malattia 2: e244.
- Tavernarakis N (2007) Necrosi cardiomiocitaria: meccanismi alternativi, interventi efficaci. Biochimica et Biophysica Acta (BBA) – Ricerca sulle cellule molecolari 1773: 480-482.
- Dorn GW (2008) Morte dei cardiomiociti programmata apoptotica e non apoptotica nel rimodellamento ventricolare. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) Il miocardio stordito e ibernato: una breve rassegna. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) Insufficienza cardiaca diastolica dopo chirurgia cardiaca. Nella malattia coronarica-Concetti attuali in epidemiologia, Fisiopatologia, diagnostica e trattamento 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) Quali meccanismi sono alla base della disfunzione diastolica nell’insufficienza cardiaca? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) Insufficienza cardiaca con frazione di eiezione conservata: fisiopatologia, diagnosi e trattamento. Eur Cuore J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) Il fosfolambano o la troponina I sono la “prima donna” nella lusitropia indotta da β-adrenergici? Circ Res 101: 326-327.
- Paulus WJ, Vantimpont PJ, Shah AM (1994) Effetti acuti dell’ossido nitrico sul rilassamento ventricolare sinistro e sulla distensibilità diastolica nell’uomo. Valutazione mediante infusione bicoronaria di nitroprussiato di sodio. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prevalenza di Abnorrnalità di riempimento diastolico ventricolare sinistro in pazienti cardiochirurgici adulti: uno studio cardiografico Eco intraoperatorio. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) Schemi di riempimento diastolico biventricolare dopo intervento chirurgico di bypass coronarico. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Ipertensione arteriosa polmonare: il ruolo chiave dell’ecocardiografia. Cassa 127: 1836-1843.
- Zochios V, Jones N (2014)Sindrome acuta del cuore destro nel paziente critico. Cuore polmone vaso 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Esperienza clinica iniziale con una sonda di ecocardiografia transesofagea miniaturizzata in un’unità di terapia intensiva cardiaca. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Prestazioni del ventricolo destro sotto stress: relazione con il flusso coronarico destro. J Clin Investire 50: 2176-2183.
- Prezzo LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Disfunzione vascolare polmonare e ventricolare destra in terapia intensiva per adulti: opzioni attuali ed emergenti per la gestione: una revisione sistematica della letteratura. Cura Crit 14: R169.
- Pfisterer M (2003) Coinvolgimento del ventricolo destro nell’infarto miocardico e nello shock cardiogeno. Lancetta 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao CE, et al. (2011) Predittori di bassa gittata cardiaca nell’insufficienza cardiaca grave scompensata. Cliniche 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Esito clinico dell’innesto di bypass coronarico urgente. J coreano Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Predittori della sindrome da bassa gittata cardiaca dopo chirurgia della valvola aortica isolata. Circolazione 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) Valutazione degli strumenti di screening nutrizionale per i pazienti in programma per la cardiochirurgia. Nutrizione 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) I valori preoperatori dell’emoglobina e del peptide natriuretico di tipo B, ma non i marcatori infiammatori, sono associati alla morbilità postoperatoria nella chirurgia cardiaca: uno studio analitico prospettico di coorte. Intervento Cardiotorac alle 8: 170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) Conta linfocitaria totale preoperatoria nel sangue periferico come predittore di scarso esito nella cardiochirurgia adulta. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminale pro-B-tipo livelli di peptide natriuretico ed esito precoce dopo chirurgia cardiaca: uno studio prospettico di coorte. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Utilità del peptide natriuretico di tipo B nella previsione delle complicanze postoperatorie e degli esiti nei pazienti sottoposti a chirurgia cardiaca. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) Relazione tra concentrazione di sodio sierico di ammissione e risultati clinici in pazienti ospedalizzati per insufficienza cardiaca: un’analisi del registro OPTIMIZE-HF. Eur Cuore J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) Mortalità ospedaliera in pazienti con insufficienza cardiaca scompensata acuta che richiedono farmaci vasoattivi per via endovenosa: un’analisi del Registro nazionale dell’insufficienza cardiaca scompensata acuta (ADERIRE). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Gestione del team di pazienti con insufficienza cardiaca: una dichiarazione per gli operatori sanitari del Consiglio infermieristico cardiovascolare dell’American Heart Association. Circolazione 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) La limitata affidabilità dei segni fisici per la stima dell’emodinamica nell’insufficienza cardiaca cronica. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) La valutazione clinica identifica i profili emodinamici che predicono i risultati nei pazienti ricoverati con insufficienza cardiaca. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Terapia medica dell’infarto miocardico acuto mediante applicazione di sottoinsiemi emodinamici. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) Gestione medica dell’insufficienza cardiaca avanzata. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) Ecocardiografia nell’insufficienza cardiaca: applicazioni, utilità e nuovi orizzonti. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) Valutazione ecocardiografica dell’emodinamica in pazienti con insufficienza cardiaca sistolica scompensata. Circc Cardiovasc Imaging 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) Raccomandazioni per la quantificazione della camera cardiaca mediante ecocardiografia negli adulti: un aggiornamento dell’American Society of Ecocardiography e dell’European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) Criteri di adeguatezza per l’uso di imaging cardiovascolare nell’insufficienza cardiaca: rapporto di revisione della letteratura. Eur Heart J Cardiovasc Imaging 16: 147-153.
- Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) Valutazione di imaging cardiaco non invasivo di pazienti con insufficienza cardiaca sistolica cronica: un rapporto dell’Associazione europea di imaging cardiovascolare (EACVI). Eur Cuore J 35: 3417-3425.
- Vazir A, Cowie MR (2012) Valutazione dell’insufficienza cardiaca scompensata acuta: strategie e strumenti. Eur Cardiol 8: 128-133.
- Gray A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) Ventilazione non invasiva nell’edema polmonare cardiogeno acuto. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) Monitoraggio emodinamico nell’insufficienza cardiaca acuta. Crit Cura Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) La pompa a palloncino intra-aortica nella gestione dell’insufficienza cardiaca: implicazioni per la pratica infermieristica. Aust Crit Cura 22: 125-131.
- Slaughter MS, Singh R (2012) Il ruolo dei dispositivi di assistenza ventricolare nell’insufficienza cardiaca avanzata. Revista Española de Cardiologia 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) Profili emodinamici di insufficienza cardiaca avanzata: associazione con caratteristiche cliniche e risultati a lungo termine. J Card Fail 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) Superiorità della dobutamina sulla dopamina per l’aumento della gittata cardiaca in pazienti con insufficienza cardiaca cronica a bassa gittata. Circolazione 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, et al. (2002) Efficacia e sicurezza del levosimendan per via endovenosa rispetto alla dobutamina nell’insufficienza cardiaca grave a bassa uscita (studio LIDO): uno studio randomizzato in doppio cieco. La Lancetta 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) Stenosi aortica a basso rendimento e basso gradiente in pazienti con funzione sistolica ventricolare sinistra depressa: l’utilità clinica della sfida della dobutamina nel laboratorio di cateterizzazione. Circolazione 106: 809-813.
- Adamopoulos S, Parissis JT, IliOdromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Effetti di levosimendan contro dobutamina sulle vie infiammatorie e apoptotiche nell’insufficienza cardiaca cronica acutamente scompensata. Am J Cardiol 98: 102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007) Sopravvivere investigatori. Levosimendan vs dobutamina per pazienti con insufficienza cardiaca scompensata acuta: lo studio randomizzato SURVIVE. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) Il sensibilizzatore al calcio levosimendan dà risultati superiori alla dobutamina nella sindrome postoperatoria a bassa gittata cardiaca. Revista Española de Cardiología (edizione inglese) 61: 471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) Nitroprussiato di sodio per insufficienza cardiaca avanzata a basso rendimento. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan contro una pompa a palloncino intra-aortica in pazienti cardiaci ad alto rischio. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) Un confronto tra doubutamina e levosimendan n flusso sanguigno epatico in pazienti con uno stato di gittata cardiaca bassa dopo chirurgia cardiaca: uno studio controllato randomizzato. Anaesth Terapia intensiva 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Effetto di levosimendan sulla sindrome da bassa gittata cardiaca in pazienti con bassa frazione di eiezione sottoposti a bypass coronarico con bypass cardiopolmonare: lo studio clinico randomizzato LICORN. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan per supporto emodinamico dopo chirurgia cardiaca. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendan in pazienti con disfunzione ventricolare sinistra sottoposti a chirurgia cardiaca. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich CE, Strobl H, Prondzinsky R, Weiche S, et al. (2018) Agenti inotropi e strategie vasodilatatrici per il trattamento dello shock cardiogeno o della sindrome da bassa gittata cardiaca. La Biblioteca Cochrane. 2 : 1-10.