Entalpia e reazioni chimiche
7.3 Entalpia e reazioni chimiche
Obiettivi formativi
- Definire l’entalpia.
- Esprimere correttamente il cambiamento entalpico delle reazioni chimiche.
- Spiega come i cambiamenti di entalpia vengono misurati sperimentalmente.
Ora che abbiamo mostrato come l’energia, il lavoro e il calore sono correlati, siamo pronti a considerare i cambiamenti energetici nelle reazioni chimiche. Un concetto fondamentale è che ogni reazione chimica si verifica con un cambiamento simultaneo di energia. Ora dobbiamo imparare come esprimere correttamente questi cambiamenti energetici.
Il nostro studio dei gas nel Capitolo 6 “Gas” e la nostra definizione di lavoro nella Sezione 7.2 “Lavoro e calore” indicano che condizioni come pressione, volume e temperatura influenzano il contenuto energetico di un sistema. Ciò di cui abbiamo bisogno è una definizione di energia che regge quando vengono specificate alcune di queste condizioni (in qualche modo simile alla nostra definizione di temperatura e pressione standard nel nostro studio dei gas). Definiamo il cambiamento di entalpiail calore di un processo a pressione costante; denotato ΔH. (ΔH) come il calore di un processo quando la pressione è mantenuta costante:
ΔH pressure qat pressione costante
La lettera H sta per “entalpia”, un tipo di energia, mentre il Δ implica un cambiamento nella quantità. Saremo sempre interessati al cambiamento di H, piuttosto che al valore assoluto di H stesso.
Quando si verifica una reazione chimica, c’è un cambiamento caratteristico nell’entalpia. La variazione di entalpia per una reazione è tipicamente scritta dopo un’equazione chimica bilanciata e sulla stessa linea. Ad esempio, quando due moli di idrogeno reagiscono con una mole di ossigeno per fare due moli di acqua, il cambiamento di entalpia caratteristica è 570 kJ. Scriviamo l’equazione come
2H2(g) + O2(g) → 2H2O(ℓ) ΔH = -570 kJ
Un’equazione chimica che include un cambiamento entalpico è chiamata equazione termochimicaun’equazione chimica che include un cambiamento entalpico.. Si presume che un’equazione termochimica si riferisca all’equazione in quantità molari, il che significa che deve essere interpretata in termini di moli, non di singole molecole.
Esempio 5
Scrivi l’equazione termochimica per la reazione di PCl3(g) con Cl2(g) per fare PCl5(g), che ha un cambiamento di entalpia di -88 kJ.
Soluzione
L’equazione termochimica è
PCl3(g) + Cl2(g) → PCl5(g) ΔH = -88 kJ
Mettiti alla prova
Scrivi l’equazione termochimica per la reazione di N2(g) con O2(g) per fare 2NO(g), che ha un cambiamento di entalpia di 181 kJ.
Risposta
N2(g) + O2(g) → 2NO(g) ΔH = 181 kJ
Potresti aver notato che il ΔH per una reazione chimica può essere positivo o negativo. Si presume che il numero sia positivo se non ha alcun segno; un segno + può essere aggiunto esplicitamente per evitare confusione. Si dice che una reazione chimica che ha un ΔH positivo sia una reazione chimica endotermica che ha un cambiamento positivo nell’entalpia., mentre una reazione chimica che ha un ΔH negativo è detto di essere esotermica reazione chimica che ha un cambiamento negativo in entalpia..
Cosa significa se il ΔH di un processo è positivo? Significa che il sistema in cui si verifica la reazione chimica sta guadagnando energia. Se si considera l’energia di un sistema come rappresentata come un’altezza su un diagramma di energia verticale, il cambiamento di entalpia che accompagna la reazione può essere schematizzato come nella parte (a) in Figura 7.3 “Energia di reazione”: l’energia dei reagenti ha una certa energia e il sistema aumenta la sua energia man mano che va ai prodotti. I prodotti sono più alti sulla scala verticale rispetto ai reagenti. Endotermico, quindi, implica che il sistema guadagna, o assorbe, energia.
Esiste una situazione opposta per un processo esotermico, come mostrato nella parte (b) della Figura 7.3 “Energia di reazione”. Se il cambiamento di entalpia di una reazione è negativo, il sistema sta perdendo energia, quindi i prodotti hanno meno energia dei reagenti e i prodotti sono più bassi sulla scala di energia verticale rispetto ai reagenti. Esotermica, quindi, implica che il sistema perde, o emette, energia.
Figura 7.3 Energia di reazione
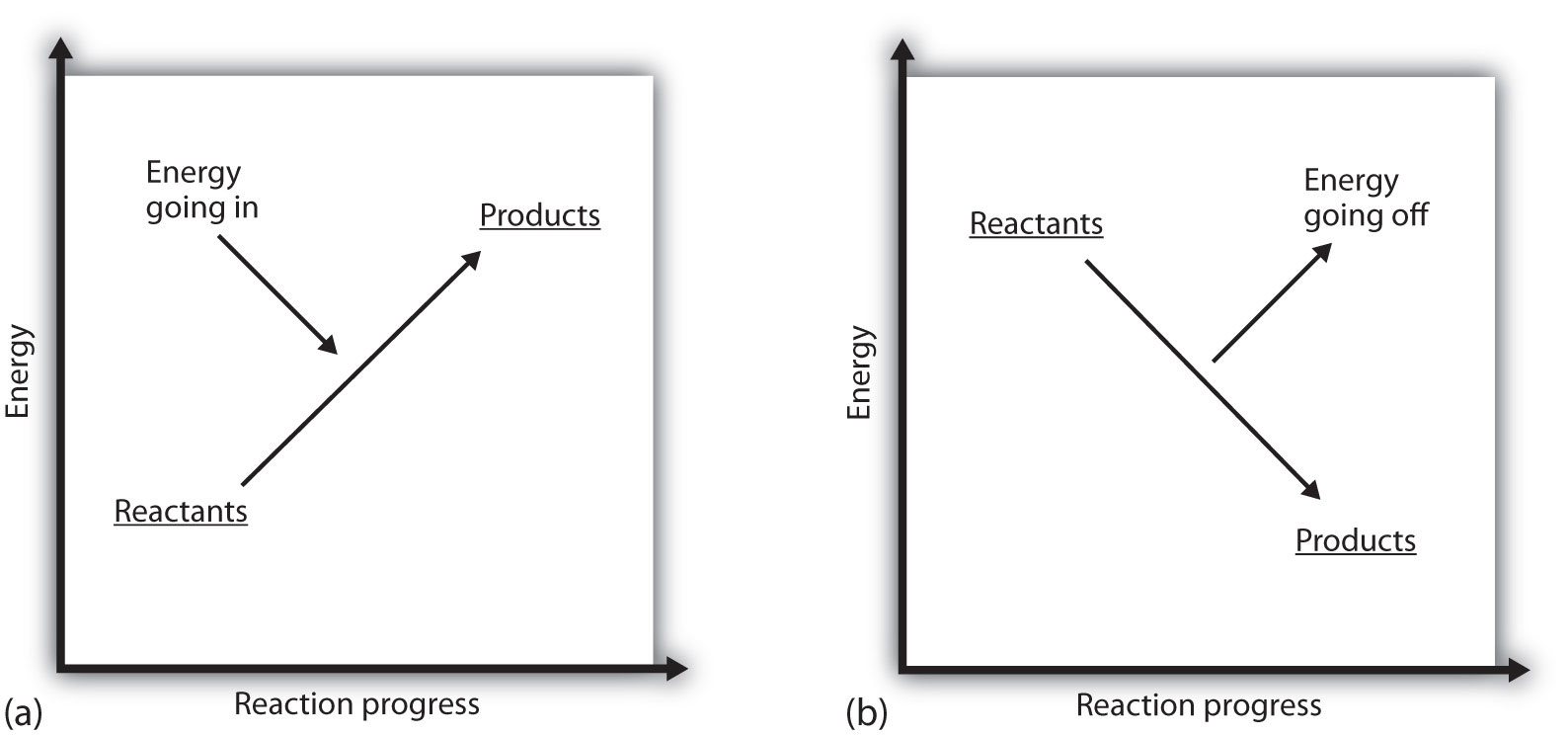
(a) In una reazione endotermica, l’energia del sistema aumenta (cioè si sposta più in alto sulla scala verticale dell’energia). (b) In una reazione esotermica, l’energia del sistema diminuisce (cioè, si muove più in basso sulla scala verticale di energia).
Esempio 6
Si consideri questa equazione termochimica.
2CO(g) + O2(g) → 2CO2(g) ΔH = -565 kJ
È esotermico o endotermico? Quanta energia viene emessa o assorbita?
Soluzione
Per definizione, una reazione chimica che ha un ΔH negativo è esotermica, il che significa che questa molta energia—in questo caso, 565 kJ—viene emessa dalla reazione.
Mettiti alla prova
Considera questa equazione termochimica.
CO2 (g) + H2 (g) → CO (g) + H2O (g) ΔH = 42 kJ
È esotermico o endotermico? Quanta energia viene emessa o assorbita?
Risposta
Endotermico; 42 kJ vengono assorbiti.
Come vengono misurati sperimentalmente i valori ΔH? In realtà, ΔH non è misurato; q è misurato. Ma le misurazioni vengono eseguite in condizioni di pressione costante, quindi ΔH è uguale al q misurato.
Sperimentalmente, q è misurata sfruttando l’equazione
q = mcΔT
Premisure la massa delle sostanze chimiche in un sistema. Quindi lasciamo che si verifichi la reazione chimica e misuriamo il cambiamento di temperatura (ΔT) del sistema. Se conosciamo il calore specifico dei materiali nel sistema (in genere, lo facciamo), possiamo calcolare q. Quel valore di q è numericamente uguale al ΔH del processo, che possiamo scalare fino a una scala molare. Il contenitore in cui risiede il sistema è tipicamente isolato, quindi qualsiasi cambiamento di energia va a cambiare la temperatura del sistema, piuttosto che essere trapelato dal sistema. Il contenitore è indicato come contenitore calorimeterA utilizzato per misurare il calore di una reazione chimica., e il processo di misurazione dei cambiamenti nell’entalpia è chiamato calorimetriil processo di misurazione dei cambiamenti di entalpia per le reazioni chimiche..
Figura 7.4 Calorimetri
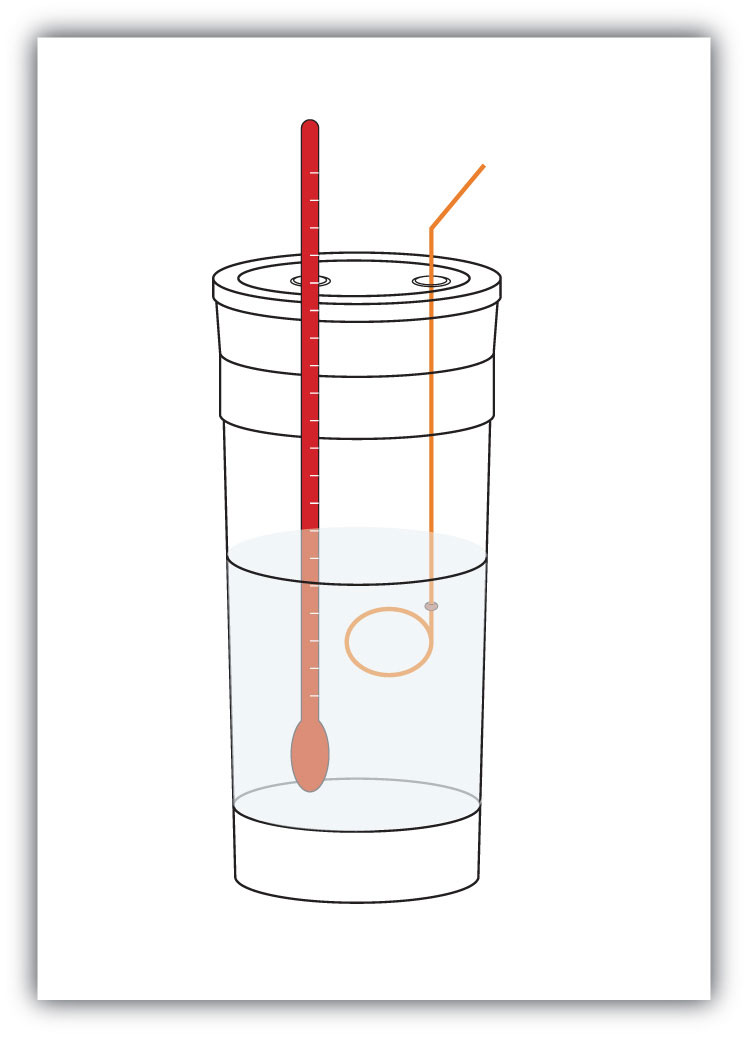
Un semplice calorimetro può essere costruito da alcune tazze di caffè in schiuma annidata, una copertura, un termometro e un agitatore.
Ad esempio, supponiamo che 4,0 g di NaOH, o 0,10 mol di NaOH, vengano sciolti per ottenere 100,0 ml di soluzione acquosa, mentre 3,65 g di HCl, o 0,10 mol di HCl, vengano sciolti per ottenere altri 100,0 ml di soluzione acquosa. Le due soluzioni vengono miscelate in un calorimetro isolato, viene inserito un termometro e il calorimetro viene coperto (vedere Figura 7.4 “Calorimetri” per un esempio di configurazione). Il termometro misura la variazione di temperatura il seguente reazione chimica si verifica:
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ)
Un osservatore osserva che la temperatura aumenta da 22.4°C a 29.1°C. Supponendo che il calore capacità e densità delle soluzioni sono le stesse di quelle di acqua pura, ora abbiamo le informazioni necessarie per determinare la variazione di entalpia della reazione chimica. La quantità totale di soluzione è di 200,0 mL e con una densità di 1,00 g/mL, abbiamo quindi 200,0 g di soluzione. Utilizzando l’equazione di q sostituto per le nostre misure sperimentali e il calore specifico dell’acqua (Tabella 7.1 “Calori Specifici di Varie Sostanze”):
q=(200.0 g)(4.184 J g⋅°C)(6.7°C)
la Risoluzione per q, otteniamo
q=5,600 J≡ΔH per la reazione
Il calore q è uguale alla ΔH per la reazione, perché la reazione chimica che avviene a pressione costante. Tuttavia, la reazione sta emettendo questa quantità di energia, quindi il segno effettivo su ΔH è negativo:
ΔH = -5,600 J per la reazione
Quindi, abbiamo la seguente equazione termochimica per la reazione chimica che si è verificato nel calorimetro:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(aq)+110 H2O(ℓ)ΔH=-5,600 J
1/10 coefficienti sono presenti per ricordare a noi che abbiamo iniziato con un decimo di una mole di ciascun reagente, così facciamo un decimo di una mole di ciascun prodotto. Tipicamente, tuttavia, riportiamo equazioni termochimiche in termini di talpe, non un decimo di una talpa. Per scalare fino a quantità molari, dobbiamo moltiplicare i coefficienti per 10. Tuttavia, quando lo facciamo, otteniamo 10 volte più energia. Abbiamo, dunque,
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
Il ΔH può essere convertito in kJ unità, così la nostra ultima equazione termochimica è
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Abbiamo appena preso i nostri dati sperimentali di calorimetria e determinato la variazione di entalpia di una reazione chimica. Misurazioni simili su altre reazioni chimiche possono determinare i valori ΔH di qualsiasi reazione chimica che si desidera studiare.
Esempio 7
Una soluzione di 100 ml di 0.25 mol di Ca2+(aq) sono stati mescolati con 0,50 mol di ioni F−(aq) e CaF2 è stato precipitato:
Ca2+(aq) + 2F−(aq) → CaF2(s)
La temperatura della soluzione è aumentata di 10,5°C. Qual è stato il cambiamento di entalpia per la reazione chimica? Qual è stato il cambiamento di entalpia per la produzione di 1 mol di CaF2? Supponiamo che la soluzione abbia la stessa densità e calore specifico dell’acqua.
Soluzione
Poiché ci viene dato ΔT direttamente, possiamo determinare il calore della reazione, che è uguale a ΔH:
q = (100 g) (4.184 J g° ° C) (10.5°C)
Risolvendo per q, otteniamo
q = 4,400 J
Pertanto, ΔH = -4,400 J.
Secondo la stechiometria della reazione, si formeranno esattamente 0,25 mol di CaF2, quindi questa quantità di calore è per 0,25 mol. Per 1 mol di CaF2, dobbiamo scalare il calore di un fattore quattro:
q = 4.400 J × 4 = 17.600 J per 1 mol CaF2
Su base molare, la variazione di entalpia è
ΔH = -17.600 J = -17.6 kJ
Mettiti alla prova
In un calorimetro a pressione costante, 0.10 mol di CH4(g) e 0.20 mol di O2(g) sono fatti reagire.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ)
La reazione si riscalda 750.0 g di H2O per 28,4°C. Qual è ΔH per la reazione su una scala molare?
Risposta
-891 kJ
Key Takeaways
- Ogni reazione chimica si verifica con un cambiamento simultaneo di energia.
- La variazione di entalpia è uguale al calore a pressione costante.
- I cambiamenti di entalpia possono essere espressi usando equazioni termochimiche.
- Le variazioni di entalpia vengono misurate utilizzando la calorimetria.
Esercizi
-
In quali circostanze q e ΔH sono uguali?
-
In quali circostanze q e ΔH sono diversi?
-
Il gas idrogeno e il gas cloro reagiscono per produrre gas cloruro di idrogeno con un cambiamento entalpico di accompagnamento di -184 kJ. Scrivi un’equazione termochimica correttamente bilanciata per questo processo.
-
Il propano (C3H8) reagisce con il gas di ossigeno elementare per produrre anidride carbonica e acqua liquida con un cambiamento entalpico di accompagnamento di -2,220 kJ. Scrivi un’equazione termochimica correttamente bilanciata per questo processo.
-
Il gas azoto reagisce con il gas ossigeno per produrre NO(g) assorbendo 180 kJ. Scrivi un’equazione termochimica correttamente bilanciata per questo processo.
-
Il sodio solido reagisce con il gas cloro per produrre cloruro di sodio solido emettendo 772 kJ. Scrivi un’equazione termochimica correttamente bilanciata per questo processo.
-
Il gas idrogeno e il gas cloro reagiscono per produrre gas cloruro di idrogeno con un cambiamento entalpico di accompagnamento di -184 kJ. Questo processo è endotermico o esotermico?
-
Il propano (C3H8) reagisce con il gas di ossigeno elementare per produrre anidride carbonica emettendo 2.220 kJ di energia. Questo processo è endotermico o esotermico?
-
Il gas azoto reagisce con il gas ossigeno per produrre NO(g) assorbendo 180 kJ. Questo processo è esotermico o endotermico?
-
Il metallo del sodio può reagire con azoto per fare l’azide del sodio (NaN3) con un ΔH di 21,72 kJ. Questo processo è esotermico o endotermico?
-
Disegnare un diagramma del livello di energia per la reazione chimica nell’esercizio 8. (Vedi Figura 7.3 “Energia di reazione” per un esempio.)
-
Disegnare un diagramma del livello di energia per la reazione chimica nell’esercizio 9. (Vedi Figura 7.3 “Energia di reazione” per un esempio.)
-
In una soluzione da 250 ml, si combinano 0,25 mol di KOH(aq) e 0,25 mol di HNO3(aq). La temperatura della soluzione aumenta da 22,5°C a 35,9°C. Supponiamo che la soluzione abbia la stessa densità e capacità termica dell’acqua. Qual è il calore della reazione e qual è il ΔH della reazione su base molare?
-
In una soluzione da 600 ml, 0.50 mol di Ca(OH)2(aq) e 0,50 mol di H2SO4(aq) sono combinati. La temperatura della soluzione aumenta di 22,3°C. Qual è il calore della reazione e qual è il ΔH della reazione su base molare? Supponiamo che la soluzione abbia la stessa densità e capacità termica dell’acqua.
-
Per riscaldare 400,0 g di H2O, vengono bruciati 0,050 mol di etanolo (C2H5OH). L’acqua si riscalda da 24,6°C a 65,6°C. Qual è il calore della reazione e qual è il ΔH della reazione su base molare?
-
Per riscaldare 100.0 g di H2O, 0.066 mol cera d’api è bruciato. L’acqua si riscalda da 21,4°C a 25,5°C. Qual è il calore della reazione e qual è il ΔH della reazione su base molare?
Risposte
-
in condizioni di pressione costante
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
esotermica
-
endotermico
-
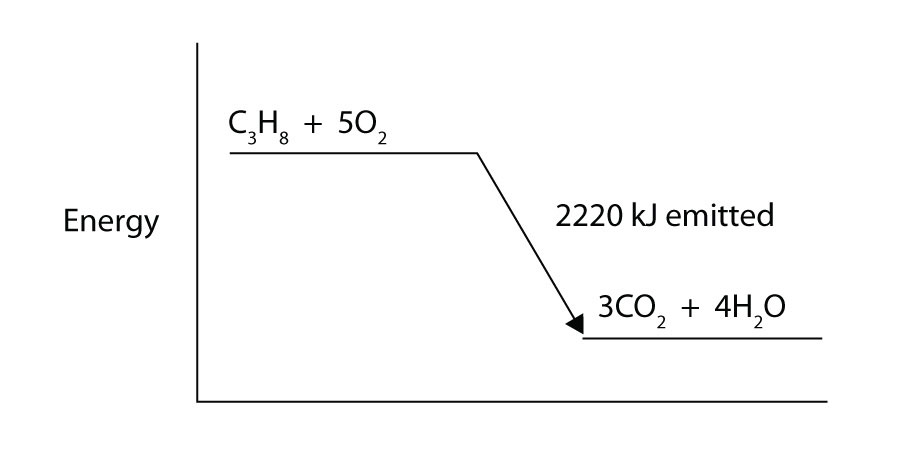
-
il calore di reazione = -14.0 kJ; ΔH = -56,0 kJ / mol di reagenti
-
calore di reazione = -68,6 kJ; ΔH = -1,370 kJ/mole di etanolo