エンタルピーと化学反応
7.3エンタルピーと化学反応
学習目標
- エンタルピーを定義します。
- 化学反応のエンタルピー変化を適切に表現する。
- エンタルピーの変化が実験的にどのように測定されるかを説明します。エネルギー、仕事、熱がどのように関連しているかを示したので、化学反応におけるエネルギー変化を検討する準備が整いました。 基本的な概念は、すべての化学反応がエネルギーの同時変化で起こるということです。 今、私たちはこれらのエネルギー変化を適切に表現する方法を学ぶ必要があります。
第6章”ガス”のガスの研究とセクション7.2″仕事と熱”の仕事の定義は、圧力、体積、温度などの条件がシステムのエネルギー含有量に影響することを示 私たちが必要とするのは、これらの条件のいくつかが指定されたときに保持されるエネルギーの定義です(ガスの研究における標準温度と圧力の定義 エンタルピー変化を定義する一定の圧力でのプロセスの熱;δ Hで表される。 (Δ H)圧力が一定に保持されているときのプロセスの熱として:
Δ H≤qat一定圧力
文字Hはエネルギーの一種”エンタルピー”を表し、Δは量の変化を意味します。 私たちは常にHの絶対値ではなく、Hの変化に興味があります。
化学反応が起こると、エンタルピーに特徴的な変化があります。 反応のエンタルピー変化は、典型的には平衡化された化学式の後に同じ行に書かれる。 例えば、2モルの水素が1モルの酸素と反応して2モルの水を作るとき、特徴的なエンタルピー変化は570kJである。 2H2(g)+O2(g)→2H2O(λ)Δ H=-570kJと書く。. 熱化学式はモル量の式を参照すると仮定されており、個々の分子ではなくモルの観点から解釈されなければならないことを意味する。
例5
Pcl3(g)とCl2(g)の反応の熱化学式を書いて、-88kJのエンタルピー変化を持つPcl5(g)を作る。
溶液
熱化学式は
Pcl3(g)+Cl2(g)→Pcl5(G)Δ H=-88kJ
自分でテスト
N2(g)とO2(g)の反応の熱化学式を書いて2NO(g)を作り、エンタルピー変化は181kJである。N2(g)+O2(g)→2NO(g)Δ H=181kJ
あなたは、化学反応のためのΔ Hが正または負であってもよいことに気づいたかもしれません。
あなたは、化学反応のためのΔ H=181kJ
あなたは、化学反応のためのΔ H=181kJ
あなたが気づいたかもしれません。 混乱を避けるために+記号を明示的に追加することができます。 正のΔ Hを有する化学反応は、エンタルピーに正の変化を有する吸熱化学反応であると言われる。 負のΔ Hを有する化学反応は、エンタルピーに負の変化を有する発熱化学反応であると言われているが、Δ Hが負のΔ Hを有する化学反応は、エンタルピーに負の変化を有する発熱化学反応であると言われている。.プロセスのΔ Hが正の場合、それはどういう意味ですか?
これは、化学反応が起こっているシステムがエネルギーを獲得していることを意味します。 システムのエネルギーが垂直エネルギープロット上の高さとして表されていると考えると、反応に伴うエンタルピー変化は、図7.3″反応エネルギー”のパート(a)のようにグラフ化することができます。反応物のエネルギーはいくらかのエネルギーを持ち、システムは生成物に行くにつれてエネルギーを増加させます。 生成物は、反応物よりも垂直スケールで高い。 吸熱は、システムがエネルギーを得る、または吸収することを意味する。
図7.3″反応エネルギー”のパート(b)に示すように、発熱プロセスには反対の状況が存在します。 反応のエンタルピー変化が負である場合、系はエネルギーを失っているので、生成物は反応物よりもエネルギーが少なく、生成物は反応物よりも垂直エネルギースケールで低い。 発熱は、システムがエネルギーを失う、または放出することを意味します。
図7.3反応エネルギー
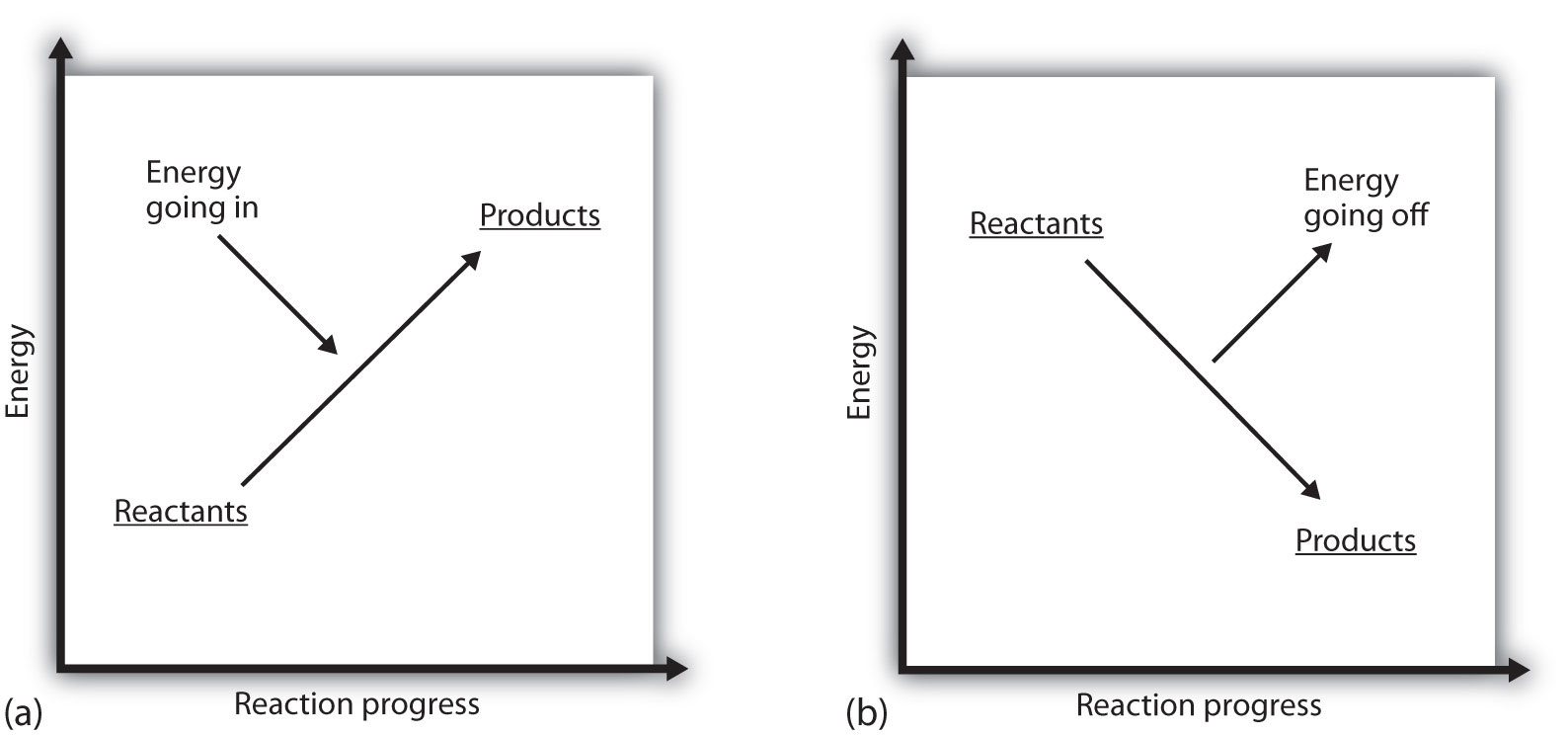
(a)吸熱反応では、システムのエネルギーが増加する(すなわち、エネルギーの垂直スケールで高く移動する)。 (b)発熱反応では、系のエネルギーが減少する(すなわち、エネルギーの垂直スケールでより低く移動する)。
例6
この熱化学式を考えてみましょう。2CO(g)+O2(g)→2CO2(g)Δ H=-565kJ発熱ですか吸熱ですか? どのくらいのエネルギーが放出されたり吸収されたりしますか?定義上、負のΔ Hを有する化学反応は発熱性であり、この多くのエネルギー(この場合は565kJ)が反応によって放出されることを意味する。この熱化学式を考えてみましょう。
CO2(g)+H2(g)→CO(g)+H2O(G)Δ H=42kJ発熱ですか吸熱ですか? どのくらいのエネルギーが放出されたり吸収されたりしますか?
答え
吸熱性;42kJが吸収される。Δ H値は実験的にどのように測定されますか?
Δ H値はどのように測定されますか? 実際には、Δ Hは測定されず、qは測定される。 しかし、測定は一定の圧力の条件下で行われるので、Δ Hは測定されたqに等しい。実験的に、qは方程式を利用して測定されます。
q=mc δ t
システム内の化学物質の質量を事前に測定します。 次に、化学反応を起こさせ、系の温度変化(Δ T)を測定します。 システム内の材料の比熱がわかっていれば(通常はそうします)、qを計算できます。qの値はプロセスのΔ Hに数値的に等しく、モルスケールにスケールアッ システムが存在する容器は、典型的には絶縁されているので、任意のエネルギー変化は、システムから漏れているのではなく、システムの温度を変化さ 容器は化学反応の熱を測定するのに使用されるcalorimeterAの容器と言われます。 そして、エンタルピーの変化を測定するプロセスは熱量と呼ばれます化学反応のためのエンタルピー変化を測定するプロセス。.
図7.4熱量計
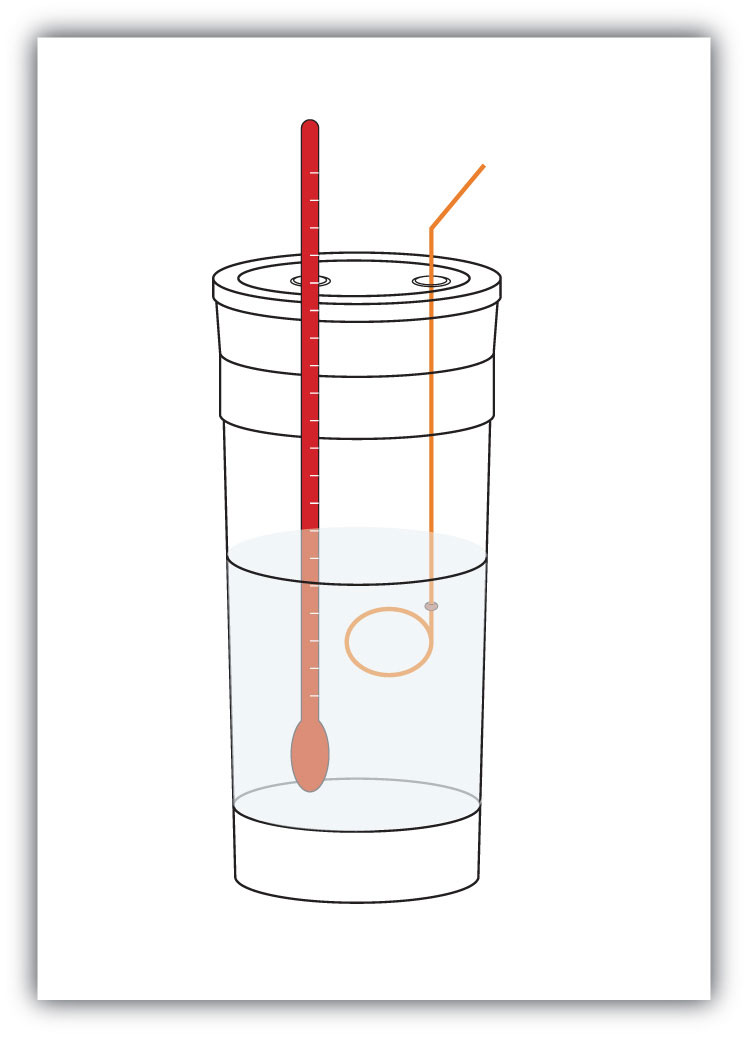
単純な熱量計は、いくつかのネストされた泡のコーヒーカップ、カバー、温度計、および攪拌機から構築することがで例えば、4.0gのNaOH、または0.10molのNaOHを溶解して100.0mLの水溶液を作り、3.65gのHCl、または0.10molのHClを溶解して別の100.0mLの水溶液を作るとします。 二つの溶液を絶縁熱量計に混合し、温度計を挿入し、熱量計をカバーします(設定例については図7.4″熱量計”を参照)。 温度計は、次の化学反応が起こるときの温度変化を測定します。
NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(λ)
観察者は、温度が22.4℃から29.1℃に上昇することに注意しています。溶液の熱容量と密度が純水のものと同じであると仮定すると、化学反応のエンタルピー変化を決定するために必要な情報が得られました。 溶液の総量は200.0mLであり、密度は1.00g/mLであり、したがって溶液は200.0gである。 Qの式を使用して、実験測定値と水の比熱(表7.1″様々な物質の比熱”)を代入します。
q=(200.0g)(4.184J g≤°C)(6.7°C)
qを解くと、反応に対して
q=5,600J≤Δ Hが得られます
化学反応は一定の圧力で起こるため、熱qは反応のΔ Hに等しくなります。 しかし、反応はこの量のエネルギーを放出しているので、Δ H上の実際の符号は負である:
Δ H=-5,600j反応のための
したがって、我々は熱量計で発生した化学反応のための次の熱化学式を持っています:
110NaOH(aq)+110HCl(aq)→110NaCl(aq)+110H2O(λ)Δ H=-5,600J
1/10係数は、各反応物のモルの十分の一から始まったことを思い出させるために存在しているので、我々は一つの反応物を作る。各製品のモルの第十。 しかし、典型的には、モルの10分の1ではなく、モルの観点から熱化学方程式を報告します。 モル量にスケールアップするには、係数に10を乗算する必要があります。 しかし、これを行うと、10倍のエネルギーが得られます。 したがって、我々は持っています
NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(λ)Δ H=-56,000J
Δ HはkJ単位に変換することができるので、私たちの最終的な熱化学式は
NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(λ)Δ H=-56kJ
私たちはちょうど熱量測定から私たちの実験データを取り、のエンタルピー変化を決定しました。化学反応だ 他の化学反応に関する同様の測定値は、研究したい化学反応のΔ H値を決定することができます。
例7
100mLの0の溶液。25molのCa2+(aq)を0.50molのF−(aq)イオンと混合し、Caf2を析出させた:
Ca2+(aq)+2F−(aq)→Caf2(s)
溶液の温度は10.5℃増加した。 1molのCaf2の生成のためのエンタルピー変化は何でしたか? 溶液が水と同じ密度と比熱を有すると仮定する。
溶液
我々はΔ Tを直接与えられているので、我々はΔ Hに等しい反応の熱を決定することができます:
q=(100g)(4.184J g≤℃)(10。5°C)
Qについて解くと、我々は得る
q=4,400J
したがって、Δ H=-4,400J.
反応の化学量論によれば、正確に0.25molのCaf2が形成されるので、この熱量は0.25molである。 1molのCaf2の場合、熱を4倍にスケールアップする必要があります。
Q=4,400J×4=17,600J1mol Caf2の場合
モルベースでは、エンタルピーの変化は
Δ H=-17,600J=-17.6kJ
定圧での熱量計では、0.10molのCH4(g)と0.20molのO2(g)である。g)を反応させる。CH4(g)+2O2(g)→CO2(g)+2H2O(γ)
反応は750を暖めます。
モルスケールでの反応のΔ Hは何ですか?
答え
-891kJ
キーテイクアウト
- すべての化学反応は、エネルギーの同時変化で発生します。
- エンタルピーの変化は、一定の圧力での熱に等しい。
- エンタルピー変化は熱化学式を用いて表すことができる。
- エンタルピー変化は熱量測定を用いて測定される。
演習
-
どのような状況下でqとΔ Hは同じですか?
-
どのような状況でqとΔ Hが違うのですか?水素ガスと塩素ガスは反応して、-184kJのエンタルピー変化を伴う塩化水素ガスを生成する。 このプロセスのための適切にバランスのとれた熱化学式を書きます。
-
プロパン(C3H8)は元素酸素ガスと反応して、-2,220kJのエンタルピー変化を伴う二酸化炭素と液体水を生成する。 このプロセスのための適切にバランスのとれた熱化学式を書きます。
-
窒素ガスは酸素ガスと反応してNO(g)を作り、180kJを吸収します。 このプロセスのための適切にバランスのとれた熱化学式を書きます。
-
固体ナトリウムは塩素ガスと反応して固体塩化ナトリウムを作り、772kJを放出する。 このプロセスのための適切にバランスのとれた熱化学式を書きます。水素ガスと塩素ガスは反応して、-184kJのエンタルピー変化を伴う塩化水素ガスを生成する。 このプロセスは吸熱性ですか発熱性ですか?
-
プロパン(C3H8)は元素酸素ガスと反応して二酸化炭素を生成し、2,220kJのエネルギーを放出します。 このプロセスは吸熱性ですか発熱性ですか?
-
窒素ガスは酸素ガスと反応してNO(g)を作り、180kJを吸収します。 このプロセスは発熱性か吸熱性ですか?金属ナトリウムは窒素と反応してアジ化ナトリウム(Nan3)を21.72kJのΔ Hで作ることができます。 このプロセスは発熱性か吸熱性ですか?
-
演習8で化学反応のエネルギー準位図を描画します。 (例については、図7.3″反応エネルギー”を参照してください。>
-
化学反応のエネルギー準位図を演習9で描画します。 (例については、図7.3″反応エネルギー”を参照してください。250mLの溶液中で、0.25molのKOH(aq)と0.25molのHNO3(aq)を合わせた。 溶液の温度は22.5℃から35.9℃に上昇する溶液が水の密度および熱容量が同じであると仮定する。 反応の熱は何ですか、そしてモルベースでの反応のΔ Hは何ですか?
-
600mLの溶液中で、0。50molのCa(OH)2(aq)と0.50molのH2SO4(aq)を合わせた。 溶液の温度は22.3℃上昇する反応の熱は何であり、モルベースでの反応のΔ Hは何ですか? 溶液が水の密度と熱容量が同じであると仮定します。400.0gのH2Oを加熱するために、0.050molのエタノール(C2H5OH)を燃焼させる。 水は24.6℃から65.6℃に暖まる反応の熱は何であり、モルベースでの反応のΔ Hは何ですか?
-
100.0gのH2Oを加熱するために、0.066molの蜜蝋を燃焼させる。 水は21.4℃から25.5℃に暖まる反応の熱は何であり、モルベースでの反応のΔ Hは何ですか?h2(g)+Cl2(g)→2HCL(G)Δ H=-184kJ
-
N2(g)+Cl2(g)→2HCL(G)Δ H=-184kJ
-
n2(g)+Cl2(g)→2HCL(G)Δ H=-184kJ
n2(g)+Cl2(g)→2HCL(G)Δ H=-184kJ
N2(g)+Cl2(g)→2HCL(G)Δ H=-184kJ
N2(g)+CL2(g)→2HCL(O2(g)→2NO(g)Δ H=180kJ
発熱性
吸熱性
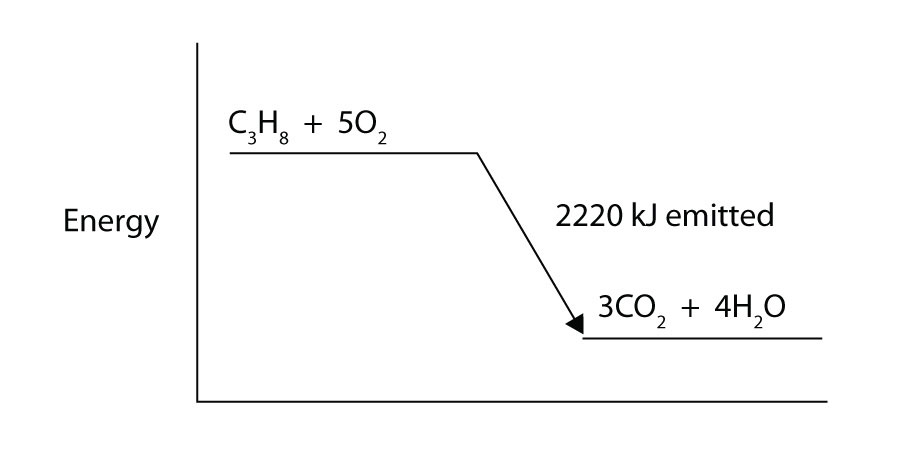



反応熱=-14.0kJ; Δ H=-56.0kj/反応物のモル
反応熱=-68.6kJ;Δ H=-1,370kj/エタノールのモル