入門化学-第1カナダ版
学習目標
- 液体の蒸気圧を定義します。
- 表面張力と毛細管現象の両方の起源を説明します。すべての液体が持っているいくつかの特性があります。
すべての液体が持っているいくつかの特性があります。 私たちが最もよく知っている液体はおそらく水であり、これらの特性を持っています。 他の液体にもそれらがありますが、これは心に留めておくべきことです。
すべての液体は、気相に入るのに十分なエネルギーを有する粒子の特定の部分を有し、これらの粒子が液体の表面にある場合、それらはそうする(図10.6″蒸発”)。 沸点以下の温度で液体からのガスの形成は蒸発と呼ばれます。 これらの温度では、気相中の材料はガスではなく蒸気と呼ばれ、ガスという用語は、気相が安定相であるときのために予約されています。
図10.6蒸発

液体のいくつかの粒子は、蒸気になるために液相を脱出するのに十分なエネルギーを持っています。使用可能な容積が十分に大きい場合、最終的にはすべての液体が蒸気になります。
使用可能な容積が十分に大きい場合、最終的にはすべての液体 しかし、利用可能な体積が十分でない場合、最終的には蒸気粒子の一部が液相に再突入する(図10.7″平衡”)。 ある時点で、気相に入る粒子の数は、気相を出る粒子の数に等しくなるので、システム内の蒸気の量に正味の変化はない。 我々は、システムが平衡状態にあると言う。 平衡状態での蒸気の分圧は、液体の蒸気圧と呼ばれます。
図10.7平衡

ある時点で、気相に入る粒子の数は、液体に戻る粒子の数によってバランスされます。 この点は平衡と呼ばれます。液体が蒸発を停止していないことを理解してください。
液体が蒸発を停止していないことを理解してください。 逆のプロセス-凝縮-は蒸発があると速く起こっている、従ってシステムの蒸気の量に純変更がない。 動的平衡という用語は、プロセスがまだ発生する状況を表しますが、システムに正味の変化がないように、反対のプロセスも同じ速度で発生します。
物質の蒸気圧は物質の温度に依存し、温度が上昇するにつれて蒸気圧も同様になります。
物質の蒸気圧は物質の温度に依存します。
物質の蒸気圧は物質の温度に依存します。 図10.8″いくつかの液体の蒸気圧対温度のプロット”は、いくつかの液体の蒸気圧対温度のプロットです。 蒸気圧を定義したので、液体の沸点を再定義することもできます:液体の蒸気圧が周囲の環境圧力に等しい温度。 したがって、通常の蒸気圧は、蒸気圧が760torr、または正確に1気圧である温度です。 したがって、沸点は周囲の圧力によって変化し、通常よりも低いまたは高い標高で食品を調理することに大きな影響を与える可能性があります。 大気圧は高度によって大きく変化する。
図10.8いくつかの液体の蒸気圧と温度のプロット
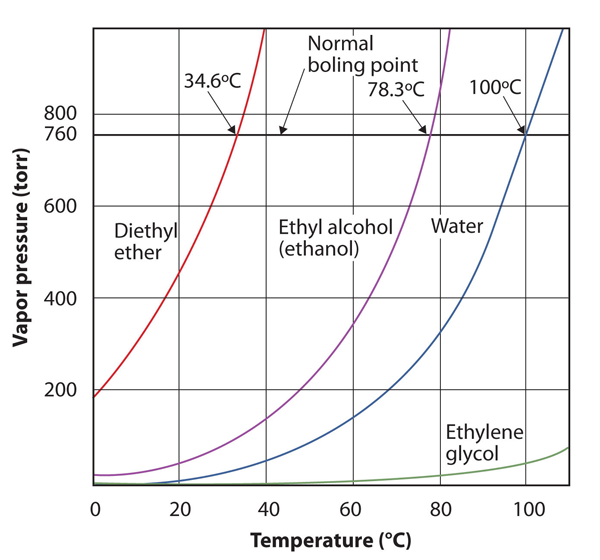
液体の蒸気圧は、このプロットが示すように、液体の同一性と温度
例4
図10.8″いくつかの液体の蒸気圧と温度のプロット”を使用して、エベレストの頂上でのおおよその大気圧である500torrでの水の沸点
ソリューション
添付の図を参照してください。 500torrは400から600の間にあるので、y軸上のその点から水の曲線まで線を伸ばし、それをx軸にドロップして関連する温度を読み取ります。 水蒸気圧曲線上の点は約90℃の温度に対応するように見えるので、500torrでの水の沸点は90℃であると結論付けます。
図10.9図10を使用して。8″いくつかの液体の蒸気圧と温度のプロット”例4に答えるために
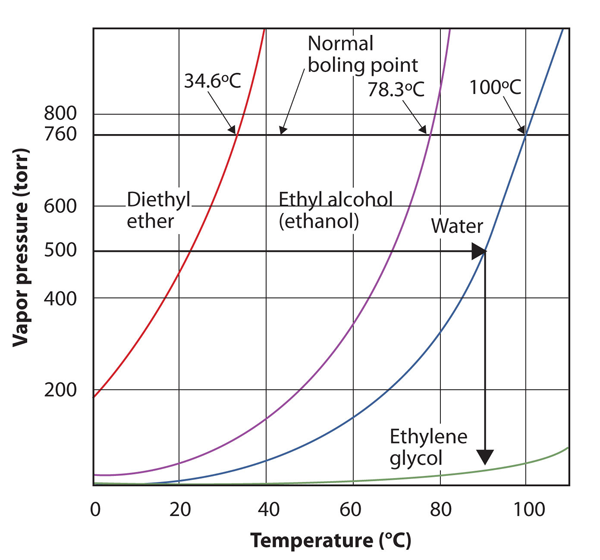
グラフを正しく読むことで、異なる温度での液体の沸点を推定することができます。
自分でテスト
図10.8「複数の液体の蒸気圧と温度のプロット」を使用して、400torrでのエタノールの沸点を推定します。
答え
約65°C
水の蒸気圧曲線は、融点—0°Cで正確にゼロではありません氷でも蒸気圧を持っています。
水の蒸気圧; それが時間の経過とともに昇華する理由です。 しかしながら、固体の蒸気圧は、典型的には液体の蒸気圧よりもはるかに低い。 -1°Cでは、氷の蒸気圧は4.2torrです。 0°F(-17°C)の冷凍庫温度では、氷の蒸気圧はわずか1.0torrであり、いわゆるディープフリーザーは氷の蒸気圧がわずか0.6torrである-23°Cに降りることが
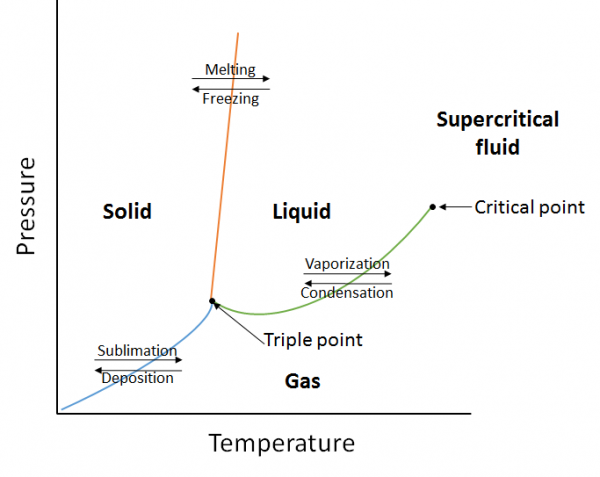
相図
相図は、指定された圧力と温度の下で物質の相の間に存在する平衡関係をグラフィカルに表現したものです(図10.10)。 相図は、蒸気圧曲線、溶融曲線および昇華曲線の3つの曲線の組み合わせである。 我々は以前に蒸気圧力曲線が液体と気相の間の平衡を表し、圧力が1気圧に等しい点が通常の沸点であることを見てきました。 相図(緑色)のこの曲線の1つの追加の特徴は、臨界点で終わることです。 臨界点とは、液体と気体が区別できる最高の温度と圧力の点です。 この点を超える温度と圧力では、物質は超臨界流体として知られている液体と気体の両方の特性を有する相に存在する。
融解曲線(オレンジ色)は固体と液体の平衡を表し、圧力が1気圧に等しい点は通常の融点です。 昇華曲線(青)は、固体と気体の間に存在する平衡を表します。 最後に、3つの曲線がすべて交わる点は、三重点として知られています。 この時点で、3つの相(固体、液体および気体)はすべて平衡状態に存在する。
例:
次の相図を使用して、次の場合に何が起こるかを決定します。
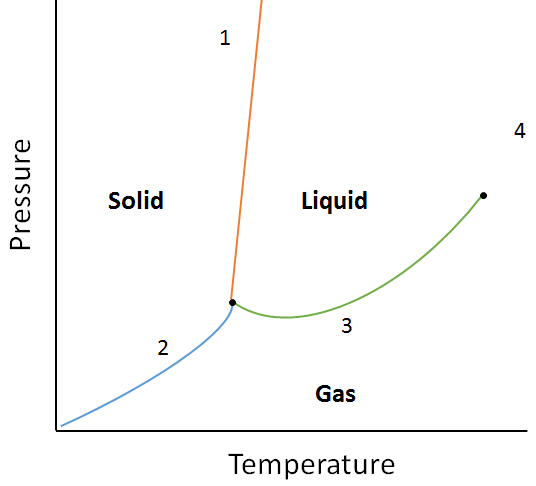
a.点1で物質の温度が上昇します。ポイント3で物質の圧力が増加します。
b.
溶液:
a.温度が上昇すると、ポイント1の物質が溶融する(固体から液体に相を変化させる)。
b. 温度が上昇すると、ポイント3の物質は凝縮(気体から液体への相の変化)します。
表面張力と毛管作用
すべての液体は、同様にいくつかの他の特性を共有しています。 表面張力は、図10.11″表面張力”に示すように、液体の表面の原子に対する力の不均衡によって引き起こされる効果です。 液体の大部分の青い粒子は、矢印で示されているように、すべての周りから分子間力を経験する。 しかし、表面上の黄色の粒子は、その上に粒子が存在しないため、その上に力を発生しません。 これは、我々が表面張力と呼ぶ力の不均衡につながります。
図10.11表面張力

表面張力は、液体の表面の粒子がすべての方向からの相互作用を経験しないという事実に由来し、表面上の力の不均衡につながる。
図10.12表面張力の影響

出典:クリスティアンrubertiによる”ウェットアップル”は、クリエイティブ*コモンズ表示-非営利-ShareAlike2.0ジェネリックの下でライセンスされています。