入門化学–第1カナダ版
学習目標
- バッファを定義します。
- バッファの二つのコンポーネントを正しく識別します。セクション12.4″強酸と弱酸と塩基とその塩”に示されているように、弱酸は私たちが食べる食品でさえも比較的一般的です。 しかし、我々は時折、1.7の強酸性pHを有する胃酸のような強酸または塩基に遭遇する。 定義上、強酸および塩基は、比較的大量のH+またはOH−イオンを生成し、その結果、顕著な化学活性を有することができる。 さらに、非常に少量の強酸および塩基は、溶液のpHを非常に迅速に変化させることができる。 1mLの胃酸が血流に添加され、補正機構が存在しない場合、血液のpHは約7.4から約4.7に低下し、これは継続的な生活に役立たないpHである。 幸いなことに、体はそのような劇的なpH変化を最小限に抑えるメカニズムを持っています。バッファーは、弱酸とその弱酸に由来する塩、または弱塩基とその弱塩基の塩のいずれかの溶質の特定のペアで構成されることによってそうします。
例えば、緩衝液は、溶解したH C2H3O2(弱酸)およびNac2H3O2(その弱酸に由来する塩)から構成することができる。 緩衝液の別の例は、N H3(弱塩基)およびN H4Cl(その弱塩基に由来する塩)を含有する溶液である。
hc2h3O2/Nac2h3O2バッファーを使用して、バッファーがどのように機能するかを示します。 Oh—(aq)イオンの源である強塩基が緩衝液に添加されると、それらのOH−イオンは酸—塩基反応においてHC2h3O2と反応する:
HC2h3O2(aq)+OH−(aq)→H2O(λ)+C2h3O2-(aq)
溶液を塩基性にすることによってpHを劇的に変化させるのではなく、添加されたOH−イオンはH2Oを作るために反応するので、pHはあまり変化しない。
h+イオンの源である強酸が緩衝液に添加されると、H+イオンは塩からのアニオンと反応します。
HC2H3O2は弱酸であるため、あまりイオン化されません。 これは、多くのH+イオンとC2H3O2−イオンが同じ溶液中に存在する場合、HC2h3O2を作るために一緒に来ることを意味します。
h+(aq)+C2h3O2−(aq)→HC2h3O2(aq)
pHを劇的に変えて溶液を酸性にするのではなく、添加されたH+イオンは反応して弱酸の分子を作る。 図12.2″バッファのアクション”は、バッファの両方のアクションを示しています。
図12.2バッファのアクション
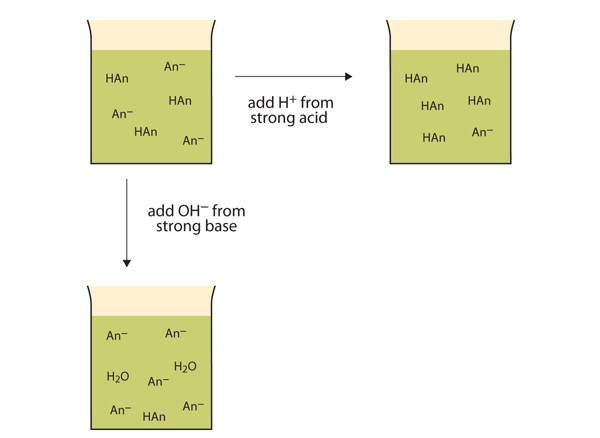
バッファは、pHの大きな変化を最小限に抑えるために、強酸(上)と強塩基(側)の両方と反応することができます。弱塩基および弱塩基の塩から作られた緩衝液も同様に作用する。 例えば、NH3とNh4Clを含むバッファーでは、NH3分子は強酸によって導入された過剰なH+イオンと反応することができます。
NH3(aq)+H+(aq)→NH4+(aq)
NH4+(aq)イオンは強塩基によって導入された任意のOH−イオンと反応することができます。
NH4+(aq)+OH−(aq)→NH3(aq)+H2O(λ)
例15
どの化合物の組み合わせが緩衝液を作ることができますか?
- Hcho2とNacho2
- HClとNaCl
- CH3NH2とCh3Nh3Cl
- NH3とNaOH
溶液
- HCHO2はギ酸、弱酸であり、Nacho2は弱酸(ギ酸イオン)のアニオンから作られた塩である。 これらの2つの溶質の組み合わせは緩衝液を作るでしょう。
- HClは強酸であり、弱酸ではないため、これら2つの溶質の組み合わせは緩衝液を作らないでしょう。
- HClは強酸であり、弱酸ではありません。
- CH3NH2はメチルアミンであり、NH3のようなもので、そのH原子の1つがCH3基で置換されています。 これは表12には記載されていないためです。2″強酸と塩基”、我々はそれが弱い塩基であると仮定することができます。 化合物Ch3Nh3Clはその弱い塩基から作られた塩であるため、これら2つの溶質の組み合わせは緩衝液を作るでしょう。
- NH3は弱塩基ですが、NaOHは強塩基です。 これら二つの溶質の組み合わせは緩衝液を作らないであろう。
あなた自身をテスト
化合物のどの組み合わせが緩衝液を作ることができますか?li>
- Nahco3とNaCl
- H3PO4とNah2Po4
- NH3と(NH4)3PO4
- NaOHとNaCl
答え
- いいえ
- はい
p>緩衝は加えられた強い酸または基盤の限られた量のためにだけよく働きます。 いずれかの溶質が完全に反応すると、溶液はもはや緩衝液ではなく、pHの急速な変化が起こり得る。 バッファには一定の容量があると言います。 より多くの溶質がそれらに溶解している緩衝液は、予想されるように、より大きな容量を有する。血液中の1つの緩衝液は、HCO3−およびH2CO3の存在に基づいています。
ヒトの血液には、pHの極端な変化を最小限に抑える緩衝系があります。 この緩衝液が存在すると、いくらかの胃酸が血流に直接その方法を見つけることができたとしても、血液のpHの変化は最小限に抑えられます。 体の細胞の多くの内部には、リン酸イオンに基づく緩衝系があります。
食べ物と飲み物のアプリ: 痛みを和らげる酸
薬は正確には”食べ物や飲み物”ではありませんが、私たちはそれらを摂取しますので、おそらく最も一般的な薬である酸を見てみましょう:アセチルサリチル酸、アスピリンとしても知られています。 アスピリンは鎮痛剤および解熱剤(熱の減力剤)として有名です。
アスピリンの構造を添付の図に示します。 酸の部分は丸で囲まれています;アスピリンがBrønsted-Lowry酸として作用するので寄付することができるのはその部分のH原子です。 表12.2″強酸および塩基”には記載されていないため、アセチルサリチル酸は弱酸である。 しかし、それはまだ酸であり、何人かの人々が毎日比較的大量のアスピリンを消費することを考えると、その酸性の性質は、それ自身の胃酸に対する胃の防御にもかかわらず、胃の内層に問題を引き起こす可能性がある。
図12.3アスピリンの分子構造

丸で囲まれた原子は、分子の酸部分です。アスピリンの酸の特性が問題になるかもしれないので多くのアスピリンのブランドは薬の”緩衝されたアスピリン”の形態を提供します。
アスピリンの酸の特性が問題になるかもしれないので、多くのアスピリンのブランド これらの場合、アスピリンはまた酸性副作用を最小にするためにアスピリンの酸味を調整する緩衝代理店—通常MgO—を含んでいます。
アスピリンと同様に有用で一般的なものであり、1899年から正式に医薬品として販売されていました。 米国食品医薬品局(FDA)は、米国の医薬品の監督と承認を担当する政府機関であり、1906年まで形成されていませんでした。 いくつかは、アスピリンが導入される前にFDAが形成されていた場合、アスピリンは、胃腸出血、耳鳴り、ライ症候群(肝臓の問題)、およびいくつかのアレルギー反応のために、その可能性のために承認を得ていない可能性があると主張している。 しかし、最近アスピリンは心臓発作や脳卒中の軽減に効果があると宣伝されているので、アスピリンはここにとどまる可能性が高いです。
重要な注意事項
- 緩衝液は、pHの急激な変化に抵抗する溶液です。
演習
-
バッファを定義します。 緩衝液を作るためには、どのような2つの関連する化学成分が必要ですか?強酸と強塩基を組み合わせることで緩衝液を作ることができますか? なぜか、なぜか?
-
どの化合物の組み合わせが緩衝液を作ることができますか? 水溶液を仮定する。
A)HClおよびNaCl
b)HNO2およびNano2
c)NH4NO3およびHNO3
d)NH4NO3およびNH3
4。 どの化合物の組み合わせが緩衝液を作ることができますか? 水溶液を仮定する。
a)H3PO4とNa3Po4
b)Nahco3とNa2Co3
c)Nano3とCa(NO3)2
d)HN3とNH3
5。 緩衝液である演習3の各組み合わせについて、強酸と強塩基が添加されたときの緩衝液成分の反応の化学式を書きます。
6. 緩衝液である演習4の各組み合わせについて、強酸と強塩基が添加されたときの緩衝液成分の反応の化学式を書きます。
7. 完全な隣酸塩緩衝システムは4つの物質に基づいています: H3PO4、H2PO4-、HPO42-、およびPO43-。 これらの物質からどのような異なる緩衝液を作ることができますか?
8. NaBrが酸性または塩基性緩衝液のいずれかの成分であることができない理由を説明します。
9. 同じ濃度の溶質を含む二つの溶液を作製した。 一方の溶液はH3PO4とNa3Po4で構成され、他方の溶液はHCNとNaCNで構成されています。 どの解決策がバッファとしてより大きな容量を持つべきですか?
10. 同じ濃度の溶質を含む二つの溶液を作製した。 一つの溶液はNH3とNH4NO3で構成され、もう一つはH2SO4とNa2So4で構成されています。 どの解決策がバッファとしてより大きな容量を持つべきですか?
回答
緩衝液は、弱酸または塩基とその弱酸または塩基の塩の組み合わせです。
緩衝液は、弱酸または塩基の塩との組み合わせです。
3b:強酸:NO2−+H+→HNO2;強塩基:HNO2+OH−→NO2−+H2O;3d:強塩基:NH4++OH−→NH3+H2O;強酸:NH3+H+→NH4+7。
バッファは三つの組み合わせから作ることができます: (1)H3PO4およびH2PO4−、(2)H2PO4−およびHPO4 2−、および(3)HPO4 2−およびPO4 3−。 (技術的には、バッファは任意の二つの成分から作ることができます。)
リン酸緩衝液は、より大きな容量を有するべきである。p>