最近の記事を見てみましょう
要約
低出力心不全(LoHF)は、心不全(HF)の珍しい形であるが、非常に高度なHFを知らせるものである。 それは不吉な予想、また相当な罹患率および死亡率と関連付けられます。 しかし、LoHFは主に研究されていないままです。 HFの伝統的な説明は、低心拍出量によってマークされ、肺/末梢うっ血を伴ううっ血性心不全(CHF)に焦点を当てました。 この焦点は、混雑の証拠がほとんどまたはまったくないLoHF患者の過小評価に貢献しました。 さらに、LoHFの患者に証明された療法がないし、適切な処置の選択は個々の病態生理学および根本的な病因学によって決まります。 Lohf患者は,異種病因および病態生理学を有し,その臨床的特徴,診断および臨床管理の詳細な理解の重要性を強調しており,これが本レビューの基礎となっている。
キーワード
低出力心臓症候群、低出力心不全、低出力状態
はじめに
医療および外科療法の著しい進歩にもかかわらず、心不全(HF)の効果的 課題は、死亡率および罹患率の増加とともに、HF関連の病院の再入院率が高いことによって反映されている。 課題の一部は、非常に不均一な病因、病態生理学、およびいくつかのHFフォームは、臨床試験データの不足とその結果、限られた理解を持っているHFの異なる形 特に、H Fの伝統的な記述は、うっ血性心不全(CHF)とほぼ同義であったが、CHFという用語は、肺および/または末梢鬱血の明白な症状をほとんどまたは全く有 低出力HF(LoHF)はまた不吉な予想とリンクされ、非常に高度HFに信号を送ります。 さらに、CHFおよびLoHFの徴候および病態生理学的な相違は異なった臨床管理アプローチのための必要性を支える。 これらの相違にもかかわらず、従来のHF療法はCHFおよびLoHFを含むHFのすべての形態に一般化され、LoHFの病態生理学、診断および臨床管理を理解する臨床 本稿では,疫学,病因,病態生理,診断および臨床管理の観点から,Lohfに関する発表されたエビデンスを集約した。 その意図は、LoHFの臨床状態の知識を刷新するだけでなく、一般的にHFの臨床管理を改善することです。
定義
心不全は、構造的および/または機能的な心筋欠損によって特徴づけられる複雑な臨床症候群であり、心室充填または駆出の障害を 症候群の複雑さは、その不均一な分類で明らかである:右、左、または二心室欠陥の位置に基づいて、急性または慢性発症の時間に基づいて、機能的状態に基づ; 心拍出量(CO)に基づいて低出力または高出力、および血流の方向に基づいて前方または後方の障害。 これらの分類のそれぞれは、HFの診断および治療にとって重要である。 いくつかの分類にもかかわらず、CHFという用語は伝統的にHFと互換的に使用されてきたが、いくつかの症候性および病態生理学的差異のためにLoHFを十分に記述していない。LoHFは、急性代償不全HFにおける低COとしても知られており、前方COの減少(心臓指数<2を特徴とするHFの高視力形態を記述する。0L/min/m2および収縮期血圧<90mmHg)および肺鬱血の証拠はほとんど、あるいは全くないエンド臓器低灌流。 LohfはCHFとは異なっており,coが減少して肺および末梢うっ血を引き起こし,呼吸困難および末梢浮腫をそれぞれ引き起こすことを特徴とするHFを記述している。 HFの診断と管理に関する2005年の欧州心臓病学会(ESC)ガイドラインは、低心拍出量症候群(LCOS)からLoHFへの心原性ショックへの連続を示唆している。 ESCガイドラインでは、収縮期血圧<90mmHgまたは平均動脈圧の低下>30mmHg;尿出力<0.5ml/kg/h;脈拍数<0.5ml/kg/h;脈拍数<0.5ml/kg/h;脈拍数<0.5ml/kg/h;脈拍数<0.5ml/kg/h;脈拍数<>輻輳の証拠の有無にかかわらず、毎分60ビート(bpm)。 一方ではLCOSはpost-operative HFの患者で共通で、激しい心配の設定の30分以上post-operative内部大動脈の気球ポンプまたは変力性サポートのための必要性として定義され
疫学
一般集団におけるLoHFの正確な有病率および発生率は完全に不明である。 現時点では、LoHFに特有の集団ベースの疫学データはありません。 利用可能な唯一のデータは、心臓手術を受けたHF患者の選択した集団を調査する単一センター臨床試験からのものです。 1975年、Parr et al. LCOSの臨床実体の精液の記述をし、CIとして定義される減らされたCOに基づいて心臓外科を経た子供の25%の発生を報告しました<2.0L/min/m2。 二十年後、Wernovsky et al. 手術後6-18時間以内に発生する動脈スイッチ操作を受けた患者における術後LCOSの同じ発生率を実証した。 最近の多くの臨床試験では、3.6%(男性)および5.9%(女性)から9.1%および41%まで、および14.7%の発生率の広範な変動が報告されています。 最近の長期(二十年)では: 1990-2009)25,176連続冠動脈バイパス移植(CABG)手術患者を含む前向き臨床試験、Algarni et al. 術後LCOSの有病率は9.1%(1990年-1994年)から2.4%(2005年-2009年)に有意に減少したと報告されている。LoHFの病因は多階乗である。
Aetiology
LoHFの病因は多階乗である。 一般に、それは、左心室(LV)、右心室(RV)または全身性心室(単一心室解剖学)機能不全の結果であり、収縮期および/または拡張期機能不全のいずれかまたは両方 心室の充填または排出における摂動は、心臓手術を受けた患者または心原性ショックを受けている患者の頻繁な合併症であるLoHFにつながる。 それは慢性HFの患者の激しい悪化として示すか、または激しい制動機の決断の一時的で、リバーシブルのエピソードであるかもしれません。 これは、心機能に影響を与える多数の疾患の最終経路と考えられる臨床的症候群である。 LoHFの診断を行うだけでは十分ではなく、根本的な原因またはトリガーも決定し、可能であれば治療する必要があります。 表1は、HF患者における低出力状態を引き起こす状態の要約を提供する。
表1. 病態生理学による低出力状態の病因
|
メカニズム |
原因条件 |
|
心筋収縮性の損失 |
|
|
冠動脈病、心筋症、心筋炎、非代償性慢性hf、心臓手術後、毒素、栄養(肥満)m浸潤性疾患、末期腎不全、シャーガス病またはhiv感染 |
|
|
心室充填または排出障害 |
心膜炎、心膜滲出液、心タンポナーデ, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
LoHFの病態生理の現在の理解は、術後CABG患者の臨床試験からの証拠に大きく依存している。 病理学的特徴は,過剰に抑制されたCOであり,臓器内低灌流を伴う。 生理学的には、心臓は、組織の代謝ニーズを満たすのに十分な量の酸素化された血液を分配するポンプとして機能する。 新陳代謝の必要性が正常な、緊張に満ちた状態の下で変わるので、COはまたこの動的要求を満たすために変わる。 心臓周期の拡張期は心筋の酸素処理を提供するために冠状詰物が起こること心室の弛緩の間にあるのでLoHFの患者で重大です。 心拍数(HR)は、あまりにも急速なHRが心臓が完全な心筋弛緩および灌流を達成するのを妨げるので、拡張期においても重要である。 したがって、心機能障害は、構造的(残存心臓異常)または機能的心臓障害(心室充填または空虚の障害、または全身血管抵抗の増加)に起因する。病態生理学的には、COはH Rおよび一回量(SV)に依存する(CO=H R*SV)。 ストローク体積は、3つの相互に関連する循環変数の正味積である:予圧、後負荷および収縮性。 これらの成分の一つ以上が損なわれている場合、低心拍出量状態が発生する可能性があります。 さらに、これらの成分は、心周期の収縮期および拡張期の両方に影響を及ぼし、lv/RV収縮期機能不全および/またはhfとしても知られる拡張期機能不全 弁膜性心疾患、肺高血圧症(P h)、機械的弁機能不全、および呼吸不全などの他の状態は、Lohfの発症を沈殿または悪化させる可能性がある。
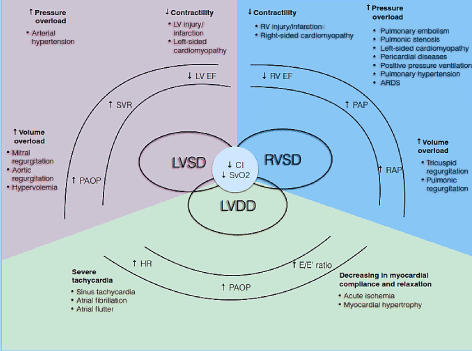
図1. 低出力心不全の病態生理学的メカニズム
一般的な原因と典型的な;LoHFの症状が含まれています。 LoHFの主要な病態生理学的メカニズムは、心室機能不全である: LV収縮期および/または拡張期機能不全およびRV収縮期機能不全は、心臓指数(CI)の低下および混合静脈酸素飽和度(Svo2)の低下の共通の病理学的特徴を LVおよびRVの収縮期機能不全は高められた圧力積み過ぎ、高められた容積の積み過ぎおよび減らされたcontractilityからの結果lvのdiastolic機能障害が厳しい頻脈に起因し、心筋の承諾および弛緩を減らした間、起因します。 Lomivorotov et al. 2017年、p. 293
左室ystolic機能不全
左室(LV)収縮期機能不全(または落ち込んだLV駆出画分)は、LoHF患者に見られる最も一般的な病態生理学的メカニズムである。 左室収縮期機能に影響を及ぼす循環変数は,前負荷,後負荷,収縮性である。 一般に、左室収縮期機能不全は、冠動脈循環障害および虚血、再灌流損傷または心筋細胞アポトーシスのあまり理解されていない自然現象に起因する壊死に起因する機能的心筋細胞の喪失または減少の結果である。 機能的心筋細胞の喪失は、冠動脈再灌流によって引き揚げられた生存可能な心筋と定義される心筋の間に見られるように一過性であり得、これは再灌流後の長期の虚血後機能不全を示す。 機能心筋細胞の損失はまた伝染のような条件の逆転に不応性である場合もあります;頻脈;valvular病気;アシドーシス、hypoglycemia、hypocalcaemiaのような新陳代謝の無秩序;環境の心毒素; そして家族性DCM、肥大性心筋症および筋ジストロフィーのような遺伝の無秩序。 前負荷に対する心臓応答の障害は、他の重要な身体器官へのCOおよび酸素送達の劇的な減少、心房圧の上昇、毛細管くさび圧、および心原性肺浮腫を引き 左室の代償的変化は比較的高い全身動脈圧に適応するが、後負荷の有意な増加は左室収縮期機能不全を誘発する可能性がある。
左室拡張期機能不全
珍しいが、保存されたLVEFを有する左室拡張期機能不全の患者でLoHFが発症することがある。 条件はdiastolic機能障害として示す正常な前負荷にもかかわらず血の十分な容積で満たす心室の部屋の無力に起因します。 重度の頻脈、心筋コンプライアンスの低下、または異常な心室弛緩などの根底にある状態は、心周期の拡張期の間にLVの弛緩および充填を損なう。 心筋細胞レベルでは、これらの状態は、サイトゾルからのカルシウム除去およびカルシウム恒常性、架橋剥離および内在性機能的細胞骨格要素障害の クロスブリッジ剥離は、特に高いHRで減少したLVストローク体積をもたらす遅延等容性緩和時間に寄与することができます。 左室弛緩はまた、筋小胞体カルシウムイオン再取り込みと一酸化窒素シグナル伝達に依存し、これはまた、架橋剥離を容易にする。 クロスブリッジ剥離のプロセスはエネルギー消費であるため、心筋エネルギーの欠損を引き起こし、その結果、LV心筋弛緩を遅くする可能性がある。
拡張期機能不全は、術後心臓患者の最大70%に見られる広範な現象であるにもかかわらず、拡張期機能不全だけでは急性HFの発症を説明するには不十分である。 心房細動(AF)、冠状循環障害、動脈性高血圧などの他の臨床状態の設定では、拡張期機能不全は代償不全状態をもたらす可能性があり、したがって心筋虚血の初期徴候であると考えられている。 LV拡張期機能と収縮期機能との間の動的な関係はまた、Lohf患者の拡張期機能不全に寄与する。 変力性カテコールアミンの刺激は、拡張期および収縮期の両方に影響を及ぼし、拡張期機能不全を増強することができる。 落ち込んだLVEFは、収縮末期容積の増加をもたらし、心周期の拡張期を延長する。
RV機能不全
LoHFでは、特に冠動脈手術後、RV機能不全の原則的な病態生理学的メカニズムには、前負荷の増加、後負荷の増加、右冠動脈灌流の損 左冠状動脈とは対照的に、右冠状動脈の灌流は、拡張期および収縮期の両方の間に起こる。 PHの存在はRV圧の増加を引き起こし,右冠状動脈灌流の減少をもたらし,これは最適な左右冠状循環を提供するための重要性を説明する。 冠動脈手術を受けた患者では、rv機能不全は、メカニズムの組み合わせの結果として発症する可能性がある。 周術期のRV虚血および梗塞は,RV収縮性障害の主な原因である。 左弁膜疾患または心筋症、PHまたは肺塞栓症(PE)、急性呼吸窮迫症候群および高陽圧換気は、圧力過負荷の一般的な原因であるが、増加した体積予圧の一般的な原因の再三尖または肺逆流。 RVは、通常、肺血管系の低圧灌流を可能にするので、肺動脈圧(PAP)の中程度の増加に対しても非常に敏感である。 RV不全は、PHの設定において、または拡張末期RV圧の増加につながるRV拡張の急速な進行に関連する収縮性の障害において発症する可能性がある。 これらの生理学的変化により既に満たされたLVの部屋の方の心室間の隔壁の転位を引き起こし、従ってLVの前負荷の減少およびCOの減少を引き起こ
リスク要因
LoHFのリスク要因はまだ研究されていない領域です。 しかし、HFに関する臨床試験および術後LCOS患者から入手可能なデータはほとんどなく、LoHFの危険因子および予測因子に関する貴重な洞察を提供する。 代償不全HFと低心拍出量で入院した452人の患者の分析では、LoHFの有意な危険因子は、シャーガス病(相対リスク:3.66)、駆出率(RR:2.41)、低ナトリウム血症(rr:1.62)および腎機能不全(rr:1.92)であった。 術後LoHFの危険因子には、左室機能障害(<50%)、ポンプ上CABG、緊急または心肺バイパス(CPB)手術、不完全な血管再生、年齢>65歳、糖尿病 患者および手術の危険因子に加えて、術後患者におけるLoHFの生化学的予測因子は、低ヘモグロビンレベル、総リンパ球数<2000細胞/μ l、および血清ナトリウム利尿ペプチドの術前レベルである。 過去二十年にわたって、いくつかの認識されたリスク要因の傾向に変化がありました。 高血圧、女性の性、三重の容器の病気および左の主要な病気のような要因は押された術前の放出の一部分と関連付けられる危険が倍増する間、もはや統計的に有意ではないです。LoHF患者のコンセンサスガイドラインや証明された診断基準はありません。
診断
lohf患者のコンセンサスガイドラインや証明された診断基準はありません。
さらに、臨床徴候および症状は非特異的である。 標準化されたガイドラインがない場合、診断は通常、LoHFの臨床的疑いを高めるために有用な血行力学的および生理学的異常の受け入れられた収集に 単独でLoHFの診断は頻繁に十分ではないです。 低出力状態の原因も確立する必要があります。 PEまたはMIのような低出力状態のある原因では、根本的な原因を扱うことは最も重要な考察であり、こうして診断をすることは命令的です。 LoHF患者はしばしば不安定であるため、臨床評価、診断および治療が急性ケアの設定で同時に起こることも一般的である。
徴候および症状
急性代償不全HFの提示特徴としての低心拍出量はまれであり、入院したHF患者の8.9-9.6%にのみ影響を及ぼす。 LoHFはCHFと多くの臨床特徴を共有するかもしれないが、それに続く診断決定を支えるか、または導くかもしれない著しい相違がある。 過度の疲労および運動不耐性の増加は、診断前であってもLoHF患者が気づいた重要な初期徴候である。 さらに、lohfの患者は意識の動揺、混乱および/または減らされたレベルと一般にあります;冷たい/vasoconstricted peripheriesまたは遅らせられた毛管補充の時間;低血圧;頻脈または徐脈;thready脈拍;上げられた頸静脈圧力;息切れおよびhypoxaemia;および乏尿/無尿。 これらの徴候および症状は、HF患者の低灌流およびうっ血の間で異なる可能性がある(表2)。
表2. 低灌流対の症状および徴候 congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: HFの診断と管理に関する2016ESCガイドラインは、HFを有する疑いのあるすべての患者の詳細な患者の病歴と身体検査を得ることの重要性を強調してい 患者からの詳細な歴史、または患者があまりにも体調不良である場合は、症状、HFを沈殿または悪化させることができる以前および現在の心臓および 患者の病歴に加えて、血行力学的、末梢灌流、鬱血、基礎となる病因および弁病変の臨床指標を評価するために、すべてのLoHF患者に身体検査が推奨される。 関心のある血行力学的パラメータには、血圧、HRおよび心臓のリズム、ギャロップリズム、酸素飽和度、および呼吸数が含まれる。 末梢灌流の検査には、意識レベル、末梢皮膚/中心温度、毛細血管補充時間、および尿排出量が含まれるべきである。 混雑のためのテストは上げられた頸静脈圧、周辺/肺の浮腫、hepatomegaly、腹水および胸水を含んでいます。 基礎となる病因のためのテストは、心血管検査、および心音と雑音を組み込む必要があります。 最後に、弁機能障害の証拠には、心タンポナーデの有無にかかわらず、心膜擦過および心膜滲出液の証拠が含まれるべきである。
患者の病歴と身体検査の組み合わせは、血行力学的状態の評価およびLoHFの認識において非常に貴重であることが証明されている。 1976年、Forrester et al. 急性心筋梗塞患者の身体検査を行い、図2に示すように四つの血行力学的プロファイル(A、B、LおよびC)を同定した。 血行力学的プロファイルは、肺うっ血の有無(肺毛細血管くさび圧>または≥18mmHg)および灌流の妥当性(CI>2.2L/min/m2)に基づ プロファイルAは、輻輳/低灌流なし、プロファイルBは、低灌流なしの輻輳、プロファイルCは、輻輳なしの低灌流、およびプロファイルLは、輻輳および低灌流を表す。 Lohf患者はプロファイルLおよびCに該当する(nohriaらに基づく低灌流±輻輳。 プロファイルLおよびCの平均CIはそれぞれ1.6L/min/m2および1.9L/min/m2であることを示しています。
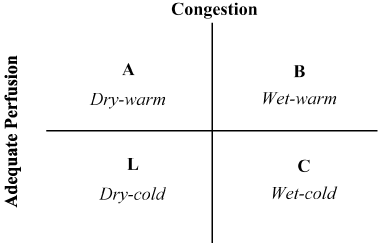
図2. 急性代償不全心不全の臨床プロファイルの概略的なプレゼンテーション
鬱血は、orthopnoeaの存在によって評価されます,頸静脈distension,肺rales,hepatojugular逆流,腹水,末梢浮腫,腹部逆流とValsalva方形波. 低潅流は、狭い脈圧、脈動変化、冷たい四肢、おそらく眠く、血清ナトリウムレベルの低下および腎機能の悪化の存在によって評価された。 Nohria,et a l.
心電図(ECG):HFに関するAHAおよびESCのガイドラインは、HFが疑われるすべての患者において、心電図(ECG)をできるだけ早く行うべきであることを推奨する。 ECGは様々な異常を示すことができ、HF患者では正常である可能性は非常に低い。 それはまた徐脈、房室ブロック、湾曲の頻脈、心房または心室の頻脈性不整脈、虚血、LVの肥大および低電圧の複合体を含む心機能障害の根本的な病因学の証拠を提供するかもしれません。
基本的な実験室試験:AHAおよびESC HFガイドラインは、HFまたは低出力状態の原因の診断をサポートするために、最初の臨床評価における基本的な実験室 血液検査はすべての疑われたHFの患者で行われるべきです。 ヘモグロビン(Hb>10g/dL)は組織への最適な酸素送達を示す)、慢性貧血は慢性HFで一般的であり、著しく増加した白血球は代替診断の疑い カリウム、マグネシウムおよびカルシウムのレベルを定める血清の電解物のためのテスト。 Hfで共通腎臓のhypoperfusionおよび機能障害を査定する尿素およびクレアチニンテスト。 肝機能障害のためのテスト,障害RVおよび/または肝鬱血を示唆しています. 心機能を損なうことができるhypoglycaemiaのために査定するべきブドウ糖テスト。 甲状腺機能は、内因性心筋梗塞を引き起こす可能性のある甲状腺機能低下症または甲状腺機能亢進症を検査します。 最後に、高レベルが増加した心室壁ストレスを示すが、長い半減期のために心室充填圧力の急激な変化を検出しない血清ナトリウム利尿ペプチドの試験。
心臓イメージング検査:心臓イメージングは、HFの診断だけでなく、モニタリングおよび指導療法において中心的な役割を果たす。 心エコー検査は正確さ、供給、安全および費用効果の理由のための好まれた様相である。 これは、禁忌およびリスクを考慮しながら、特定の臨床的質問に答える能力に基づいて選択された他の画像診断法によって補完され得る。
心エコー検査:心エコー検査は、LoHFの臨床診断を確認または除外し、SVおよびその変動を評価し、低出力状態の原因を特定する能力のため、疑われるすべての 低心拍出量の臨床診断後,経胸心エコー検査をできるだけ早く行うべきである。 収縮期および拡張期機能不全の程度を測定するだけでなく、心室形態、弁膜機能不全、心筋および心膜疾患および局所壁運動異常に関する貴重な情報 心エコー検査は、LEVFを測定することによって収縮期機能を評価し、ここで>45-50%は正常とみなされます。 一方,拡張期機能は僧帽弁輪における流れパターン,肺静脈流および組織ドップラーを用いて評価され,COおよびSVはドップラー原理を用いて評価される。 肺動脈圧(PAP)は逆流噴流速度を測定することによって推定できる。 低出力状態の原因としてPEの臨床的疑いを高めるRV圧の急性上昇を示す中隔平平化または左室への弓を伴う拡張RVの存在下での高PAP。
胸部X線:LoHFの疑いのある患者では胸部x線を考慮することができます。 評価のために考慮すべき重要な指標には、心臓肥大またはLV肥大を示す心臓の拡大、LV充填圧力の上昇を示す肺静脈鬱血が含まれる; および胸水は、左室圧の上昇、肺塞栓症または心臓手術後を示す(。
冠動脈造影:LoHF患者における冠動脈造影の適応症は、HFの関連するコンセンサスガイドラインの勧告と一致するべきである。 胸痛と心電図上のST上昇心筋梗塞(STEMI)の証拠を提示するHF患者では、一次経皮的冠動脈介入を用いた血管再建はできるだけ早く行うべきである。 冠動脈造影は、虚血性病因の心停止後の患者、HFの証拠がある場合、および原因が決定されていないときに低出力状態から回復した患者においても考慮されるべきである。
臨床管理
LoHFの存在は、迅速な治療を必要とする非常にリスクの高い状態を表しますが、臨床管理のための標準化されたガイドラインを欠 その結果、臨床医は通常、個々の病態生理学を考慮して、最も適切な治療戦略を選択する。 急性LoHF患者では、2016ESC HFガイドラインでは、臨床管理を導くために血行力学的プロファイル(鬱血の有無および灌流の妥当性に基づく)の使用を推奨して 急性代償不全状態にあるプロファイルL(うっ血はないが低灌流)およびプロファイルC(うっ血と低灌流の両方)のLoHF患者の場合、緊急治療の目標には、患者の蘇生、酸素化の回復、臓器灌流の改善および血行力学的(ストロークボリュームおよびCO)の最適化、および症状の解決が含まれる。 他の後続の目標には、最適なモニタリングと低心拍出量の根本的な原因の確立と、可逆的であれば原因の治療が含まれます。 現在、LoHFの治療標的として利用可能なのは、組織の酸素化の最適化、循環の安定化、低出力状態の可逆的原因の治療です(図3)。
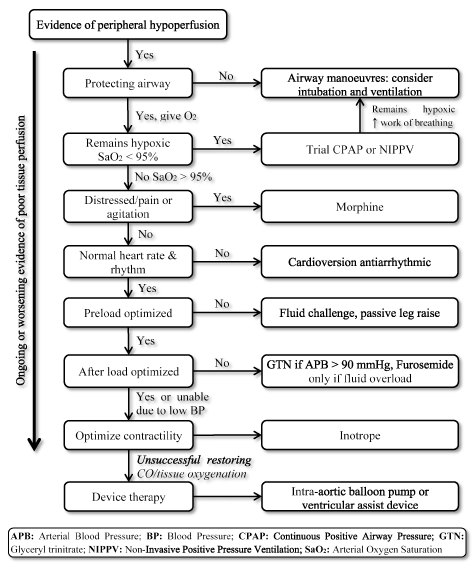
図3. 低出力心不全のための治療アルゴリズム
LoHFの治療は、組織の酸素化を改善し、組織灌流の進行中または悪化する症状に基づいて循環を安定させる 処置は高い流れの酸素、連続的で肯定的な航空路圧力(CPAP)または非侵襲的で肯定的な圧力換気(NIPPV)の配達を使用して換気の改善によって始まります。 失敗した場合、心拍数を正常化するための除細動または抗不整脈薬、前負荷を最適化するための流体チャレンジ、および/または血管拡張薬およびinotropesを与え、それぞれ収縮性を操作および改善する。 以前の換気および投薬が心拍出量および/または組織酸素化の回復に失敗した場合、大動脈内バルーンポンプまたは心室補助装置を用いた装置療法を考慮することができる
組織酸素化の最適化(換気戦略)
LoHF患者の臨床管理は、しばしば末梢低灌流の証拠のための気道、呼吸および循環の評価から始まる。 口腔咽頭または鼻咽頭気道などの人工呼吸器戦略は、脳灌流の低下による意識レベルの低下を伴うLoHF患者における気道開存性を回復または維持す 患者が妥協された航空路と残っていれば付加的なendotracheal挿管法は考慮されるべきです。 患者が低酸素状態を維持し続ける場合(Sao2<95%)、高流量酸素、持続気道陽圧(CPAP)または非侵襲的陽圧換気(NIPPV)を使用した酸素送達の最大化 改善のない患者では、挿管または換気を考慮することができる。心拍出量(CO)はHRとSVの関数です。
循環を安定させる
心拍出量(CO)はHRとSVの関数です。 次に、SVは、心拍数、前負荷、収縮性および後負荷の4つの循環変数に依存する。 これらすべての変数を最適化することで、LoHF患者のCOが改善されます。 臨床設定では、COを高める作戦は根本的な原因および影響を受けた循環の変数によって決まります。 臨床的介入には、容積調整、薬理学的支援および装置療法が含まれる。
心拍数/リズム: 身体の生理学的応答の一部として、HRの増加はCOを増加させる。 速すぎるか遅いHRはCOに有害な影響を与えます。 頻脈(速すぎる休息HR>100bpm)を有するlohf患者では、モルヒネを投与して呼吸困難、痛みおよび興奮を和らげることができ、特にCPAPまたはNIPPV患者の後負荷を軽減するための軽度の静脈拡張剤である。 HR<40bpmで血行力学的妥協および/またはCO障害の証拠がある場合、HRを増加させる薬物(アトロピンおよび抗コリン作用薬)または経皮的/経静脈ペーシングなどの介入を行うべきである。 心室/上室性頻脈または心血管妥協の証拠を有する急速なAFを有する選択されたLoHFにおいて、緊急の電気的除細動を考慮すべきである。
予圧の最適化(体積調整):予圧の測定は、その最適化のために不可欠です。 末梢灌流障害の臨床的証拠を有する患者に推奨される。 予圧応答性を評価するために、流体チャレンジを実行する必要があります。 250mlの液体(結晶質またはコロイド)を5分以上急速に注入し、SVに対する効果を客観的に評価する。 効果が増加または減少である場合>10%、患者は流体応答性がなくなるまで予圧を最適化するために流体ボーラスを受け続けるべきで 流動膠灰粘土を要求しない肺の浮腫および混雑の印の患者のために、受動の足の昇給はすることができる–流動挑戦のための必要性を除くために 応答が有利であれば、実際の流体の挑戦を与えることができます。
後負荷を操作する(薬理学的支持):後負荷は、心室が血液を排出している抵抗であり、時にはSVRとして推定される。 後負荷が高く、COが低く、末梢perf流が悪い、肺浮腫の証拠を示すLoHF患者では、後負荷を軽減すべきである。 血管拡張剤を用いた薬理学的支持は、収縮期血圧≧110mmHgのLoHF患者に与えられるべきである。 収縮期血圧<90mmHGおよび平均動脈圧<65mmHgの患者では、臓器灌流を複雑にする可能性のある低血圧のリスクのた これらの患者では、inotropesが治療の最初の行として推奨されています。
収縮性を改善する(薬理学的サポート): 患者が心拍数、前負荷および後負荷のための介在にもかかわらずティッシュのhypoperfusionまたは減らされた酸素配達の証拠と持続すれば、contractilityを改善する処置は その間、最大限に活用する酸素配達はヘモグロビン≤10g/dlおよび最適の酸素の飽和(Sao2)を保障することを向け続けられるべきです。 心筋収縮性に悪影響を及ぼす因子は、高カリウム血症、低マグネシウム血症、低カルシウム血症、重度のアシドーシス、低酸素症および低血糖であり、これは 低血圧および/または低CIを有するLoHF患者における収縮性およびその後のCOを改善するために、末梢灌流または鬱血の徴候が存在する場合には、Inotropes 但し、Dobutamine(inotrope)を使用して病理学サポートはavのノード伝導を高め、速い心室のリズムを沈殿させることができるので頻脈かAFがある患者で注意して使用される 一方では、levosimendanは激しい心筋のischemicまたはポストの心臓外科を用いるlohfの患者で心筋の酸素の要求を増加しないので推薦されます。 Inotropesの長期効果は有害であることができ、安定性が達成されたらこうして使用は停止されるべきです。 昇圧剤は、SVRを増加させ、その後COを損なうため、低出力状態での第一選択薬であってはならない。 しかし、低出力状態の根本的な原因として敗血症を有する患者には、昇圧剤および不飽和脂肪酸の二重療法が推奨される。
デバイス療法:最適な医療療法がCOおよび組織酸素化の回復に失敗した場合、LoHF患者でデバイス療法を考慮する必要があります。 一般的な装置療法には、大動脈内バルーンポンプ(IABP)および心室補助装置(VAD)が含まれる。 Iabpの使用は、虚血性心疾患、前または後の経皮的介入または心臓手術後のLohf患者において一般的である。 IABPは、大腿動脈を通って大動脈に挿入されるバルーンで構成される。 バルーンは拡張期の間に膨張し、収縮期の間に収縮して拡張期血圧およびその結果として冠状灌流を増加させ、それによってCOを増加させる後負荷を減 一方、VADの使用はまれです。 それは専門家の中心でだけ使用することができる。 それは好ましい生活環境基準の患者の心臓移植または激しい心筋炎の患者の回復への橋として一般的です。
根本的な原因の治療
LoHF患者の低出力状態のいくつかの原因は、特定の治療法で逆転することができます。 可逆的な原因は、初期の臨床評価中に早期に同定されるべきである。 これらの原因には、急性心筋梗塞、心タンポナーデ、緊張気胸、肺塞栓症、および急性弁不全が含まれる。 (表3)。
診断および臨床管理のメタ分析
LoHFの臨床診断の基礎は、COおよびSvo2の減少の証拠を伴うLV/RV収縮期機能不全および/またはLV拡張期機能 うっ血および灌流の測定に基づく血行力学的プロファイルは、急性HF患者を乾燥-暖かい(A)、湿潤-暖かい(B)、乾燥-冷たい(L)および湿潤冷たい(C)の四つのプロフ LoHF患者は、鬱血の有無および/または末梢灌流の不十分さに基づいて、プロファイル(L)および(C)に分類されている。 これら二つの血行力学的プロファイルは、臨床試験でLoHF患者を選択するための基礎を形成しているだけでなく、提示時に患者を分類し、初期療法の選択 現在のメタアナリシスの目標は、LoHF患者の共通の診断特徴および治療結果の公表された証拠を集約することである。
検索戦略
LoHFの診断と臨床管理を調査する研究のために、2018年の開始以来、三つの主要なオンラインデータベース(PubMed、EMBASE、Cochrane)が体系的に検索されました。 タイトルや要約にLoHFに言及していない研究を見落とすことを避けるために、全文Google Scholar検索で取得された最初の200の関連性ランクの記事が含まれてい 出版時間や言語の制限は適用されませんでした。 追加の研究は、包含された研究からの参照のリストの手動検索を通じて同定されただけでなく、関連するレビュー記事から、その後、包含基準に供された。 検索基準には、関心のある集団(LoHFまたはLCOS患者)、関心のある診断検査(心エコー検査および血行動態プロファイル)、および関心の介入(人工呼吸器戦略、容積調整、薬理学的支援およびデバイス療法)が含まれていた。 研究は、以下の基準を満たしている場合に含まれていた:(a)LoHF患者が含まれていた; (b)心エコー検査および血行力学的プロファイルを用いて診断された;(c)血行力学的安定化のために治療された患者;および(d)報告された治療結果。 重複したデータを報告した研究の場合、最大数の患者を提供した研究のみが含まれていた。 会議の抄録、症例報告、レビュー記事は除外されました。
研究の選択
図4は、適格な研究を含めるために使用される検索およびスクリーニングプロセスを示しています。 二つのレビュアーは、体系的なオンライン検索から検索されたすべてのタイトルと抄録を独立して上映しました。 母集団、介入、および関心のある結果を含む抄録は、全文検索のために含まれていました。 その後、二つの査読者はまた、独立して、包含基準に対して全文記事をレビューしました。 不一致の場合には、それは議論と合意によって解決された。

図4。 文献検索と包含プロセスのフロー図
データ収集
二つのレビュアーは、独立して含まれている研究からデータを抽出し、任意の不一致は、コンセンサス 抽出された主なデータは、心エコーおよび血行力学的プロファイルデータであり、使用される治療および血行力学的(心臓指数、PCWP)および死亡率に関する治療転 これらの主要なデータに加えて、2人の査読者はまた、研究の特徴、患者の特徴およびフォローアップ期間に関するデータを抽出した(表4)。
統計分析
複数の研究で報告されている関心のあるアウトカムは、心臓指数、PCWPおよび死亡率である。 各アウトカムについて、介入前後の要約統計(平均±標準偏差)、またはベースラインと治療後の差を抽出した。 これらの要約統計は、治療群および対照群/プラセボ群について別々に抽出された。 診断結果および治療効果は、介入前後の手段の差および関連する95%信頼区間によって測定した。 森林プロットは、視覚的に研究全体で異質性(I2)を調べるために使用されました。 プールされた診断および治療効果および関連する95%信頼区間は、固定効果(I2<49%)またはランダム効果モデル(I2>50%)を用いて推定した。 P値>0.05は統計的に有意であると考えられました。
結果
研究特性
十二(12)ランダム化比較試験(RCTs)は、包含基準を満たしました。 七(7)の研究は、LoHF患者を登録し、残りの五(5)は、低心拍出量と心臓手術を受けているHF患者を登録しました。 出版された臨床試験(10)の大半は死の血行力学そして防止に対する異なったタイプのinotropesの効果を比較する薬物を調査しました:dobutamineだけ、dobutamineおよびドーパミン;levosimendan 残りの2つの臨床試験のうち、それぞれが血管拡張薬(nitroprusside)とプラセボ、およびデバイス療法(IABP)とinotrope(levosimendan)を単独でまたはIAPBと組み合わせて調査しました。 全体として、12の臨床試験は3,738人の患者を登録し、平均年齢64歳(範囲=55-74歳)であり、大多数は男性(78%)であった。
結果の合成
LoHFに関する診断データは矛盾していた。 12件の臨床試験では、診断を導くのに有用なLoHFの一般的な定義は現れていませんでした。 試験に患者を含めるために使用された血行力学的基準には、CI<2.0L/min/m2、CI<2.2L/min/m2またはCI<2.5L/min/m2およびPCWP>15mmhgまたは≥18mmhg。 定義はまた、低血圧(収縮期血圧<90mmHgのための>>90mmHgおよび臓器内低灌流(冷たい末梢、尿出力<30ml/時間)。 心原性ショックは、急性左室機能不全、COの減少、低血圧および組織低灌流のカスケードを含む複雑な症候群として記載されている。
図5および図6は、それぞれベースラインおよびinotropeまたは血管拡張療法に続く心臓指数の標準化された平均の森林プロットを示しています。 ベースライン心臓指数は平均1.93(95%CI:1.91-1.95)から治療後平均2.82(95%CI:2.80-2.84)に増加した。 図7は、レボシメンダンとドブタミンによる治療後の心臓指数の標準平均差(SMD)の森林プロットを示しています。 レボシメンダンはドブタミンと比較して高い心臓指数を達成する(SMD:2.82;95%CI:2.54-3.10)。 術後患者におけるLoHFに対する予防として、麻酔後のレボシメンダン注入は、術前IABP(2.3)またはレボシメンダン(2.4)の組み合わせと比較して、より高い心臓指数(2.57)を達成した。 図8は、レボシメンダンとプラセボの間の死亡率の森林プロットを示しています。 レボシメンダンはプラセボと比較して死亡率が低かった(オッズ比:0.83;95%CI:0.59-1.18)が、その差は統計的に有意ではなかった(p=0.30)。 最後に、図9はさらに、レボシメンダンの死亡率がドブタミンと比較して低いことを示しています(OR:0.65;95%CI:0.39-1。08) but the difference was not statistically significant (p=0.10).
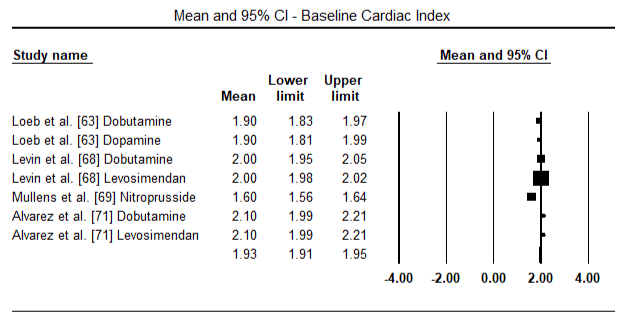
Figure 5. Mean baseline cardiac index
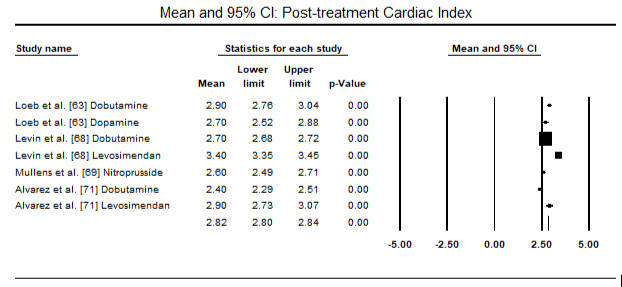
Figure 6. Mean post-treatment cardiac index
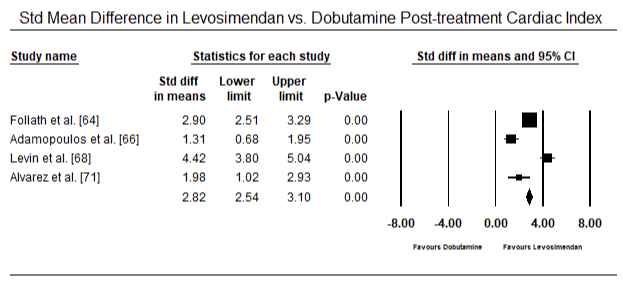
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
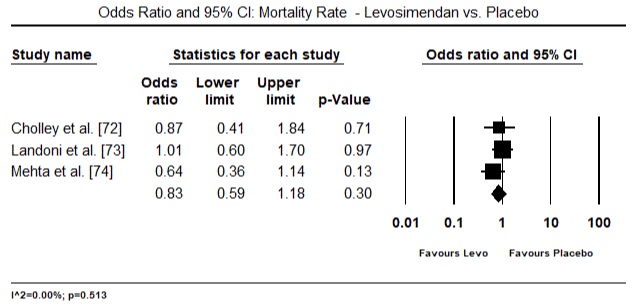
Figure 8. Mortality rate between levosimendan and placebo
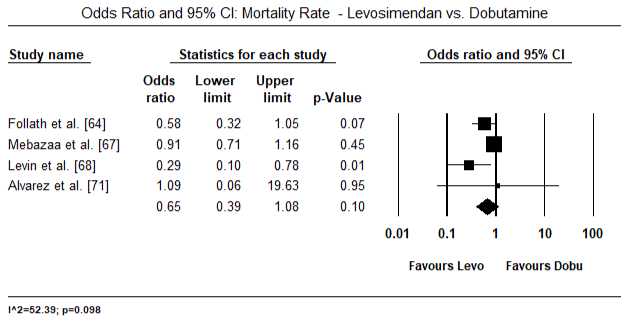
Figure 9. レボシメンダンとドブタミンの死亡率
所見の議論
このシステマティックレビューとメタアナリシスは、LoHF患者に対する医療および装置療法(IABP)の共通の診断機能、および治療成績を評価した。 結果は、LoHF患者は広く受け入れられているか、標準化された診断機能を欠いていることを示しています。 LoHF患者は、臨床診断を示唆またはサポートするために心臓指数、PCWP、収縮期BPおよびSvo2を含むいくつかの特徴を示すことができるが、これらの特徴はすべ LoHFにおける低出力状態を示す最も一般的な臨床的特徴である心臓指数は、三つのカットオフ値を有する:<2.0L/min/m2、<2.2L/min/m2または<2.5l/min/m2。 変力性支持は、灌流を改善し、LoHF患者における心拍出量を正常化するための非常に一般的な介入として浮上した。
レボシメンダン、ドブタミン、ドーパミン、血管拡張剤(ニトロプルシド)およびIABPなどの変力性薬物は、ベースラインと治療後の間のCIを有意に改善した。 Inotropesの点では、levosimendanはdobutamineより短期死(30日の死亡率)に対して血行力学の安定性そしてよりよい予防することの改善で有効です。 さらに、inotropesは、術後LoHFの発症に対する予防として作用することができる。 一方では、inotropesは血行力学を改善し、心拍出量を正常化する間、使用されるinotropeのタイプにもかかわらず死亡率に対してかなりよりよい保護を提供しません。
LoHFの治療におけるinotropesの役割は、心原性ショックおよびLCOSの治療のための変力剤および血管拡張剤戦略の以前のレビューによって支持されている。 Inotropesで報告されたレビューは、術後LCOSにおける血行力学的、有害事象および死亡率の低下を改善する。 Levosimendan(カルシウム増感剤およびinodilator)のようなより新しいinotropesは肯定的なinotrope持っていますあるvasodilatory特性をです。 それはまた肝動脈をvasodilatingなしで門脈の流れだけを改善できるdobutamineと比較される肝動脈および門脈の流れを通って門脈の流れを改善できる選択的なレバー vasodilator Levosimendanはまた心筋の酸素の要求を高めないし、激しい心筋のischemicまたはポストの心臓外科を用いるLoHFの患者のdobutamineに推薦されます。 術後LoHFの場合、短期死亡率(30日死亡率)に対するinotropesの保護効果は、プラセボと比較して重要ではないままである。
現在のシステマティックレビューとメタ分析にはいくつかの重要な制限があります。 LoHFは激しい心筋梗塞のような根本的な心疾患に二次にまたは後操作中発生してもよいです。 ほとんどの研究には、他の原因からのLoHFの提示が少ない術後LoHFの調査が含まれていました。 研究のほとんどは、他のinotropesだけでなく、デバイス療法などの他の治療法の理解を制限し、二つのinotropes(レボシメンダンとドブタミン)に焦点を当てました。 いくつかの試験では、分析は、かなりの数の患者がフォローアップに失われたために誤分類バイアスのリスクがあった。 ほとんどの試験では、関連する標準偏差を伴う介入前および介入後の差、標準偏差を伴う介入前および介入後の差、介入前および介入後のアウトカム測定が独立していると報告されていないため、これは関連する標準偏差を伴う治療効果に対するサイダー信頼区間を得る。
結論
低出力心不全(LoHF)は、臓器内低灌流を伴う心拍出量の減少を特徴とする臨床症候群である。 それは一般集団の心不全の珍しい形態しかしpost-operation HFの患者で流行していますです。 その病因は不均一であり、低出力状態および心臓手術を引き起こす様々な状態からなる。 主な病態生理学的機序は、左室収縮期および/または拡張期機能不全、および心拍数、前負荷、後負荷および/または収縮性の変化によって引き起こされる LoHFのための一般的な危険率はChagasの病気、落ち込んだ放出の一部分を含み、後操作中の患者で糖尿病および腎臓の機能障害の損なわれたLV機能、不完全なrevascularization、高齢、および存在を含んでいる間、腎機能障害。 診断は、標準化されたガイドラインを欠いており、低出力状態を引き起こす条件を含む血行力学的および生理学的異常の受け入れられた収集に依存 患者の病歴および身体検査は、血行力学的状態を評価し、低出力状態を認識するのに役立ち、心エコー検査は心室機能不全(HF)および低心拍出量を確認する。 診断を支えるか、または低出力の状態の原因を確立する他のテストは心電図および基本的な実験室試験(血、血清の電解物、尿素およびクレアチニン、レバー 治療は、確立されたガイドラインを欠いているが、最も適切な治療戦略を選択するために、個々の病態生理の評価に依存します。 治療には、心拍数とリズムを改善するための人工呼吸器戦略、前負荷を最適化するための体積調整、後負荷を操作して収縮性を改善するための薬理学的 選択された患者では、基礎疾患を逆転させる治療法は、心拍出量を回復させることができる。Inamdar A、Inamdar A(2016)心不全診断、管理および利用。 J Clin Med5:62.