関節リウマチの合併症としての大きな顆粒状リンパ球白血病|Reumatologíaclínica
Introduction
フェルティ症候群(FS)は、関節リウマチ(RA)のまれな全身合併症(1%未満)であり、RA、持続性好中球減少症(3
)および無症状の脾腫から、イメージングによってのみ検出可能なmassive1脾腫までの範囲である様々なサイズの脾腫のトライアドによって特徴付けられる。 これは、主に重度の関節疾患および関節外症状を有する長年の症例で起こり、HLA-DR4ハプロタイプ(症例のほぼ95%)と強い関連を有する。2FSを有する患者の30%-40%において、大きな顆粒リンパ球(LGL)の拡張がある。1LGLは循環単核細胞の10%–15%を表し、その大きなサイズ(15-18μ m)、それらの円形またはインデントされた核およびazurophilic顆粒を有する豊富な細胞質によって形態学 これらの細胞の表現型は、細胞傷害性Tリンパ球(CD8+、CD5 7+)またはナチュラルキラー(NK)(CD3−、CD8−、CD5 6+)であり得る。3lglの拡張がモノクローナルであり、これらの細胞による骨髄および脾臓の浸潤と関連している場合、それは大粒状リンパ球白血病(LGLL)と呼ばれ、慢性低悪性 その臨床提示はまた”pseudo-Felty”と呼ばれたようにneutropenia、貧血症および脾腫と関連付けられる細菌感染への高められた感受性を強調するFSのそれに類似してい3,4臨床プレゼンテーション
花崗岩採石場から70歳の退職した労働者は、手、足、膝および腰の関与を伴う血清陽性RAと43歳で診断されました。 その後、じん肺症と肺リウマチ結節を発症した(図。 1)、キャプラン症候群と診断されています。 進行中,Nsaids,コルチコステロイド,金塩,シクロスポリン,メトトレキサートで治療した。 それにもかかわらず、患者は手、足および腰に構造的損傷を発症し、それぞれ51歳および54歳の両方の腰にプロテーゼを配置する必要があった。 近年、彼の病気は安定しており、毎週メトトレキサート10mgおよび低用量のグルココルチコイドで治療され、炎症性関節活性の証拠はない。 彼はすべての指に”グースネック”の変形と肘のリウマチ結節を提示しました。 12ヶ月前、彼は突然、彼の右鼠径部に発熱と痛みを発症し、その後の敗血症性ショックを伴い、サルモネラ菌sppによる右股関節の感染を示した。 メトトレキサートとグルココルチコイドを懸濁し,長期抗生物質療法とプロテーゼの部分置換で治療した。 実験室試験では、骨髄毒性薬の回収および敗血症の改善にもかかわらず、0neutrophils/mm3に達したにもかかわらず、持続的な好中球減少症が証明された。 遡及的に、好中球の数を見直すとき、彼は1800と1000/mm3の間で、前年に低いカウントを持っていました。 残りの血球数と生化学は正常であった。 ESRは80mm/hおよびCRP111mg/lであり、彼はリウマチ因子(6930U/ml)および抗CCP(300U/ml)の高レベルを維持し、またポリクローナル高ガンマグロブリン血症を有していた。 抗核抗体および抽出可能な核抗原は陰性であり、補体レベルは正常値内であった。 HLAタイピングは、彼がハプロタイプDRB1*0404(DR4)を実施し、軽度の脾腫(13.7cm)腹部コンピュータ断層撮影で検出されたことを示した。

塵肺症および肺リウマチ結節。
末梢血塗抹標本は、LGLによるリンパ球増加を示した(図5)。 免疫表現型において、全白血球の4 2%に対応し、細胞傷害性Tリンパ球(CD3+、CD8+、CD5+、CD7+/−、CD4−、CD5 6−およびDR+)の異常な表現型を有する。 骨髄生検は、同じクローン拡張に対応する全骨髄細胞性の20%を示した(TCRガンマの可変領域の再配列によって確認された)。 これらの所見に基づいて、LGLLの診断が行われ、メトトレキサート15mgによる治療は、好中球減少症を持続させる3ヶ月(3
)にもかかわらず、毎週再開され、顆粒生成刺激因子の頻繁な投与が必要であった。 その後,シクロホスファミド,ビンクリスチン,プレドニゾンで高用量で治療した。 治療の6ヶ月後、好中球減少症が持続する。
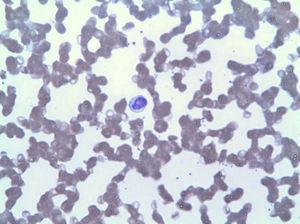
LGLによるリンパ球増加。(0.14MB)。
議論
LGLLは、活性化された細胞傷害性Tリンパ球またはより頻度の低いNK細胞のLGLモノクローナル表現型の拡大を特徴とする慢性白血病である。診断の平均年齢は60年であり、頻繁に自己免疫疾患、特にRAと関連付けられますが、また潰瘍性大腸炎、Sjögrenのシンドローム、エリテマトーデスおよびmultiple1硬化で記 LGLLを関連させたRA患者は、FSと同様の臨床的提示を有する。 彼らは通常、長年のRA、重度の関節損傷および重大な結果、およびリウマチ結節、リンパ節腫脹、前庭性潰瘍、胸膜炎、皮膚色素沈着、神経障害または上痛などの関節外症状の頻度の増加を有する患者である。6この患者はまた、シリカ、石炭または花崗岩などの無機粉塵への職業暴露の病歴を有する患者における典型的なリウマチ結節と同様の組織病理学7我々の知る限り、本症例は、同じ患者におけるキャプラン症候群とLGLLの提示を記述する最初のものである。 ほとんどの場合、提示LGLLは再発細菌感染と関連付けられる厳しいneutropeniaです。 最も一般的に関与する微生物は、黄色ブドウ球菌、連鎖球菌sppである。 およびグラム陰性桿菌。 あまり一般的ではない貧血、発熱、寝汗、肝臓および脾臓の拡大5もそれに付随する可能性があります。 LLGG患者の3分の1までは、診断時に明らかなRA臨床活性を示さないが、高レベルのESRを維持する。6FS患者の40%までがLGLリンパ球増加症を有する。この事実は、臨床的類似性およびHLA−DR4との関連とともに、RAに関連するFSおよびLGLLが、LGLの増殖を特徴とする同一の実体の発現であることを強く示唆8他の形態には、反応性リンパ球増加症およびより攻撃的な形態のNK5LGLLへの感染などのより軽度の形態も含まれる。 LGLL診断は、特徴的な免疫表現型(CD3+、CD4−、CD8+、CD16+、CD28−およびCD57+)を有する末梢血および骨髄におけるLGLのモノクローナル拡張の発見に基づいている。 Clonalityはretcr9遺伝子の調査によって確認されます。 一般に、LGLは慢性および怠惰な進行を有し、平均生存期間は10年である。1まれに、特に拡張がNK表現型を有するLGLによるものである場合、この白血病はより積極的に行動することができる。5治療のための最も一般的な適応は、再発性感染症であり、より少ない頻度で、貧血、症候性脾腫または重度のB症状B1の出現である。
LGLLにおける第一選択治療は、免疫抑制薬単独であり、具体的にはメトトレキサート(10mg/週)、シクロスポリンA(1-1.5mg/kg/1日2回)または経口シクロホスファミド(50–100mg/日)である。 この治療は、患者の約50%において有効であり、細胞減少症の矯正を達成するが、白血病細胞を根絶することはない。1Glucocorticoidsが応答を促進するのに使用することができ、granulopoiesisの刺激因子はneutropeniaの最初の管理に有用です。 難治性患者およびCHOP(シクロホスファミド、ビンクリスチン、ドキソルビシンおよびプレドニゾン)およびリンパ腫のための他のスキームと同様の化学療法レジメンによる非常に積極的な提示治療を有する患者では、試みられているが、その有効性を明確に実証していない。 試験されている他の治療法は、プリン類似体、アレムツズマブ、ボルテゾミブ、脾摘出および同種骨髄移植であり、様々な結果がある。3
結論
FSとLGLLの両方が、有意な構造的損傷および関節外症状を伴う、長年の疾患に現れるRAのまれな合併症である。 長年のRAおよび好中球減少症の患者では、末梢血および/または骨髄におけるLGLのクローン増殖の存在を除外し、LGLLの診断を可能にするべきである。 最初の行の治療は、低用量メトトレキサートなどの免疫抑制薬の使用であり、グルココルチコイドは顆粒生成刺激因子と関連している可能性がある。 化学療法または脾摘出術のような他の処置の様相はある処理し難い場合で可変的な結果を示しました。
倫理的開示
人間および動物の対象の保護。 著者らは、この調査のためにヒトまたは動物に対して実験は行われなかったと宣言している。
データの機密性。 著者らは、患者データの公開に関するワークセンターの議定書に従っており、研究に含まれるすべての患者が十分な情報を受け取り、その研究に参加するた