5.3:ルイス図
ルイスは、与えられた原子の最も外側、または価数、殻に存在していたどのように多くの電子を追跡するために、単純な図(現在ルイス図と呼ばれる)を使用しました。 原子の核、すなわち核と内部電子は化学記号で表され、原子価電子のみが化学記号を囲むドットとして描かれます。 したがって、電子と原子価から図1に示す三つの原子は、以下のルイス図で表すことができます:
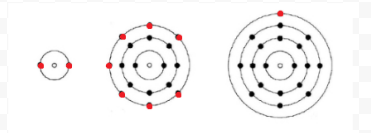

原子が希ガス原子の場合、2つの代替手順が可能です。 原子がゼロ価電子を有すると考えることができるか、または最も外側の充填された殻を価電子殻とみなすことができる。 したがって、最初の三つの希ガスは次のように書くことができます。
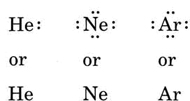
Example\(\PageIndex{1}\):Lewis Structures
次の各要素の原子のルイス図を描く: Li,N,F,Na
溶液
私たちは、Liが3の原子番号を持っていることをフロントカバー内の周期表から見つけます。 このように、希ガスHeよりも1つ以上の電子が3つ含まれています。 これは、最も外側の、または原子価のシェルが一つの電子のみを含み、ルイス図は
同じ推論に続いて、NはHeよりも七つの電子を持ち、Fはheよりも七つの電子を持ち、
![]()
NaはHeよりも9個の電子を持っていますが、そのうちの8個はneの最外殻の8個の電子に対応する核内にあります。 NaはNeよりも1つだけ多くの電子を持っているので、そのルイス図は
![]()
前の例から、アルカリ金属のルイス図は化学記号を除いて同一であることに注意してください。 これはアルカリ金属の非常に類似した化学的挙動とよく一致した。 同様に、アルカリ土類やハロゲンのような他の群のすべての元素についてのルイス図は同じように見える。
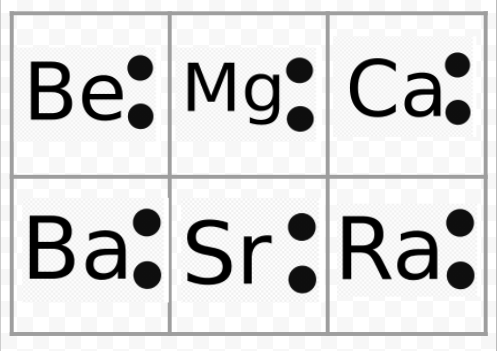
ルイス図は、要素の価数を予測するためにも使用できます。 ルイスは、原子の原子価の数は、その原子価殻内の電子の数、または次の希ガスの電子殻構造を達成するために原子価殻に加えなければならない電子の数に等しいことを示唆した。 それらのルイス図と希ガスHeとNeの図は

BeとHeを比較すると、前者はさらに二つの電子を持っているので、2の価数を持つべきであることがわかります。 元素Oは6個の原子価電子(Neより2個小さい)を持っているので、6の原子価または2の原子価を持つと予想されるかもしれません。 このようにして開発された原子価の規則を使用して、ルイスは原子価のセクションで見つかった表中の化合物の添字の規則的な増加と減少を説明することができ、ここで再現された。 さらに、彼は表の数式の50%以上を占めることができました。 (彼のアイデアに同意するものは、テーブルの色で陰影付けされています。 今すぐその表を参照し、示された数式のいくつかがLewisの規則に従っていることを確認することができます。)ルイスのこの接続の成功は、分子が形成されたときに電子が原子を一緒に保持する上で最も重要な要因であることを明確に示した。
これらの成功にもかかわらず、ルイスの理論、特に周期表のカルシウムを超えた元素についても困難があります。 例えば、元素Br(Z=35)は、希ガスAr(Z=18)よりも17個多くの電子を有する。 これにより、Brは17個の価電子を有すると結論づけられ、これら2つの原子が7個の価電子しか持たないにもかかわらず、BrがClとFに非常に密接に似ている理由を説明するのは厄介なことになります。
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. ムーア(Uw-マディソン)、ジャスティン-ショーブ(ホープ-カレッジ)、ザビエル-プラット=レジーナ(ミネソタ-ロチェスター大学)、ティム-ウェンドルフ、アダム-ハーン。
div