Focalin XR – Pharmacology dexmethylphenidate hydrochloride
Clinical Pharmacology
mechanism of action
Dexmethylphenidate hydrochloride is a CNS stimulant. The mode of therapeutic action in ADHD is not known.
pharmacodynamics
Dexmethylphenidate is the more pharmacologically active d-enantiomer of racemic methylphenidate. メチルフェニデートはシナプス前ニューロンにノルエピネフリンおよびドーパミンのreuptakeを妨げ、extraneuronalスペースにこれらのmonoaminesの解放を高めます。
心臓電気生理学
推奨される最大総一日投与量40mgでは、Focalin XRはQTc間隔を臨床的に関連する程度まで延長しない。
薬物動態
吸収
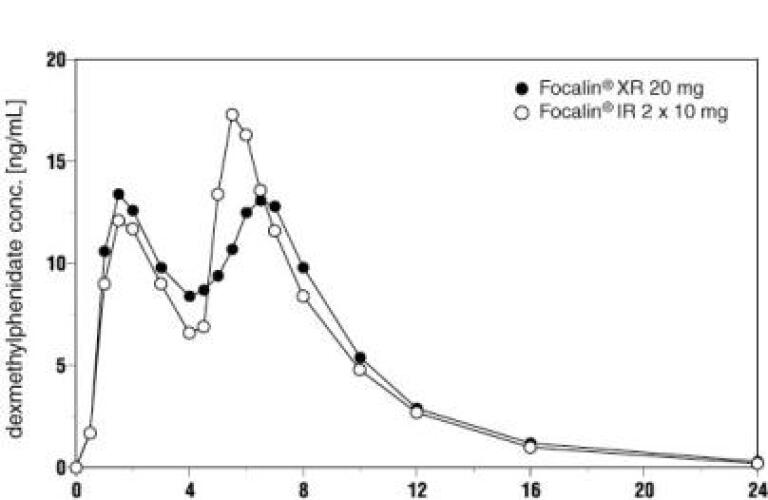
フォカリンXRは、健康な成人に経口投与すると、バイモーダル血漿濃度-時間プロファイル(すなわち、2つの異なるピーク フォカリンXRの初期吸収速度は、2つの製剤間の同様の速度パラメータ、すなわち、最初のピーク濃度(Cmax1)、および最初のピークまでの時間(tmax1)によって示されるように、フォカリン錠剤のそれに類似しており、これは1.5時間(典型的な範囲1-4時間)に達している。 ピーク間最小までの平均時間(tminip)はわずかに短く、第二のピークまでの時間(tmax2)は、一日一回与えられたフォカリンXRのためにわずかに長い(約6.5時間;範囲、4。5から7時間)観察される範囲はFocalin XRのためにより大きいが、2つの線量で4時間離れて与えられるFocalinのタブレットと比較されて(図1を見て下さい)。
一日一回投与されたフォカリンXRは、2回投与されたフォカリン錠剤よりも低い第二のピーク濃度(Cmax2)、高いピーク間最小濃度(Cminip)、および2回投与されたフォカリン錠剤よりも少ないピークおよびトラフ変動を4時間間隔で示す。 これは、遅延放出ビーズからの早期発症およびより長期の吸収によるものである(図1参照)。
一日一回与えられたフォカリンXRの投与後のAUC(0-inf)およびCmaxの幾何平均の比は、それぞれ1.02および0.86であり、2回の用量で与えられたフォカリン錠剤の同じ総用量に対する4時間間隔である。 Cmax、Cmin、およびAUCの変動性は、Focalin XRとFocalin即時放出錠剤の間で類似しており、それぞれに約3倍の範囲があります。
用量の約90%は、放射性標識ラセミメチルフェニデートの経口投与後に吸収される。 しかしながら、最初の通過代謝のために、種々の製剤中に投与されたときのデキスメチルフェニデートの平均絶対生物学的利用能は、22%〜25%であった。
単回投与後、フォカリンXRは5mgから40mgの範囲で用量比例PKを示した。
カプセルを飲み込むことができない患者のために内容物はapplesauceで振りかけられ、管理されるかもしれません。Dexmethylphenidateの血しょう蛋白質の結合は知られていません
分布
; ラセミ体のメチルフェニデートは12%から15%によって血しょう蛋白質に、集中の独立者区切られます。 Dexmethylphenidateは2.65±1.11L/kgの配分の容積を示します。
除去
血漿デキサメチルフェニデート濃度は、フォカリンXRの経口投与後に単相的に低下する。 デクスメチルフェニデートの平均末端除去半減期は、健康な成人で約3時間であった。 小児患者は、2〜3時間の平均でわずかに短い半減期を有する傾向がある。 Dexmethylphenidateは0.40±0の平均クリアランスで除去された。静脈内の管理の後の12のL/hr/kg。
代謝
ヒトでは、デキスメチルフェニデートは、主にd-α-フェニル-ピペリジン酢酸(d-リタリン酸としても知られる)への脱エステル化を介して代謝される。 この代謝産物は薬理学的活性をほとんどまたは全く有していない。 L-threo-鏡像異性体へのin vivoでの相互変換はない。
排泄
ヒトにおける放射性標識ラセミメチルフェニデートの経口投与後、放射能の約90%が尿中に回収された。 ラセミ体(d,l-)メチルフェニデートの主な尿代謝産物はd,l-リタリン酸であり、投与量の約80%に関与していた。 親化合物の尿中排excretionは、静脈内投与量の0.5%を占めた。
特定の集団における研究
男性および女性患者
フォカリンXRの投与後、最初のピーク(Cmax1)は女性で平均45%高かった。 ピーク間最小値と第二ピークも女性でわずかに高い傾向があり,これらのパターンは体重正常化後も残っていた。
人種的または民族的グループ
薬物動態の民族的変異を検出するためのフォカリンXRの使用経験は不十分である。
小児患者
フォカリンXR投与後のデキサメチルフェニデートの薬物動態は、18歳未満の小児科では研究されていない。 ラセミメチルフェニデートの同様の製剤を15歳から10歳までの患者、3歳から7歳までのADHD患者で検討したところ、最初のピークまでの時間は類似していたが、ピーク最小までの時間と第二のピークまでの時間は遅れており、成人に比べて小児患者ではより可変であった。 小児患者および成人に同じ用量を投与した後、小児患者の濃度は、成人で観察された濃度の約二倍であった。 このより高い露出はdexmethylphenidateのpharmacokinetic変数(すなわち、配分の整理そして容積)の関連した年齢関連の相違が線量および重量への正常化の後で観察されないのでよ
腎機能障害を有する患者
腎機能障害を有する患者には、フォカリンXRの使用経験はない。 腎クリアランスはメチルフェニデート除去の重要な経路ではないので,腎障害はフォカリンX rの薬物動態にほとんど影響を及ぼさないと予想される。
肝障害を有する患者
肝障害を有する患者には、フォカリンXRの使用経験はない。
薬物相互作用研究
メチルフェニデートは、臨床的に関連する程度にシトクロムP450(CYP)アイソザイムによって代謝されない。 CYPsの誘導剤または阻害剤は、メチルフェニデートの薬物動態に関連する影響を及ぼすことは期待されていない。 逆に、メチルフェニデートのd-およびl-鏡像異性体は、関連性CYP1A2、2C8、2C9、2C19、2D6、2E1または3Aを阻害しなかった。 臨床的に、メチルフェニデート共投与は、CYP2D6基質デシプラミンの血漿濃度を増加させなかった。