2.1: Evolution of Atomic Theory
atomteori efter det nittende århundrede
hvis stof var sammensat af atomer, hvad var atomer sammensat af? Var de de mindste partikler, eller var der noget mindre? I slutningen af 1800 ‘ erne undersøgte en række forskere, der var interesseret i spørgsmål som disse, de elektriske udladninger, der kunne produceres i lavtryksgasser, med den mest betydningsfulde opdagelse foretaget af den engelske fysiker J. J. Thomson ved hjælp af et katodestrålerør. Dette apparat bestod af et forseglet glasrør, hvorfra næsten al luft var fjernet; røret indeholdt to metalelektroder. Når højspænding blev påført over elektroderne, optrådte en synlig stråle kaldet en katodestråle mellem dem. Denne stråle blev afbøjet mod den positive ladning og væk fra den negative ladning og blev produceret på samme måde med identiske egenskaber, når forskellige metaller blev anvendt til elektroderne. I lignende eksperimenter blev strålen samtidigt afbøjet af et påført magnetfelt, og målinger af omfanget af afbøjning og magnetfeltstyrken tillod Thomson at beregne forholdet mellem ladning og masse af katodestrålepartiklerne. Resultaterne af disse målinger viste, at disse partikler var meget lettere end atomer (figur \(\Sideindeks{1}\)).
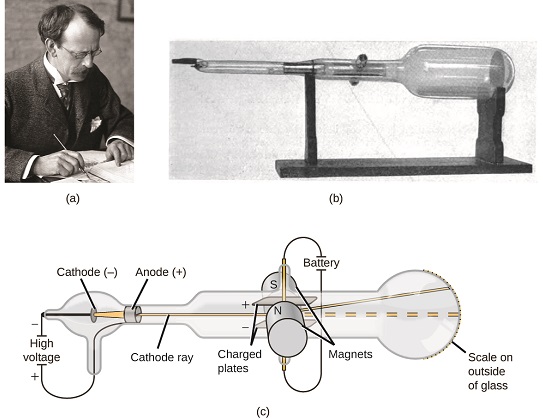
figur \(\Sideindeks{5}\): (a) J. J. Thomson producerede en synlig stråle i et katodestrålerør. (B) Dette er et tidligt katodestrålerør, opfundet i 1897 af Ferdinand Braun. (c) i katodestrålen kommer strålen (vist i gul) fra katoden og accelereres forbi anoden mod en fluorescerende skala i enden af røret. Samtidige afbøjninger ved anvendte elektriske og magnetiske felter tillod Thomson at beregne masse-til-ladningsforholdet for partiklerne, der komponerer katodestrålen. (kredit a: ændring af arbejde af Nobel Foundation; kredit b: ændring af arbejde af Eugen Nesper; kredit c: ændring af arbejde af “kurson”/Commons).
baseret på hans observationer er her, hvad Thomson foreslog, og hvorfor: partiklerne tiltrækkes af positive (+) ladninger og frastødes af negative (−) ladninger, så de skal være negativt ladede (som ladninger afviser og i modsætning til ladninger tiltrækker); de er mindre massive end atomer og kan ikke skelnes, uanset kildematerialet, så de skal være grundlæggende, subatomære bestanddele af alle atomer. Selvom det var kontroversielt på det tidspunkt, blev Thomsons ide gradvist accepteret, og hans katodestrålepartikel er det, vi nu kalder en elektron, en negativt ladet, subatomær partikel med en masse mere end tusind gange mindre end et atom. Udtrykket ” elektron “blev opfundet i 1891 af den irske fysiker George Stoney, fra” elektrisk ion.”
i 1909 blev mere information om elektronen afdækket af den amerikanske fysiker Robert A. Millikan via hans” oliedråbe ” eksperimenter. Millikan skabte mikroskopiske oliedråber, som kunne oplades elektrisk ved friktion, når de blev dannet eller ved hjælp af røntgenstråler. Disse dråber faldt oprindeligt på grund af tyngdekraften, men deres nedadgående fremskridt kunne sænkes eller endda vendes af et elektrisk felt lavere i apparatet. Ved at justere den elektriske feltstyrke og foretage omhyggelige målinger og passende beregninger var Millikan i stand til at bestemme ladningen på individuelle dråber (figur \(\Sideindeks{2}\)).
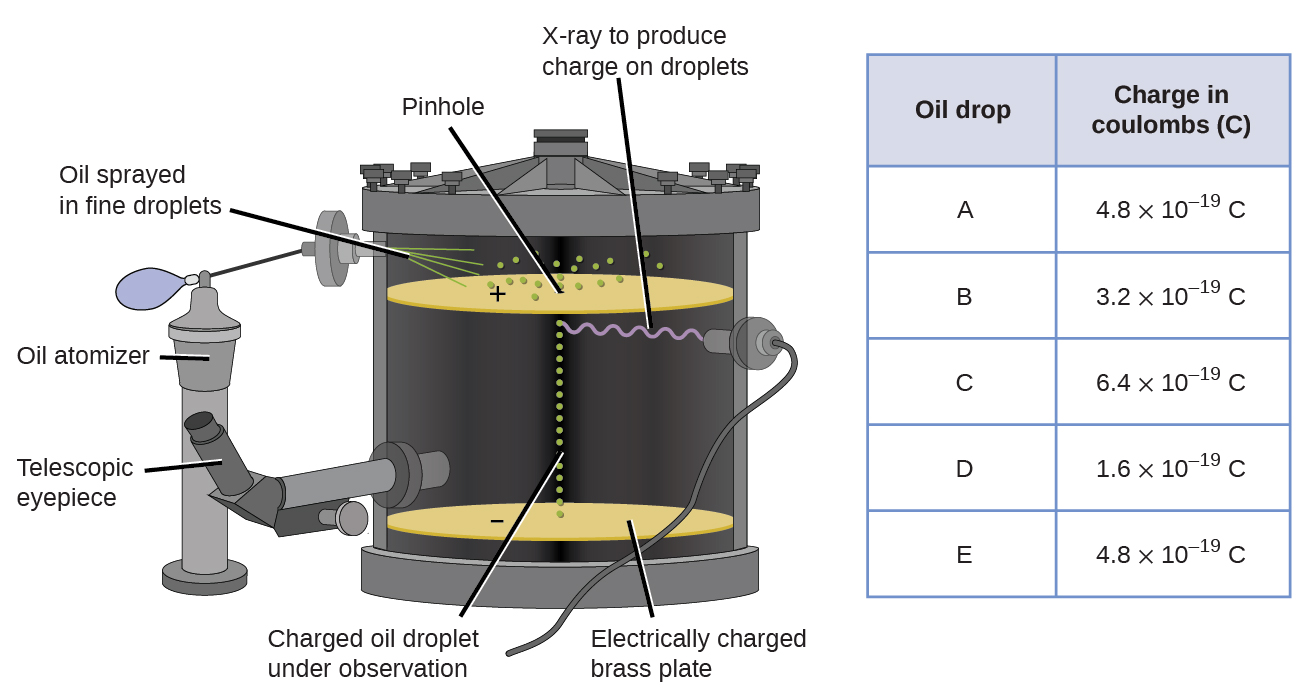
figur \(\Sideindeks{6}\): Millikans eksperiment målte ladningen af individuelle oliedråber. De tabulerede data er eksempler på nogle få mulige værdier.
når du ser på de ladningsdata, som Millikan indsamlede, har du måske erkendt, at ladningen af en oliedråbe altid er et multiplum af en bestemt ladning, 1,6 \(\gange\) 10-19 C. Millikan konkluderede, at denne værdi derfor skal være en grundlæggende ladning—ladningen af en enkelt elektron—med hans målte ladninger på grund af et overskud af en elektron (1 gange 1.6 \(\gange\) 10-19 C), to elektroner (2 gange 1,6 \(\gange\) 10-19 C), tre elektroner (3 gange 1,6 \(\gange\) 10-19 C) og så videre på en given oliedråbe. Da ladningen af en elektron nu var kendt på grund af Millikans forskning, og forholdet mellem ladning og masse allerede var kendt på grund af Thomsons forskning (1.759 \(\gange\) 1011 C/kg), krævede det kun en simpel beregning for også at bestemme elektronens masse.
\
forskere havde nu fastslået, at atomet ikke var udeleligt, som Dalton havde troet, og på grund af Thomson, Millikans og andres arbejde var ladningen og massen af de negative, subatomære partikler—elektronerne—kendt. Imidlertid var den positivt ladede del af et atom endnu ikke godt forstået. I 1904 foreslog Thomson “plum pudding” – modellen af atomer, der beskrev en positivt ladet masse med en lige stor mængde negativ ladning i form af elektroner indlejret i den, da alle atomer er elektrisk neutrale. En konkurrerende model var blevet foreslået i 1903 af Hantaro Nagaoka, der postulerede et Saturn-lignende atom bestående af en positivt ladet kugle omgivet af en glorie af elektroner (figur \(\Sideindeks{3}\)).
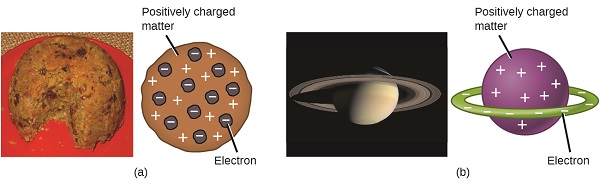
figur \(\Sideindeks{7}\): (A) Thomson foreslog, at atomer lignede blommepudding, en engelsk dessert bestående af fugtig kage med indlejrede rosiner (“blommer”). (B) Nagaoka foreslog, at atomer lignede planeten Saturn, med en ring af elektroner omkring en positiv “planet.”(credit a: ændring af arbejde af “Man vyi”/Commons; credit b: ændring af arbejde af “NASA”/Commons).
den næste store udvikling i forståelsen af atomet kom fra Ernest Rutherford, en fysiker fra Sjælland, der stort set tilbragte sin videnskabelige karriere i Canada og England. Han udførte en række eksperimenter ved hjælp af en stråle af højhastigheds -, positivt ladede alfapartikler (liter-partikler), der blev produceret ved radioaktivt henfald af radium; liter-partikler består af to protoner og to neutroner (du vil lære mere om radioaktivt henfald i kapitlet om nuklear Kemi). Rutherford og hans kolleger Hans Geiger (senere berømt for Geiger-tælleren) og Ernest Marsden sigtede mod en stråle af Karr-partikler, hvis kilde var indlejret i en blyblok for at absorbere det meste af strålingen, mod et meget tyndt stykke guldfolie og undersøgte den resulterende spredning af Karr-partiklerne ved hjælp af en selvlysende skærm, der glødede kort, hvor den blev ramt af en Karr-partikel.
hvad opdagede de? De fleste partikler passerede lige gennem folien uden at blive afbøjet overhovedet. Imidlertid blev nogle omdirigeret lidt, og et meget lille antal blev afbøjet næsten lige tilbage mod kilden (figur \(\Sideindeks{4}\)). Rutherford beskrev at finde disse resultater: “det var den mest utrolige begivenhed, der nogensinde er sket med mig i mit liv. Det var næsten lige så utroligt som om du fyrede en 15-tommers skal på et stykke tissuepapir, og det kom tilbage og ramte dig”1 (s. 68).
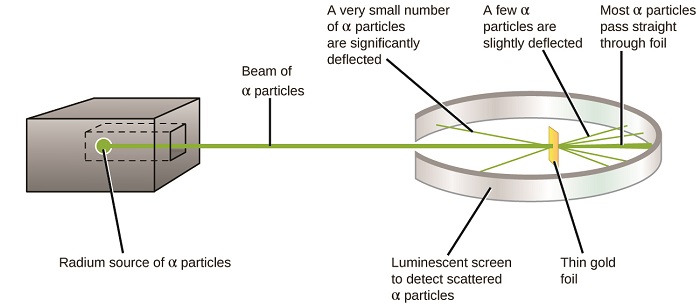
figur \(\Sideindeks{8}\): Geiger og Rutherford fyrede Karp-partikler mod et stykke guldfolie og opdagede, hvor disse partikler gik, som vist i dette skematiske diagram af deres eksperiment. De fleste af partiklerne passerede lige gennem folien, men nogle få blev afbøjet lidt, og et meget lille antal blev signifikant afbøjet.
her er, hvad Rutherford udledte: fordi de fleste af de hurtigtbevægende prispartikler passerede gennem guldatomerne, må de have rejst gennem det væsentlige tomme rum inde i atomet. Alfapartikler er positivt ladede, så afbøjninger opstod, da de stødte på en anden positiv ladning (som ladninger afviser hinanden). Da lignende ladninger frastøder hinanden, må de få positivt ladede kurspartikler, der pludselig ændrede stier, have ramt eller tæt nærmet sig en anden krop, der også havde en stærkt koncentreret, positiv ladning. Da afbøjningerne fandt sted en lille brøkdel af tiden, besatte denne ladning kun en lille mængde plads i guldfolien. Ved at analysere en række sådanne eksperimenter i detaljer trak Rutherford to konklusioner:
- volumenet optaget af et atom skal bestå af en stor mængde tomt rum.
- en lille, relativt tung, positivt ladet krop, kernen, skal være i midten af hvert atom.
denne analyse fik Rutherford til at foreslå en model, hvor et atom består af en meget lille, positivt ladet kerne, hvor det meste af atomets masse er koncentreret, omgivet af de negativt ladede elektroner, så atomet er elektrisk neutralt (figur \(\Sideindeks{5}\)).
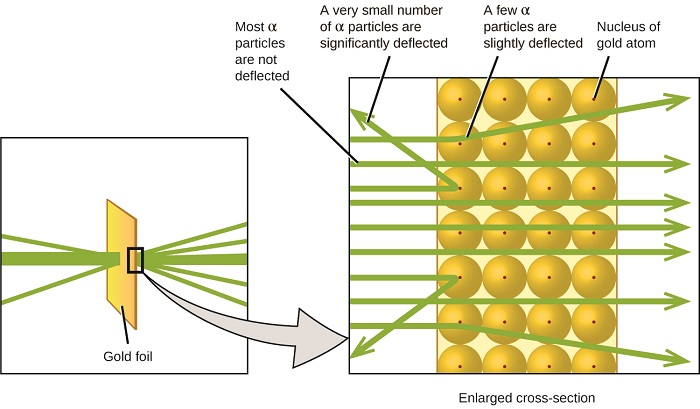
figur \(\Sideindeks{9}\): de røde partikler afbøjes kun, når de kolliderer med eller passerer tæt på den meget tungere, positivt ladede guldkerne. Fordi kernen er meget lille i forhold til størrelsen af et atom, afbøjes meget få liter partikler. De fleste passerer gennem det relativt store område besat af elektroner, som er for lette til at afbøje de hurtigt bevægende partikler.
efter mange flere eksperimenter opdagede Rutherford også, at kernerne i andre elementer indeholder brintkernen som en “byggesten”, og han kaldte denne mere grundlæggende partikel protonen, den positivt ladede, subatomære partikel, der findes i kernen. Med en tilføjelse, som du vil lære næste, bruges denne atommodel af atomet, der blev foreslået for over et århundrede siden, stadig i dag.
et andet vigtigt fund var opdagelsen af isotoper. I begyndelsen af 1900 ‘ erne identificerede forskere flere stoffer, der syntes at være nye elementer, og isolerede dem fra radioaktive malme. For eksempel fik et” nyt element ” produceret af det radioaktive henfald af thorium oprindeligt navnet mesothorium. En mere detaljeret analyse viste imidlertid, at mesothorium var kemisk identisk med radium (et andet henfaldsprodukt), på trods af at det havde en anden atommasse. Dette resultat sammen med lignende fund for andre elementer førte den engelske kemiker Frederick Soddy til at indse, at et element kunne have typer atomer med forskellige masser, der kemisk ikke kunne skelnes. Disse forskellige typer kaldes isotoper-atomer af det samme element, der adskiller sig i masse. Soddy blev tildelt Nobelprisen i kemi i 1921 for denne opdagelse.
et puslespil forblev: kernen var kendt for at indeholde næsten hele massen af et atom, hvor antallet af protoner kun leverede halvdelen eller mindre af den masse. Der blev fremsat forskellige forslag for at forklare, hvad der udgjorde den resterende masse, herunder eksistensen af neutrale partikler i kernen. Som man kunne forvente, er det meget udfordrende at opdage uladede partikler, og det var først i 1932, at James Chadvick fandt tegn på neutroner, uladede, subatomære partikler med en masse, der var omtrent den samme som protoner. Eksistensen af neutronen forklarede også isotoper: de adskiller sig i masse, fordi de har forskellige antal neutroner, men de er kemisk identiske, fordi de har det samme antal protoner. Dette vil blive forklaret mere detaljeret senere i denne enhed.