Biologibegreber-1.canadiske udgave
vira blev først opdaget efter udviklingen af et porcelænsfilter, kaldet Chamberland-Pasteur-filteret, som kunne fjerne alle bakterier, der var synlige under mikroskopet, fra enhver væskeprøve. I 1886 demonstrerede Adolph Meyer, at en sygdom hos tobaksplanter, tobaksmosaiksygdom, kunne overføres fra en syg plante til en sund gennem flydende planteekstrakter. I 1892 viste Dmitri Ivanovsky, at denne sygdom kunne overføres på denne måde, selv efter at Chamberland-Pasteur-filteret havde fjernet alle levedygtige bakterier fra ekstraktet. Alligevel var det mange år, før det blev bevist, at disse “filtrerbare” smitsomme stoffer ikke blot var meget små bakterier, men var en ny type lille sygdomsfremkaldende partikel.
virioner, enkeltviruspartikler, er meget små,omkring 20-250 nanometer (1 nanometer = 1/1.000. 000 mm). Disse individuelle viruspartikler er den infektiøse form af en virus uden for værtscellen. 100 gange større), kan vi ikke se vira med et lysmikroskop, med undtagelse af nogle store virioner af poksvirusfamilien (figur 12.3).
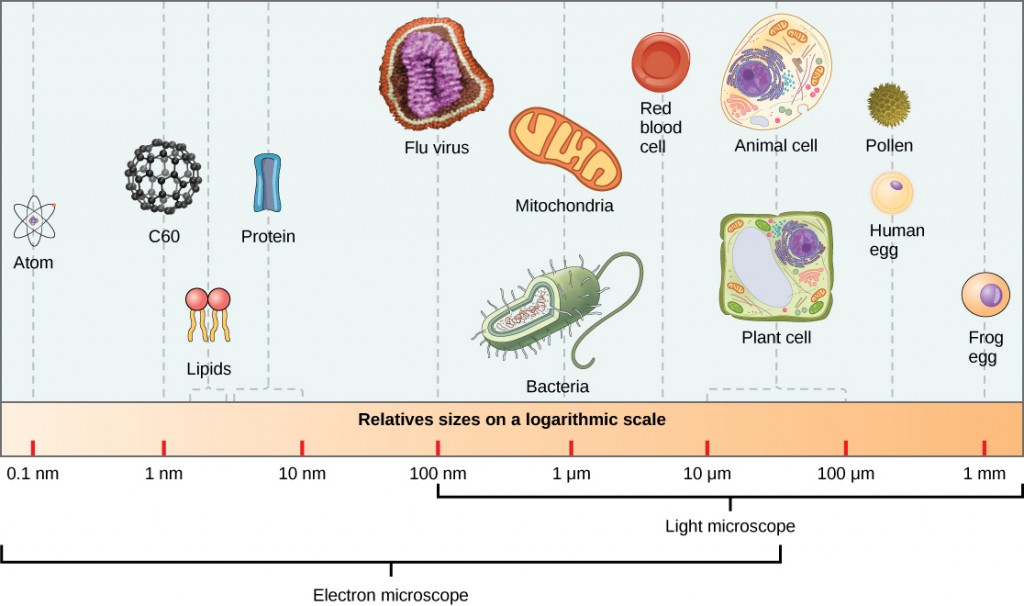
det var ikke før udviklingen af elektronmikroskopet i 1940 ‘ erne, at forskere fik deres første gode syn på strukturen af tobaksmosaikviruset (figur 12.2) og andre. Overfladestrukturen af virioner kan observeres ved både scanning og transmissionselektronmikroskopi, mens virusets indre strukturer kun kan observeres i billeder fra et transmissionselektronmikroskop (figur 12.4).
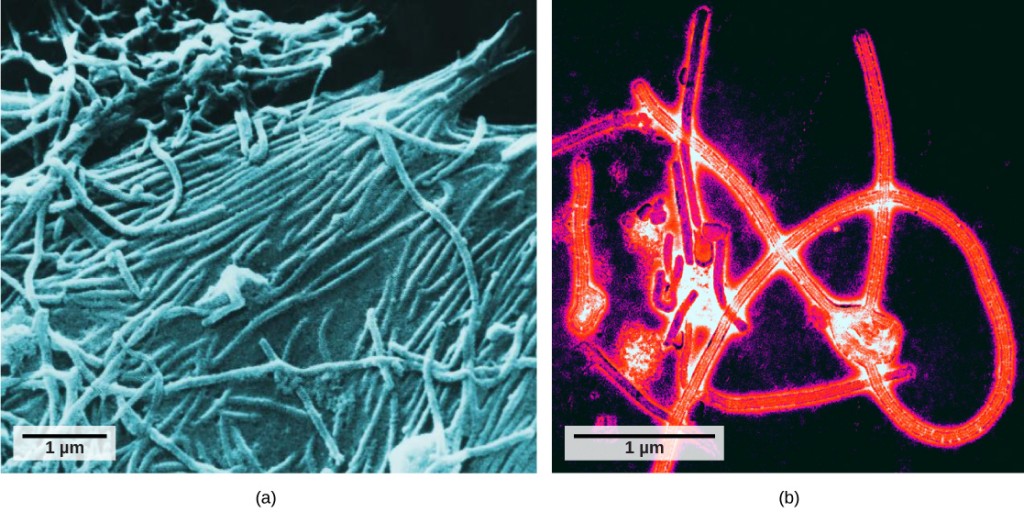
brugen af denne teknologi har gjort det muligt at opdage mange vira af alle typer levende organismer. De blev oprindeligt grupperet efter delt morfologi, hvilket betyder deres størrelse, form og karakteristiske strukturer. Senere blev grupper af vira klassificeret efter den type nukleinsyre, de indeholdt, DNA eller RNA, og om deres nukleinsyre var enkelt – eller dobbeltstrenget. For nylig har molekylær analyse af virale replikationscyklusser yderligere raffineret deres klassificering.
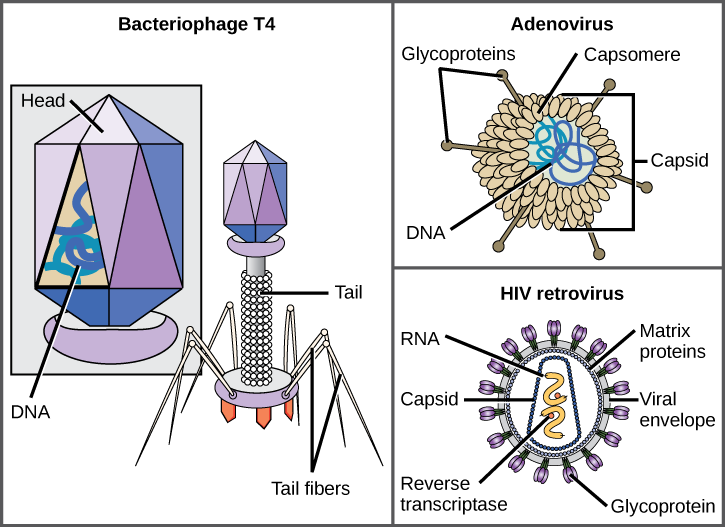
en virion består af en nukleinsyrekerne, en ydre proteinbelægning og undertiden en ydre kuvert lavet af protein-og phospholipidmembraner afledt af værtscellen. Den mest synlige forskel mellem medlemmer af virale familier er deres morfologi, som er ret forskelligartet. Et interessant træk ved viral kompleksitet er, at værtens kompleksitet ikke korrelerer med virionens kompleksitet. Nogle af de mest komplekse virionstrukturer observeres i bakteriofager, vira, der inficerer de enkleste levende organismer, bakterier.
vira findes i mange former og størrelser, men disse er konsistente og forskellige for hver viral familie (figur 12.5). Alle virioner har et nukleinsyregenom dækket af et beskyttende lag af protein, kaldet en kapsid. Capsid er lavet af protein underenheder kaldet capsomeres. Nogle virale capsider er enkle polyhedrale” kugler”, mens andre er ret komplekse i struktur. Den ydre struktur, der omgiver kapsiden af nogle vira, kaldes den virale konvolut. Alle vira bruger en slags glycoprotein til at binde til deres værtsceller ved molekyler på cellen kaldet virale receptorer. Virussen udnytter disse celleoverflademolekyler, som cellen bruger til et andet formål, som en måde at genkende og inficere specifikke celletyper på. For eksempel bruger mæslingsvirus et celleoverfladeglycoprotein hos mennesker, der normalt fungerer i immunreaktioner og muligvis i sæd-æg-interaktionen ved befrugtning. Vedhæftning er et krav for, at vira senere trænger ind i cellemembranen, injicerer det virale genom og afslutter deres replikation inde i cellen.
T4-bakteriofagen, der inficerer E. coli-bakterien, er blandt de mest komplekse virion, der er kendt; T4 har en proteinhalestruktur, som virussen bruger til at fastgøre til værtscellen og en hovedstruktur, der huser dens DNA.
Adenovirus, en ikke-indkapslet dyrevirus, der forårsager luftvejssygdomme hos mennesker, bruger proteinspidser, der stikker ud fra dets capsomerer, til at binde sig til værtscellen. Ikke-indkapslede vira inkluderer også dem, der forårsager polio (poliovirus), plantarvorter (papillomavirus) og hepatitis A (hepatitis A-virus). Ikke-indkapslede vira har tendens til at være mere robuste og mere tilbøjelige til at overleve under barske forhold, såsom tarmen.
indhyllede virioner som HIV (human immundefektvirus), det forårsagende middel i AIDS (erhvervet immundefektsyndrom), består af nukleinsyre (RNA i tilfælde af HIV) og kapsidproteiner omgivet af en phospholipid-dobbeltlagshylster og dets tilknyttede proteiner (figur 12.5). Skoldkopper, fåresyge og fåresyge er eksempler på sygdomme forårsaget af vira med konvolutter. På grund af konvoluttens skrøbelighed er ikke-indkapslede vira mere modstandsdygtige over for ændringer i temperatur, pH og nogle desinfektionsmidler end omsluttede vira.
samlet set fortæller virionens form og tilstedeværelsen eller fraværet af en konvolut os lidt om, hvilke sygdomme virusserne kan forårsage, eller hvilke arter de kan inficere, men er stadig et nyttigt middel til at begynde viral klassificering.
hvilke af følgende udsagn om virusstruktur er sandt?
A) alle vira er indkapslet i en viral membran.
B) capsomeren består af små proteinunderenheder kaldet capsider.
C) DNA er det genetiske materiale i alle vira.
D) glycoproteiner hjælper viruset med at binde sig til værtscellen.
<!- D – >
i modsætning til alle levende organismer, der bruger DNA som deres genetiske materiale, kan vira bruge enten DNA eller RNA som deres. Viruskernen indeholder genomet eller det samlede genetiske indhold af virussen. Virale genomer har tendens til at være små sammenlignet med bakterier eller eukaryoter, der kun indeholder de gener, der koder for proteiner, som virussen ikke kan få fra værtscellen. Dette genetiske materiale kan være enkeltstrenget eller dobbeltstrenget. Det kan også være lineært eller cirkulært. Mens de fleste vira indeholder et enkelt segment af nukleinsyre, har andre genomer, der består af flere segmenter.
DNA-vira har en DNA-kerne. Det virale DNA leder værtscellens replikationsproteiner til at syntetisere nye kopier af det virale genom og til at transkribere og oversætte dette genom til virale proteiner. DNA-vira forårsager menneskelige sygdomme som skoldkopper, hepatitis B og nogle kønssygdomme som herpes og kønsvorter.
RNA-vira indeholder kun RNA i deres kerner. For at replikere deres genomer i værtscellen koder genomerne af RNA-vira, der ikke findes i værtsceller. RNA-polymeraser er ikke så stabile som DNA-polymeraser og begår ofte fejl under transkription. Af denne grund forekommer mutationer, ændringer i nukleotidsekvensen i RNA-vira hyppigere end i DNA-vira. Dette fører til hurtigere udvikling og ændring i RNA-vira. For eksempel er det faktum, at influensa er en RNA-virus, en af grundene til, at der er behov for en ny influensavaccine hvert år. Menneskelige sygdomme forårsaget af RNA-vira inkluderer hepatitis C, mæslinger og rabies.
vira kan ses som obligatoriske intracellulære parasitter. Virussen skal fastgøres til en levende celle, tages inde, fremstille dens proteiner og kopiere dens genom og finde en måde at undslippe cellen på, så virussen kan inficere andre celler og i sidste ende andre individer. Virus kan inficere kun visse arter af værter og kun visse celler inden for denne vært. Det molekylære grundlag for denne specificitet er, at et bestemt overflademolekyle, kendt som den virale receptor, skal findes på værtscelleoverfladen for at virussen kan binde sig. Også metaboliske forskelle set i forskellige celletyper baseret på differentiel genekspression er en sandsynlig faktor, hvor celler en virus kan bruge til at replikere. Cellen skal fremstille de stoffer, som virussen har brug for, såsom virusgenomet i sig selv ikke har gener til, eller virussen vil ikke være i stand til at replikere ved hjælp af den celle.
trin af virusinfektioner
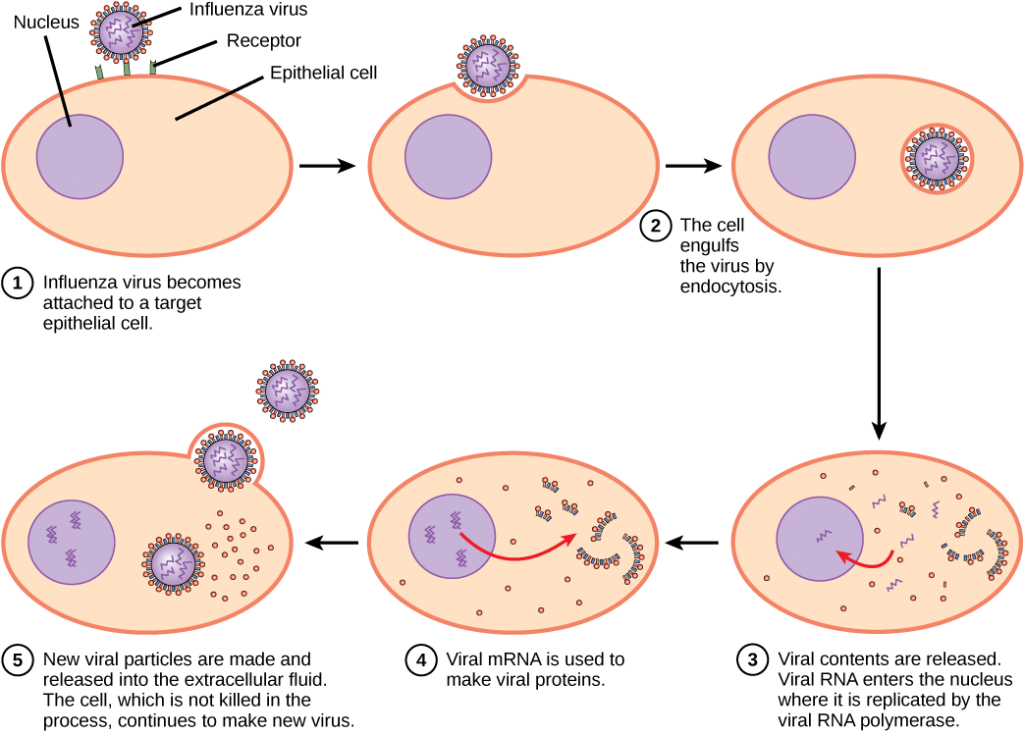
en virus skal “overtage” en celle for at replikere. Den virale replikationscyklus kan producere dramatiske biokemiske og strukturelle ændringer i værtscellen, hvilket kan forårsage celleskader. Disse ændringer, kaldet cytopatiske effekter, kan ændre cellefunktioner eller endda ødelægge cellen. Nogle inficerede celler, såsom dem, der er inficeret med forkølelsesvirus (rhinovirus), dør gennem lysis (sprængning) eller apoptose (programmeret celledød eller “cellemord”) og frigiver alle afkom virioner på en gang. Symptomerne på virussygdomme skyldes immunresponset på virussen, som forsøger at kontrollere og eliminere virussen fra kroppen og fra celleskader forårsaget af virussen. Mange dyrevirus, såsom HIV (human immundefektvirus), forlader de inficerede celler i immunsystemet ved en proces kendt som spirende, hvor virioner forlader cellen individuelt. Under den spirende proces gennemgår cellen ikke lysis og dræbes ikke straks. Imidlertid kan skaden på cellerne, som HIV inficerer, gøre det umuligt for cellerne at fungere som mediatorer af immunitet, selvom cellerne forbliver i live i en periode. Mest produktive virusinfektioner følger lignende trin i virusreplikationscyklussen: vedhæftning, penetration, uncoating, replikation, samling og frigivelse.
en virus binder sig til et specifikt receptorsted på værtscellemembranen gennem fastgørelsesproteiner i kapsidet eller proteiner indlejret i dets konvolut. Vedhæftningen er specifik, og typisk vil en virus kun binde sig til celler af en eller nogle få arter og kun visse celletyper inden for disse arter med de relevante receptorer.
koncept i aktion

se denne video for en visuel forklaring på, hvordan HIV og influens angriber kroppen.
i modsætning til dyrevirus injiceres nukleinsyren af bakteriofager i værtscellen nøgen og efterlader kapsidet uden for cellen. Plante-og dyrevirus kan komme ind i deres celler gennem endocytose, hvor cellemembranen omgiver og opsluger hele virussen. Nogle indhyllede vira kommer ind i cellen, når den virale konvolut smelter direkte sammen med cellemembranen. En gang inde i cellen nedbrydes den virale kapsid, og den virale nukleinsyre frigives, som derefter bliver tilgængelig til replikation og transkription.
replikationsmekanismen afhænger af det virale genom. DNA-vira bruger normalt værtscelleproteiner til at fremstille yderligere DNA, der bruges til at kopiere genomet eller transkriberes til messenger RNA (mRNA), som derefter bruges til proteinsyntese. RNA-virus, såsom RNA-virus, bruger normalt RNA-kernen som en skabelon til syntese af viralt genomisk RNA og mRNA. Det virale mRNA oversættes til virale proteiner og kapsidproteiner for at samle nye virioner (figur 12.6). Selvfølgelig er der undtagelser fra dette mønster. Hvis en værtscelle ikke leverer de nødvendige til viral replikation, leverer virale gener informationen til direkte syntese af de manglende proteiner. Retrovirus, såsom HIV, har et RNA-genom, der skal reverseres for at fremstille DNA, som derefter indsættes i værtens DNA. For at konvertere RNA til DNA indeholder retrovirus gener, der koder for den virusspecifikke reverse transkriptase, der transkriberer en RNA-skabelon til DNA. Det faktum, at HIV producerer nogle af sine egne symptomer, som ikke findes i værten, har gjort det muligt for forskere at udvikle lægemidler, der hæmmer disse symptomer. Disse lægemidler, herunder revers transkriptasehæmmer, hæmmer HIV-replikation ved at reducere aktiviteten af det aktive stof uden at påvirke værtens metabolisme.
den sidste fase af viral replikation er frigivelsen af de nye virioner i værtsorganismen, hvor de er i stand til at inficere tilstødende celler og gentage replikationscyklussen. Nogle vira frigives, når værtscellen dør, og andre vira kan efterlade inficerede celler ved at spire gennem membranen uden direkte at dræbe cellen.
virus er pakket i en viral kuvert, som smelter sammen med plasmamembranen. På denne måde kan virussen forlade værtscellen uden at dræbe den. Hvilken fordel får virussen ved at holde værtscellen i live?
<!- Værtscellen kan fortsætte med at fremstille nye viruspartikler.–>
koncept i aktion

klik gennem denne tutorial om vira for at identificere strukturer, transmissionsformer, replikation og mere.