Cellebiologi 07: mikrotubuli og celledeling
Dette er noter fra forelæsning 7 af Harvard-udvidelsens Cellebiologikursus.
Foredrag 6 introducerede mikrotubuli, og dette foredrag vil diskutere deres rolle i celledeling. Her er en introduktionsvideo:
oversigt over cellecyklussen
cellecyklussen – processen med celledeling og replikation – styres af en række biokemiske kontakter kaldet cellecyklusstyringssystemet.
cellecyklussen er opdelt i faser, der er opdelt i faser – folk vil henvise til “4 faser”, men så er der faktisk 5, og folk bruger også andre ord til at gruppere disse faser sammen og andre ord til at opdele dem. Jeg har gjort mit bedste for at opsummere forholdet mellem disse udtryk i følgende tabel. (ændret / udvidet):
| MOST general grouping | the supposed “4 phases” | subphases |
|---|---|---|
| non-dividing | Gap 0 (G0) | |
| interphase | Gap 1 (G1) | G1a R G1b |
| Synthesis (S) | ||
| Gap 2 (G2) | ||
| Mitosis | Mitosis (M) | prophase prometaphase metaphase anaphase telophase cytokinesis |
The

de hurtigst opdelte humane celler kan gennemføre en cellecyklus på cirka 24 timer (G1: 9h, S: 10h, G2: 4h, M: 30 min). Gær kan afslutte en cyklus på 30 minutter, og de hurtigst opdelte Drosophila-celler tager så lidt som 8 minutter.
Master controllere af denne proces omfatter cyklinerne, som regulerer cyclinafhængig kinase eller CDK. Husk at kinaser er proteiner, der phosphorylerer andre proteiner. CDK ‘ s phosphorylering af dets mål gør det muligt for mitose at fortsætte. For at være præcis er modningsfremmende faktor eller MPF et obligatorisk heterodimerisk kompleks sammensat af cyclin B og CDK, som kun gør sin phosphorylerende virkning, når begge proteiner er til stede.
Mikrotubuliens rolle
mikrotubuli er kritiske i hele cellecyklussen – de organiserer cellulære komponenter og deler dem i to. Her er en række videoer af cellecyklussen, der fremhæver mikrotubuliens rolle:
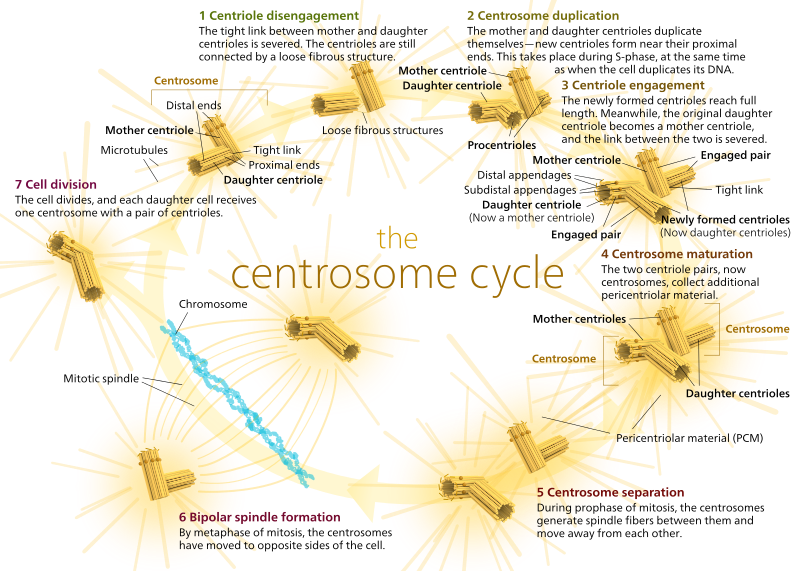
hos dyr har hvilende celler og endda celler i interfase normalt kun en MTOC, kaldet et centrosom, der fungerer som det centrale knudepunkt for alle mikrotubuli i cellen. Et centrosom består af to centrioler som vist nedenfor (tak igen til Kelvinsong):

de to centrioler frigøres fra hinanden og replikerer sig selv under S-fase og adskilles derefter for at danne modsatte ‘poler’ af cellen under M-fase, så der nu er to Mtoc ‘ er, som hver til sidst vil være den eneste MTOC for en ny celle (et andet boss Kelvinsong-billede):
under mitose har du de to ‘poler’ i cellen, hver med mikrotubuli forankret i (-) enden og med deres (+) ender overlappende og peger ind i midten af cellen, som vist her:
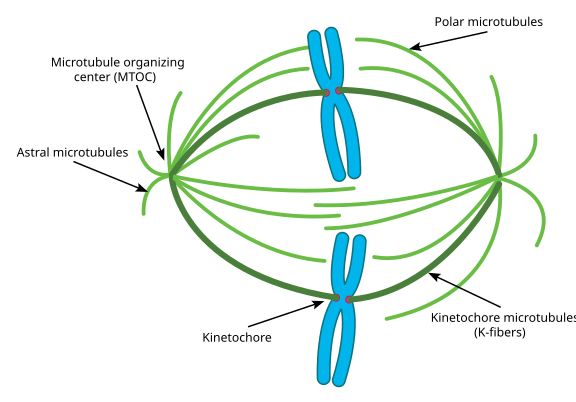
det hele kaldes et spindelapparat, og det område, hvor de to MTOCs’ mikrotubuli overlapper hinanden, kaldes interdigitationsområdet.’Du vil undertiden høre hver MTOC og dens urchin-lignende vifte af mikrotubuli kaldet en ‘mitotisk aster.’
mikrotubuli i dette trin siges at falde i tre kategorier:
- astrale mikrotubuli peger udad mod cellebarken for at forankre hele spindelapparatet langs celledelingsaksen.
- Kinetochore mikrotubuli fastgøres til kinetochore af kromatider.
- polære mikrotubuli, orienteret parallelt med hinanden, men i modsatte retninger, er afgørende for at skubbe spindelapparatet fra hinanden under mitose. (Faktisk er polære mikrotubuli også til stede tidligere og hjælper med at skubbe centrosomerne fra hinanden under profase).
Hvis du foretrækker fotos frem for diagrammer, her er hvordan hele spindelapparatet ser ud med kromatider i blåt, mikrotubuli i grønt og kinetochores som røde prikker:

mikrotubuli bliver meget mere dynamiske under mitose: mere gamma-tubulin fremmer lettere nucleation, men HSMAP215, en mikrotubuli stabilisator, phosphoryleres og således inaktiveres under mitose, hvilket efterlader Kinesin-13 fri til at katastrofisere mikrotubuli. Formuer er lavet og tabt hurtigt. Halveringstiden for en mikrotubuli under mitose er cirka 15 minutter sammenlignet med 30 minutter under interfase. Folk studerer mikrotubuli-dynamikken ved hjælp af frap: Tilføj en fluorescerende mikrotubuli, bleg det og se, hvor hurtigt genmontering sker, baseret på hvor hurtigt fluorescens vises igen. + Tips spiller også en vigtig rolle i at hjælpe og samle mikrotubuli.
Kinesin-5 is har to polære hoveder, der binder til modstående mikrotubuli og forsøger at gå mod (+) enden af hver. Dette skubber de to mikrotubuli fra hinanden og giver drivkraften til adskillelse af Mtoc ‘ erne.Centromerisk DNA har lav information entropi og specielle histoner, der adskiller sig fra andet kromatin. Centromerer er en del af genomet, du næsten aldrig henter i næste generations sekventering, selv på virkelig høj dybde. Det skyldes, at centromerer tjener et andet formål end meget af resten af genomet: sekvensen der er gunstig for interaktion med centromere proteiner og kinetochore vedhæftning. Cohesiner er proteiner, der holder de to søsterkromatider sammen. Vi henviser til kinetochore proteiner som at have to lag, den indre kinetochore og den ydre kinetochore.
under prometaphase bevæger kromosomerne sig frem og tilbage. Kinesiner forankrer kromosomerne til kinetochore-mikrotubuli ud over spidsen, hvor Kinesin-13 depolymeriserer mikrotubuli, hjulpet af mangel på tilgængelige tubulindimerer. En kombination af motoriske proteiner, mikrotubuli-interagerende proteiner og treadmilling tjener til at bevæge kromosomerne. I mellemtiden arbejder dynein og dynactin – motoriske proteiner, der går mod (-) slutarbejdet på de astrale mikrotubuli og trækker Mtoc ‘ erne mod celleperiferien. I metafase kommer kromatiderne til at blive justeret langs ‘metafasepladen’.
under denne proces opløses den nukleare kuvert, og derfor bliver nuklear import irrelevant. Ran-GEF lokaliserer nær kromosomer og genererer høje koncentrationer af Ran-GTP, som giver energi til nogle nødvendige processer (?).
celler har en eller anden mekanisme til at detektere spændingen i mikrotubuli, der angiver deres vedhæftningskromatider, før mitose kan fortsætte. At sikre, at hvert kromatid er korrekt forankret, er afgørende for at undgå aneuploidi.
forresten spiller andre cytoskeletale elementer udover mikrotubuli også en nøglerolle i cellecyklussen. Ved cytokinesis danner actin en kontraktil ring, og ved hjælp af myosin II-motorproteiner cinches cellen i to.
betydningen af modelorganismer
opdagelsen af reguleringsprocesser for cellecyklus var stærkt afhængig af nogle pæne træk ved populære modelorganismer.Saccharomyces cerevisiae (spirende gær) og pombe (fissionsgær) kan eksistere som haploider eller diploider. Det er vigtigt, fordi i den haploide fase kan en mutation slå et gen ud – du behøver ikke at ramme begge alleler. Og i gær er mange mutationer, især i Cdc__ (celledelingskontrol) gener, temperaturafhængige, hvor et protein med en missense-mutation stadig kan fungere korrekt ved ‘permissive’ temperaturer, men mister sin oprindelige funktion ved ‘ikke-permissive’ temperaturer. Dette gør det muligt at studere knockout-fænotypen (ved den ikke-permissive temperatur), mens den stadig har bekvemmeligheden ved at være i stand til let at formere organismerne (ved den permissive temperatur). Hele S. cerevisiae-genomet er tilgængeligt som plasmidbiblioteker, hvilket gør det muligt at screene, for hvilket plasmid redder fænotypen af en given mutant. Det er, hvor mange af de gener, der regulerer cellecyklussen, blev opdaget.
I S. cerivisiae, spirende er en del af fase G1, og når dattercellen når en bestemt størrelse, i et øjeblik kaldet “START”, de to er forpligtet til at indtaste S og i sidste ende fuldføre cellecyklussen. Pattedyrceller har deres eget forpligtelsespunkt kaldet begrænsningspunktet eller R, I G1, hvilket er analogt med START.
temperaturfølsomme Cdc28-mutanter knopper ikke ved den ikke-tilladte temperatur. Cdc28-genet koder for gærens homolog af vores cyclinafhængige kinase (CDK), som, når og kun når de er komplekseret med cyclin, kan phosphorylere andre proteiner for at regulere deres deltagelse i cellecyklusfaser. Temperaturfølsomme mutanter ved den ikke-tilladte temperatur sidder fast i stand til at knoppe og gå ind i S-fasen. I stedet opfører de sig som vildtype celler berøvet næringsstoffer: de vokser store nok til at passere starten, men så fortsætter de ikke.en slags frø viste sig at være kritisk for forståelsen af cellecyklussen, fordi dens reproduktion involverer et meget stort antal celler (dvs. nok udgangsmateriale til vestlige blots osv.), der er perfekt synkroniseret (dvs. alle er i samme fase af cellecyklus på samme tidspunkt. (Sammenlign med gær, for eksempel, hvor celler ikke alle vil være i samme fase på samme tid). Også selve ægget er stort og nemt at arbejde med, og flere cellecyklusser følger befrugtning. I frøer, æg begynder meiotisk opdeling, men arresteres derefter i G2-fasen i 8 måneder, mens de vokser i størrelse og lagrer ting, der er nødvendige for vækst ved befrugtning.
mellemliggende filamenter
ud over mikrofilamenter og mikrotubuli har eukaryote celler også en række ‘andre’ cytoskeletale proteiner kaldet mellemliggende filamenter (IFS). Selvom de er mere forskellige end mikrofilamenter og mikrotubuli, er IF ‘er ikke kun en fangstbetegnelse for’ ethvert andet filament ‘ -snarere er de en gruppe beslægtede proteiner. De strækker sig generelt gennem cytoplasmaet og den indre nukleare kuvert, er ikke-polære og har ingen motoriske proteiner forbundet med dem. De har stor trækstyrke og er meget stabile med en langsom valutakurs og ikke meget sammenbrud, selvom phosphorylering kan fremme deres adskillelse. Her er nogle populære eksempler:
- keratiner findes i epitelceller, mesodermceller og neuroner. De giver styrke og kommer i sure og basiske former. Hver kan danne sin egen streng, men de fleste IFs består af to tråde – en grundlæggende og en sur, slags snoet omkring hinanden. Hår og negle er lavet af’ hård ‘ keratin rig på cystein til disulfidbindinger, som giver den enorme styrke. Permanenter og glatning er afhængige af at reducere disulfidbindingerne, omforme håret og derefter reformere disulfidbindingerne. Du har også ‘blød’ keratin i din hud.
- Desmins såsom vimentin findes i mesenkymale celler (knogle, cartiledge og fedt).
- Neurofilamenter er i neuronale aksoner og regulerer diameteren deraf, hvilket igen bestemmer hastigheden af aktionspotentialets udbredelse.
- laminer er begge de mest udbredte og menes at være mest ligner den fylogenetiske forfader til alle de andre IFs. De yder strukturel støtte til kernemembranen. De kan hjælpe plads ud de nukleare porekomplekser og også organisere DNA.
endelig en sammenfattende video: