Entalpi og kemiske reaktioner
7.3 Entalpi og kemiske reaktioner
læringsmål
- Definer entalpi.
- udtrykker korrekt entalpiændringen af kemiske reaktioner.
- Forklar, hvordan entalpiændringer måles eksperimentelt.
nu hvor vi har vist, hvordan energi, arbejde og varme er relateret, er vi klar til at overveje energiændringer i kemiske reaktioner. Et grundlæggende koncept er, at enhver kemisk reaktion sker med en samtidig ændring i energi. Nu skal vi lære at udtrykke disse energiændringer korrekt.
vores undersøgelse af gasser i kapitel 6 ” gasser “og vores definition af arbejde i afsnit 7.2″ arbejde og varme ” indikerer, at forhold som tryk, volumen og temperatur påvirker et systems energiindhold. Det, vi har brug for, er en definition af energi, der holder, når nogle af disse betingelser er specificeret (noget svarende til vores definition af standardtemperatur og tryk i vores undersøgelse af gasser). Vi definerer entalpiændringenvarmen af en proces ved konstant tryk; betegnet lush. Som varmen i en proces, når trykket holdes konstant:bogstavet H står for “entalpi”, en slags energi, mens det indebærer en ændring i mængden. Vi vil altid være interesseret i ændringen i H, snarere end den absolutte værdi af H selv.
når en kemisk reaktion opstår, er der en karakteristisk ændring i entalpi. Entalpiændringen for en reaktion skrives typisk efter en afbalanceret kemisk ligning og på samme linje. For eksempel, når to mol brint reagerer med en mol ilt for at fremstille to mol vand, er den karakteristiske entalpiændring 570 kj. Vi skriver ligningen som
2H2 (g) + O2(g) luth 2H2O(liter) TURH = -570 kJ
en kemisk ligning, der inkluderer en entalpiændring kaldes en termokemisk ligningen kemisk ligning, der inkluderer en entalpiændring.. En termokemisk ligning antages at henvise til ligningen i molære mængder, hvilket betyder, at den skal fortolkes i form af mol, ikke individuelle molekyler.
eksempel 5
skriv den termokemiske ligning for reaktionen af PCl3(g) med Cl2(g) for at fremstille PCl5(g), som har en entalpiændring på -88 kj.
opløsning
den termokemiske ligning er
PCl3 ( g) + Cl2(g) liter PCl5(g) liter = -88 kj
Test dig selv
skriv den termokemiske ligning for reaktionen af N2(g) med O2(g) for at lave 2NO(g), som har en entalpiændring på 181 kJ.
svar
N2(g) + O2(g) list 2NO(g) list = 181 kJ
du har måske bemærket, at luren for en kemisk reaktion kan være positiv eller negativ. Tallet antages at være positivt, hvis det ikke har noget tegn; et + tegn kan tilføjes eksplicit for at undgå forvirring. En kemisk reaktion, der har en positiv LARGH, siges at være endotermikemisk reaktion, der har en positiv ændring i entalpi., mens en kemisk reaktion, der har en negativ LARGH, siges at være eksotermen kemisk reaktion, der har en negativ ændring i entalpi..
hvad betyder det, hvis en proces er positiv? Det betyder, at det system, hvor den kemiske reaktion forekommer, får energi. Hvis man betragter et systems energi som repræsenteret som en højde på et lodret energiplot, kan entalpiændringen, der ledsager reaktionen, diagrammes som i del (A) i figur 7.3 “Reaktionsenergi”: reaktanternes energi har en vis energi, og systemet øger sin energi, når det går til produkter. Produkterne er højere i lodret skala end reaktanterne. Endotermisk indebærer derefter, at systemet vinder eller absorberer energi.
Der findes en modsat situation for en eksoterm proces, som vist i del (b) i figur 7.3 “Reaktionsenergi”. Hvis entalpiændringen af en reaktion er negativ, mister systemet energi, så produkterne har mindre energi end reaktanterne, og produkterne er lavere på den lodrette energiskala end reaktanterne er. Eksoterm indebærer derfor, at systemet mister eller afgiver energi.
figur 7.3 Reaktionsenergi
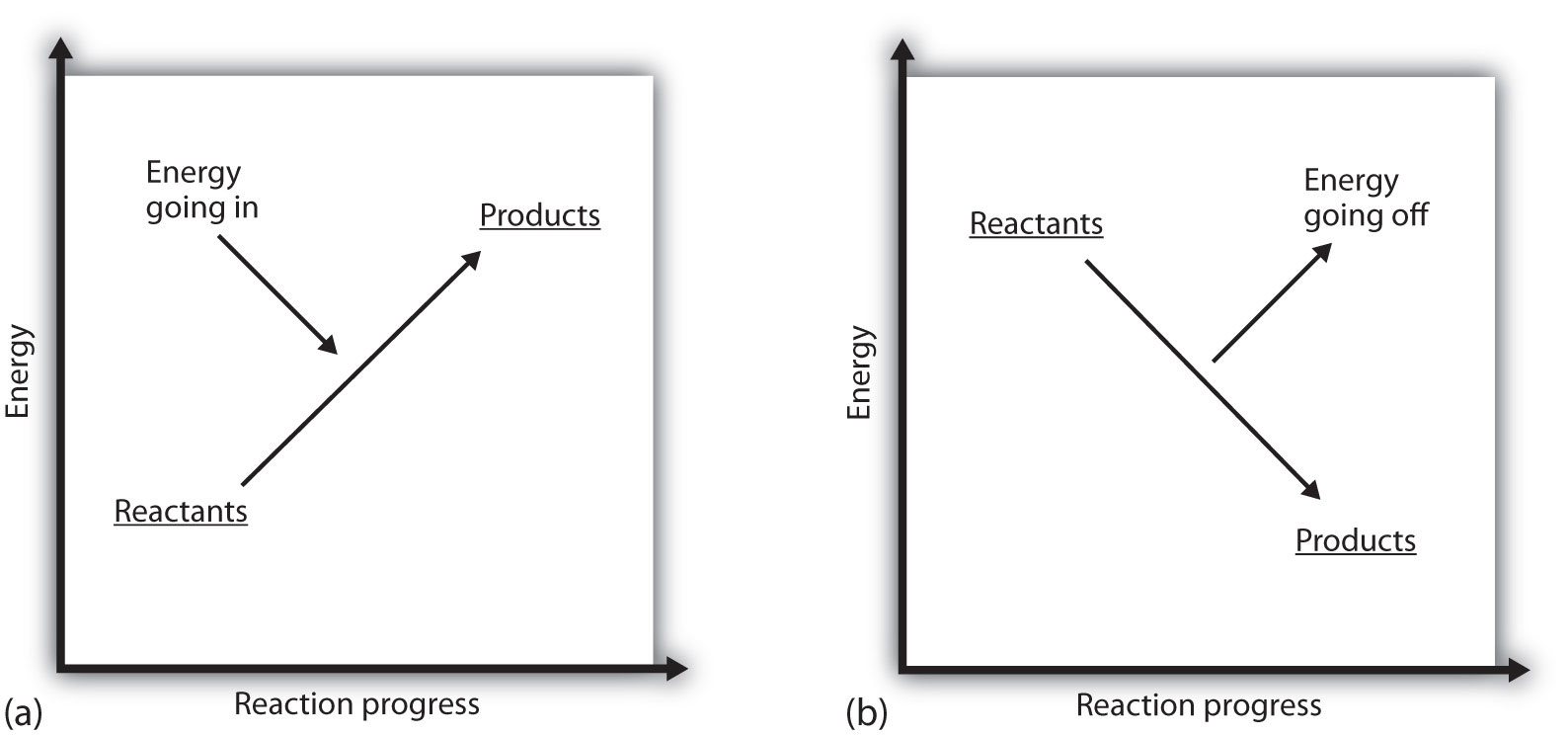
(a) i en endoterm reaktion øges systemets energi (dvs.bevæger sig højere på den lodrette skala af energi). (b) i en eksoterm reaktion falder systemets energi (dvs.bevæger sig lavere på den lodrette skala af energi).
eksempel 6
overvej denne termokemiske ligning.
2CO (g) + O2(g) liter 2CO2(g) liter = -565 kJ
er det eksoterm eller endoterm? Hvor meget energi afgives eller absorberes?
opløsning
per definition er en kemisk reaktion, der har en negativ LERTH, eksoterm, hvilket betyder, at denne meget energi—i dette tilfælde 565 kJ—afgives af reaktionen.
Test dig selv
overvej denne termokemiske ligning.
CO2 (g) + H2(g) liter CO(g) + H2O(g) liter = 42 kJ
er det eksoterm eller endoterm? Hvor meget energi afgives eller absorberes?
svar
endoterm; 42 kJ absorberes.
hvordan måles lush-værdier eksperimentelt? Faktisk måles ikke, Og K måles. Men målingerne udføres under betingelser med konstant tryk, så LH er lig med det målte antal.
eksperimentelt måles k ved at drage fordel af ligningen
k = mc chart
vi forudmåler massen af kemikalierne i et system. Derefter lader vi den kemiske reaktion forekomme og måler temperaturændringen (Krust) i systemet. Hvis vi kender den specifikke varme af materialerne i systemet (typisk gør vi), kan vi beregne spørgsmål. Beholderen, hvor systemet befinder sig, er typisk isoleret, så enhver energiændring går i at ændre systemets temperatur snarere end at blive lækket fra systemet. Beholderen betegnes som et kalorimeteren beholder, der anvendes til at måle varmen af en kemisk reaktion., og processen med måling af ændringer i entalpi kaldes kalorimetriprocessen med måling af entalpiændringer for kemiske reaktioner..
figur 7.4 kalorimetre
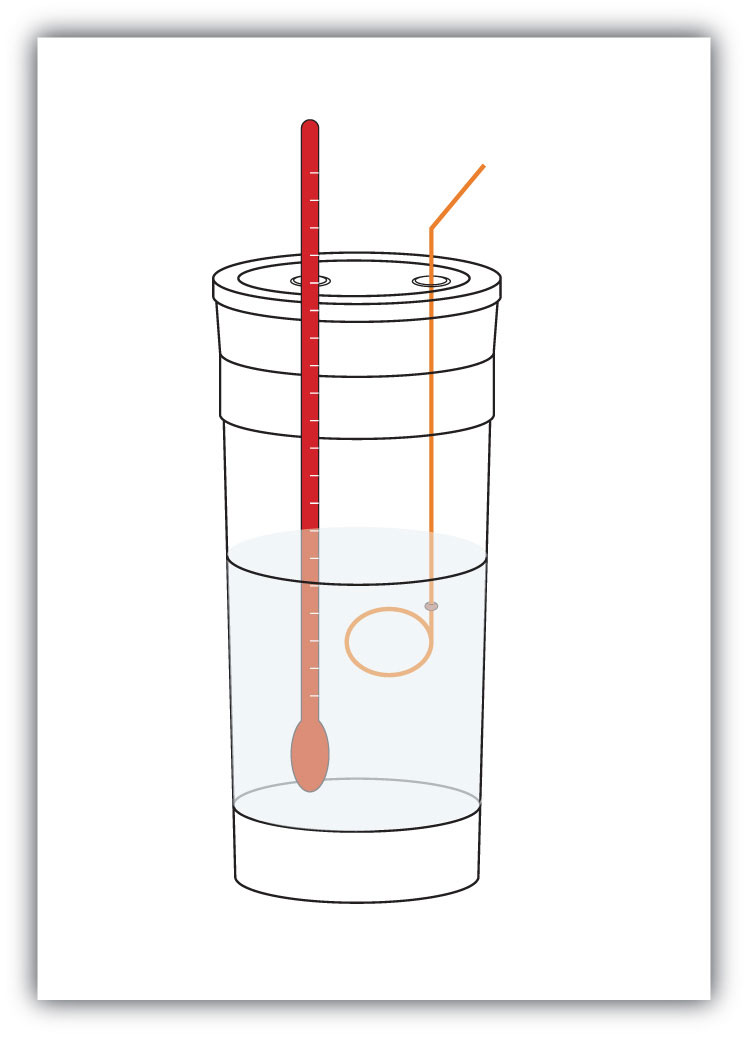
en simpel kalorimeter kan konstrueres fra nogle indlejrede skum kaffekopper, et dæksel, et termometer og en omrører.Antag for eksempel, at 4,0 g NaOH eller 0,10 mol NaOH opløses for at fremstille 100,0 mL vandig opløsning, mens 3,65 g HCl eller 0,10 mol HCl opløses for at fremstille yderligere 100,0 mL vandig opløsning. De to opløsninger blandes i et isoleret kalorimeter, et termometer indsættes, og kalorimeteret er dækket (se figur 7.4 “kalorimetre” for et eksempel setup). Termometeret måler temperaturændringen, når følgende kemiske reaktion opstår:
NaOH (AK) + HCI(AK) kr NaCl(AK) + H2O(kr)
en observatør bemærker, at temperaturen stiger fra 22,4 kr C til 29,1 kr C. forudsat at opløsningernes varmekapacitet og densiteter er de samme som for rent vand, har vi nu de oplysninger, vi har brug for til at bestemme entalpiændringen af den kemiske reaktion. Den samlede mængde opløsning er 200,0 mL, og med en densitet på 1,00 g/mL har vi således 200,0 g opløsning. Ved hjælp af ligningen for K erstatter vi vores eksperimentelle målinger og den specifikke varme af vand (tabel 7.1 “specifikke varmer af forskellige stoffer”):
k=(200,0 g)(4,184 J G K)(6,7 k)
løsning for K, Vi får
k=5.600 J K for reaktionen
varmen K er lig med K for reaktionen, fordi den kemiske reaktion forekommer ved konstant tryk. Imidlertid, reaktionen afgiver denne mængde energi, så det faktiske tegn på LARSH er negativt:
LARTH = -5.600 J for reaktionen
således har vi følgende termokemiske ligning for den kemiske reaktion, der opstod i kalorimeteret:
110 NaOH(AK)+110 HCl(AK) lot 110 NaCl(AK)+110 H2O(Lot)Lot=-5.600 J
1/10 koefficienterne er til stede for at minde os om, at vi startede med en tiendedel af en mol af hver reaktant, så vi laver en en tiendedel af en mol af hvert produkt. Typisk rapporterer vi imidlertid termokemiske ligninger i form af mol, ikke en tiendedel af en mol. For at skalere op til molære mængder skal vi multiplicere koefficienterne med 10. Men når vi gør dette, får vi 10 gange så meget energi. Således har vi
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(g ar) ΔH = -56,000 J
ΔH kan omregnes til kJ enheder, så vores endelige termokemiske ligning
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(g ar) ΔH = -56 kJ
Vi har lige taget vores eksperimentelle data fra kalorimetri og bestemt enthalpi ændring af en kemisk reaktion. Lignende målinger på andre kemiske reaktioner kan bestemme LERTH-værdierne for enhver kemisk reaktion, du vil studere.
eksempel 7
en 100 mL opløsning af 0.25 mol Ca2+(AKV) blev blandet med 0,50 mol f−(AKV) ioner, og CaF2 blev udfældet:
Ca2+(AKV) + 2F−(AKV) liter CaF2(s)
opløsningens temperatur steg med 10,5 liter C. Hvad var entalpiændringen for den kemiske reaktion? Hvad var entalpiændringen for produktionen af 1 mol CaF2? Antag, at opløsningen har samme tæthed og specifik varme som vand.
opløsning
fordi vi får kvit direkte, kan vi bestemme reaktionsvarmen, som er lig med kvit: k=(100 g)(4,184 j g kvit C)(10.5 liter C)
løsning for K, Vi får
K = 4.400 J
derfor, LH = -4.400 J.
i henhold til støkiometrien af reaktionen dannes nøjagtigt 0,25 mol CaF2, så denne mængde varme er for 0,25 mol. For 1 mol CaF2 er vi nødt til at opskalere varmen med en faktor på fire:
K = 4.400 J liter 4 = 17.600 J for 1 mol CaF2
på molær basis er ændringen i entalpi
liter = -17.600 J = -17,6 kJ
Test dig selv
i et kalorimeter ved konstant tryk, 0,10 mol CH4(g) og 0,20 mol af O2(g) reageres.
CH4 (g) + 2O2(g) liter CO2(g) + 2H2O(liter)
reaktionen varmer 750.0 g H2O med 28,4 liter C. Hvad er liter for reaktionen på en molær skala?
svar
-891 kJ
nøgle grillbarer
- hver kemisk reaktion forekommer med en samtidig ændring i energi.
- ændringen i entalpi er lig med varme ved konstant tryk.
- Entalpiændringer kan udtrykkes ved hjælp af termokemiske ligninger.
- Entalpiændringer måles ved hjælp af kalorimetri.
øvelser
-
under hvilke omstændigheder er det samme?
-
Under hvilke omstændigheder er k og LR forskellige?
-
hydrogengas og klorgas reagerer for at fremstille hydrogenchloridgas med en ledsagende entalpiændring på -184 kj. Skriv en korrekt afbalanceret termokemisk ligning til denne proces.
-
propan (C3H8) reagerer med elementær iltgas for at producere kulsyre og flydende vand med en ledsagende entalpiændring på -2.220 kj. Skriv en korrekt afbalanceret termokemisk ligning til denne proces.
-
nitrogengas reagerer med iltgas for at gøre Nej(g), mens den absorberer 180 kJ. Skriv en korrekt afbalanceret termokemisk ligning til denne proces.
-
fast natrium reagerer med klorgas for at fremstille fast natriumchlorid, mens det afgiver 772 kj. Skriv en korrekt afbalanceret termokemisk ligning til denne proces.
-
hydrogengas og klorgas reagerer for at fremstille hydrogenchloridgas med en ledsagende entalpiændring på -184 kj. Er denne proces endoterm eller eksoterm?
-
propan (C3H8) reagerer med elementær iltgas for at producere kulsyre, mens den afgiver 2.220 kJ energi. Er denne proces endoterm eller eksoterm?
-
nitrogengas reagerer med iltgas for at gøre Nej(g), mens den absorberer 180 kJ. Er denne proces eksoterm eller endoterm?
-
natriummetal kan reagere med nitrogen for at gøre natriumatsid (NaN3) med en liter på 21,72 kJ. Er denne proces eksoterm eller endoterm?
-
Tegn et energiniveaudiagram for den kemiske reaktion i øvelse 8. (Se figur 7.3 “Reaktionsenergi” for et eksempel.)
-
Tegn et energiniveaudiagram for den kemiske reaktion i øvelse 9. (Se figur 7.3 “Reaktionsenergi” for et eksempel.)
-
i en 250 mL opløsning kombineres 0,25 mol KOH(AK) og 0,25 mol HNO3(AK). Opløsningens temperatur stiger fra 22,5 liter C til 35,9 liter C. Antag, at opløsningen har samme densitet og varmekapacitet af vand. Hvad er reaktionens varme, og hvad er reaktionens reaktion på molær basis?
-
i en 600 mL opløsning, 0.50 mol Ca(OH)2(Ak) og 0,50 mol H2SO4(AK) kombineres. Opløsningens temperatur stiger med 22,3 liter C. Hvad er reaktionens varme, og hvad er reaktionens reaktion på molær basis? Antag, at opløsningen har samme tæthed og varmekapacitet af vand.
-
til opvarmning af 400,0 g H2O, 0,050 mol ethanol (C2H5OH) brændes. Vandet opvarmes fra 24,6 liter C til 65,6 liter C. Hvad er reaktionens varme, og hvad er reaktionens reaktion på molær basis?
-
for at varme 100,0 g H2O brændes 0,066 mol bivoks. Vandet opvarmes fra 21,4 liter C til 25,5 liter C. Hvad er reaktionens varme, og hvad er reaktionen på molær basis?
Svar
-
under konstant pres
-
2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exoterm
-
endoterm
-
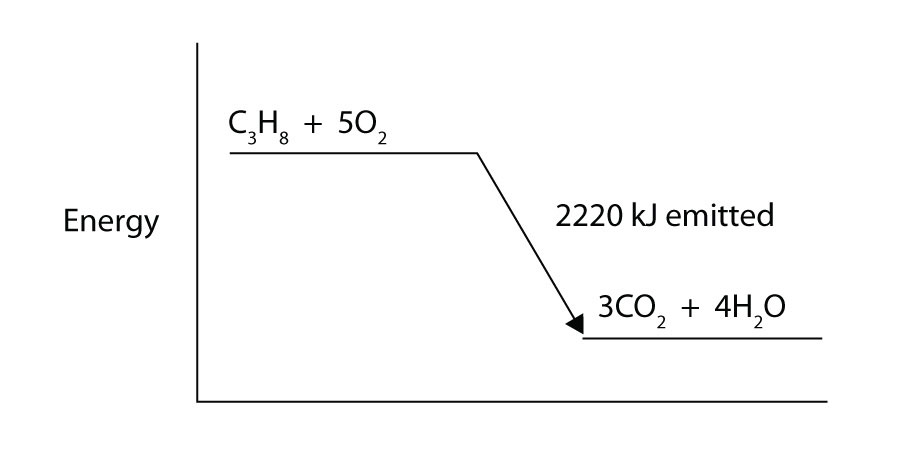
-
heat reaktion = -14.0 kJ; LARTH = -56,0 kJ / mol reaktanter
-
reaktionsvarme = -68,6 kJ; Larh = -1.370 kJ / mol ethanol