Introduktionskemi-1.canadiske udgave
læringsmål
- Definer væskens damptryk.
- Forklar oprindelsen af både overfladespænding og kapillærvirkning.
Der er nogle egenskaber, som alle væsker har. Den væske, som vi er mest bekendt med, er sandsynligvis vand, og det har disse egenskaber. Andre væsker har dem også, hvilket er noget at huske på.
alle væsker har en vis del af deres partikler, der har tilstrækkelig energi til at komme ind i gasfasen, og hvis disse partikler er på væskens overflade, gør de det (figur 10.6 “fordampning”). Dannelsen af en gas fra en væske ved temperaturer under kogepunktet kaldes fordampning. Ved disse temperaturer kaldes materialet i gasfasen damp snarere end gas; udtrykket gas er forbeholdt, når gasfasen er den stabile fase.
Figur 10.6 fordampning

nogle partikler af en væske har nok energi til at undslippe væskefasen til at blive en damp.
Hvis det tilgængelige volumen er stort nok, vil al væske til sidst blive damp. Men hvis det tilgængelige volumen ikke er nok, vil nogle af damppartiklerne til sidst genindtræde i væskefasen (figur 10.7 “ligevægt”). På et tidspunkt vil antallet af partikler, der kommer ind i dampfasen, svare til antallet af partikler, der forlader dampfasen, så der er ingen nettoændring i mængden af damp i systemet. Vi siger, at systemet er i ligevægt. Dampens partielle tryk ved ligevægt kaldes væskens damptryk.
figur 10.7 ligevægt

på et tidspunkt vil antallet af partikler, der kommer ind i dampfasen, blive afbalanceret med antallet af partikler, der vender tilbage til væsken. Dette punkt kaldes ligevægt.
forstå, at væsken ikke er stoppet med at fordampe. Den omvendte proces-kondensation-forekommer så hurtigt som fordampning er, så der er ingen nettoændring i mængden af damp i systemet. Udtrykket dynamisk ligevægt repræsenterer en situation, hvor en proces stadig forekommer, men den modsatte proces forekommer også i samme hastighed, så der ikke er nogen nettoændring i systemet.
damptrykket for et stof afhænger af stoffets temperatur; når temperaturen stiger, gør damptrykket det også. Figur 10.8 “parceller af damptryk versus temperatur for flere væsker” er et plot af damptryk versus temperatur for flere væsker. Efter at have defineret damptryk kan vi også omdefinere kogepunktet for en væske: den temperatur, hvor damptrykket af en væske svarer til det omgivende miljøtryk. Det normale damptryk er altså den temperatur, hvor damptrykket er 760 torr, eller nøjagtigt 1 atm. Kogepunkter varierer således med det omgivende tryk, en kendsgerning, der kan have store konsekvenser for madlavning ved lavere eller højere end normale højder. Atmosfærisk tryk varierer betydeligt med højden.
figur 10.8 parceller af damptryk versus temperatur for flere væsker
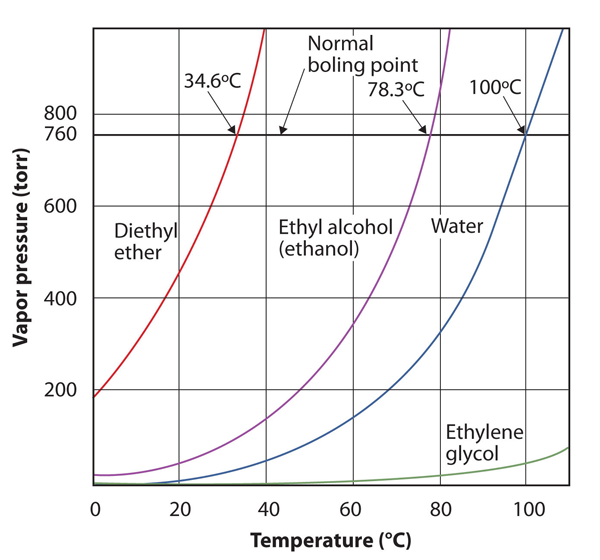
damptrykket af en væske afhænger af væskens identitet og temperaturen, som dette plot viser.
eksempel 4
brug figur 10.8 “plot af damptryk versus temperatur for flere væsker” til at estimere kogepunktet for vand ved 500 torr, hvilket er det omtrentlige atmosfæriske tryk øverst på Mount Everest.
opløsning
se den medfølgende figur. Fem hundrede torr er mellem 400 og 600, så vi udvider en linje fra det punkt på y-aksen over til kurven for vand og derefter slippe den ned til H-aksen for at læse den tilhørende temperatur. Det ser ud til, at punktet på vanddamptrykskurven svarer til en temperatur på omkring 90 liter C, så vi konkluderer, at kogepunktet for vand ved 500 torr er 90 liter C.
figur 10.9 ved hjælp af figur 10.8 “plot af damptryk versus temperatur for flere væsker”for at besvare eksempel 4
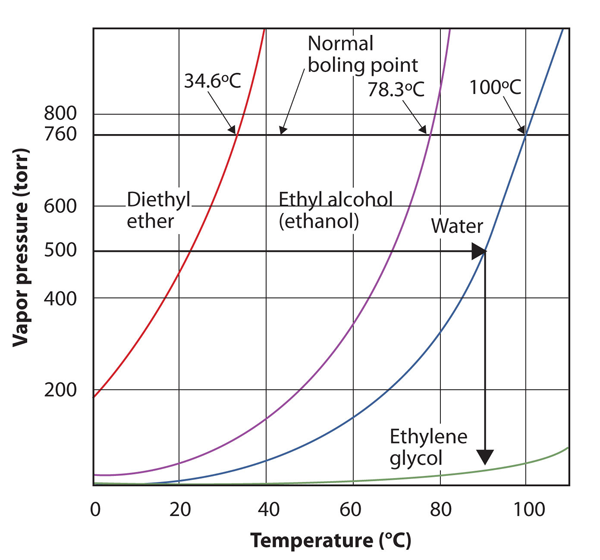
Ved at læse grafen korrekt kan du estimere kogepunktet for en væske ved forskellige temperaturer.
Test dig selv
brug figur 10.8 “plot af damptryk versus temperatur for flere væsker” for at estimere kogepunktet for ethanol ved 400 torr.
svar
om 65 liter C
damptrykskurven for vand er ikke nøjagtigt nul ved smeltepunktet-0 liter C. Selv is har et damptryk; derfor sublimerer det over tid. Imidlertid er damptrykket af faste stoffer typisk meget lavere end for væsker. Ved -1 liter C er isens damptryk 4,2 torr. Ved en frysetemperatur på 0 liter F (-17 liter C) er isens damptryk kun 1,0 torr; såkaldte dybfrysere kan komme ned til -23 liter C, hvor isens damptryk kun er 0,6 torr.
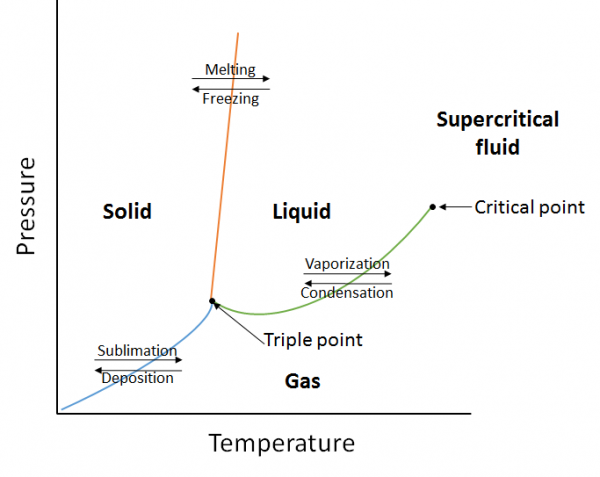
fasediagrammer
et fasediagram er en grafisk repræsentation af de ligevægtsforhold, der findes mellem et stofs faser under specificerede tryk og temperaturer (figur 10.10). Fasediagrammet er en kombination af tre kurver: damptrykskurven, smeltekurven og sublimeringskurven. Vi har tidligere set, at damptrykskurver repræsenterer ligevægten mellem væske-og gasfasen, og det punkt, hvor trykket er lig med 1 atm, er det normale kogepunkt. Et yderligere træk ved denne kurve i fasediagrammet (grønt) er, at det ender på det kritiske punkt. Det kritiske punkt er det punkt ved den højeste temperatur og tryk, hvor væsker og gasser forbliver skelnelige. Ved temperaturer og tryk ud over dette punkt eksisterer sagen i en fase med egenskaber af både væsker og gasser kendt som en superkritisk væske.
smeltekurven (orange) repræsenterer ligevægten mellem fast og flydende, og det punkt, hvor trykket er lig med 1 atm, er det normale smeltepunkt. Sublimeringskurven (blå) repræsenterer den ligevægt, der findes mellem fast stof og gas. Endelig er det punkt, hvor alle tre kurver mødes, kendt som det tredobbelte punkt. På dette tidspunkt findes tre faser (fast, flydende og gas) alle ved ligevægt.
eksempel:
brug følgende fasediagram til at bestemme, hvad der ville ske, hvis:
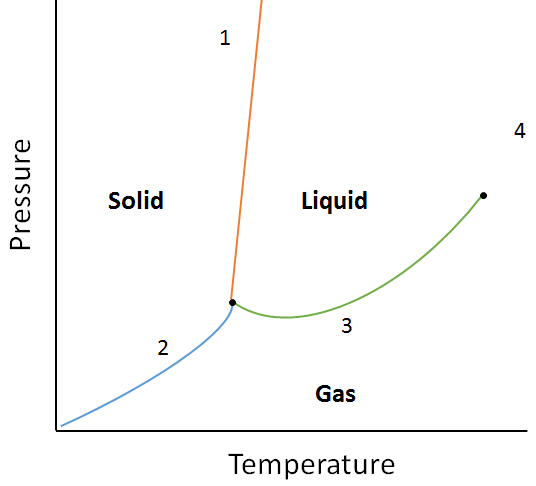
a. temperaturen øges for stof i punkt 1.
b. trykket øges for stof i punkt 3.
opløsning:
A. stof ved punkt 1 smelter (skift fase fra fast til væske), hvis temperaturen øges.
b. Materie på punkt 3 kondenserer (skift fase fra gas til væske), hvis temperaturen øges.
overfladespænding og Kapillærvirkning
alle væsker deler også nogle andre egenskaber. Overfladespænding er en effekt forårsaget af en ubalance af kræfter på atomerne ved overfladen af en væske, som vist i figur 10.11 “overfladespænding”. Den blå partikel i hovedparten af væsken oplever intermolekylære kræfter fra hele vejen rundt, som illustreret af pilene. Den gule partikel på overfladen oplever imidlertid ingen kræfter over den, fordi der ikke er nogen partikler over den. Dette fører til en ubalance af kræfter, som vi kalder overfladespænding.
figur 10.11 overfladespænding

overfladespænding kommer fra det faktum, at partikler på overfladen af en væske ikke oplever interaktioner fra alle retninger, hvilket fører til en ubalance af kræfter på overfladen.
figur 10.12 effekter af overfladespænding

kilde: “våd æble” af cristian ruberti er licenseret under Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic.