Introduktionskemi-1.canadiske udgave
læringsmål
- Definer buffer.
- korrekt identificere de to komponenter i en buffer.
som angivet i afsnit 12.4 “stærke og svage syrer og baser og deres salte” er svage syrer relativt almindelige, selv i de fødevarer, vi spiser. Men vi støder lejlighedsvis på en stærk syre eller base, såsom mavesyre, som har en stærkt sur pH på 1,7. Per definition kan stærke syrer og baser producere en relativt stor mængde H+− eller OH-ioner og har følgelig markante kemiske aktiviteter. Derudover kan meget små mængder stærke syrer og baser ændre pH i en opløsning meget hurtigt. Hvis der blev tilsat 1 mL mavesyre til blodbanen, og der ikke var nogen korrektionsmekanisme, ville blodets pH falde fra omkring 7,4 til omkring 4,7—en pH, der ikke er befordrende for fortsat Levevis. Heldigvis har kroppen en mekanisme til at minimere sådanne dramatiske pH-ændringer.
mekanismen involverer en buffer, en opløsning, der modstår dramatiske ændringer i pH. buffere gør det ved at være sammensat af visse par opløste stoffer: enten en svag syre plus et salt afledt af den svage syre eller en svag base plus et salt af den svage base. For eksempel kan en buffer være sammensat af opløst HC2H3O2 (en svag syre) og NaC2H3O2 (saltet afledt af den svage syre). Et andet eksempel på en buffer er en opløsning indeholdende NH3 (en svag base) og NH4Cl (et salt afledt af den svage base).
lad os bruge en HC2H3O2/NaC2H3O2 buffer til at demonstrere, hvordan buffere fungerer. Hvis en stærk base—en kilde til OH−ioner—tilsættes til bufferopløsningen, vil disse OH− ioner reagere med HC2H3O2 i en syre-base-reaktion:
HC2H3O2(AK) + OH−(AK) kar H2O(kar) + C2H3O2−(AK)
i stedet for at ændre pH dramatisk ved at gøre opløsningen basisk, reagerer de tilsatte OH− ioner for at gøre H2O, så pH ændres ikke meget.
Hvis en stærk syre—en kilde til H+ ioner—tilsættes til bufferopløsningen, reagerer H+ ionerne med anionen fra saltet. Fordi HC2H3O2 er en svag syre, ioniseres den ikke meget. Dette betyder, at hvis masser af H+ ioner og C2H3O2− ioner er til stede i den samme opløsning, vil de komme sammen for at gøre HC2H3O2:
H+(AK) + C2H3O2−(AK) til HC2H3O2(AK)
i stedet for at ændre pH dramatisk og gøre opløsningen sur, reagerer de tilsatte H+ ioner for at gøre molekyler af en svag syre. Figur 12.2″ Buffers handlinger ” illustrerer begge handlinger af en buffer.
figur 12.2 handlingerne af buffere
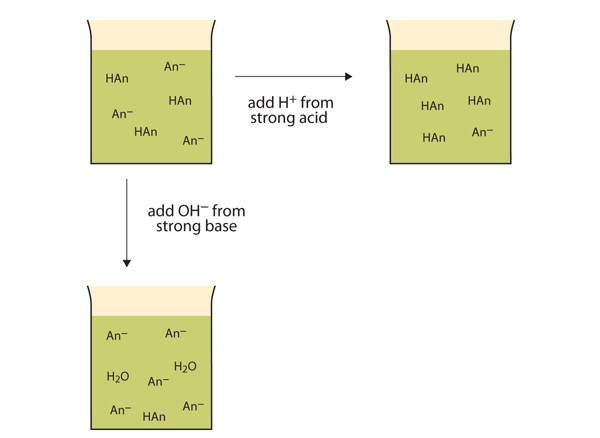
buffere kan reagere med både stærke syrer (top) og stærke baser (side) for at minimere store ændringer i pH.
buffere fremstillet af svage baser og salte af svage baser virker på samme måde. For eksempel i en buffer indeholdende NH3 og NH4Cl, kan NH3 molekyler reagere med eventuelle overskydende H+ ioner indført af stærke syrer:
NH3(AK) + h+(AK) LH4+(AK)
mens NH4+(AK) ion kan reagere med eventuelle OH− ioner indført af stærke baser:
NH4+(AK) + OH−(AK) LH3(AK) + H2O(lart)
eksempel 15
hvilke kombinationer af forbindelser kan lave en bufferopløsning?
- Hcho2 og NaCHO2
- HCl og NaCl
- CH3NH2 og CH3NH3Cl
- NH3 og NaOH
opløsning
- HCHO2 er myresyre, en svag syre, mens NaCHO2 er saltet fremstillet af anionen af den svage syre (formiationen ). Kombinationen af disse to opløste stoffer ville gøre en bufferopløsning.
- HCl er en stærk syre, ikke en svag syre, så kombinationen af disse to opløste stoffer ville ikke skabe en bufferopløsning.
- CH3NH2 er methylamin, som er som NH3 med et af dets H-atomer substitueret med en CH3-gruppe. Fordi det ikke er angivet i tabel 12.2 “stærke syrer og baser”, kan vi antage, at det er en svag base. Forbindelsen CH3NH3Cl er et salt fremstillet af den svage base, så kombinationen af disse to opløste stoffer ville gøre en bufferopløsning.
- NH3 er en svag base, men NaOH er en stærk base. Kombinationen af disse to opløste stoffer ville ikke skabe en bufferopløsning.
Test dig selv
hvilke kombinationer af forbindelser kan lave en bufferopløsning?
- NaHCO3 og NaCl
- H3PO4 og NaH2PO4
- NH3 og (NH4)3PO4
- NaOH og NaCl
svar
- Nej
- ja
- ja
- Nej
- Nej
- Nej
- Nej
- Nej
buffere fungerer kun godt for begrænsede mængder tilsat stærk syre eller base. Når enten opløst stof er fuldstændigt reageret, er opløsningen ikke længere en buffer, og hurtige ændringer i pH kan forekomme. Vi siger, at en buffer har en vis kapacitet. Buffere, der har mere opløst stof opløst i dem til at begynde med, har større kapacitet, som man kunne forvente.
humant blod har et buffersystem for at minimere ekstreme ændringer i pH. en buffer i blod er baseret på tilstedeværelsen af HCO3− og H2CO3 . Med denne buffer til stede, selvom noget mavesyre skulle finde vej direkte ind i blodbanen, ville ændringen i blodets pH være minimal. Inde i mange af kroppens celler er der et buffersystem baseret på fosfationer.
mad og drikke App: Syren, der letter smerter
selvom medicin ikke ligefrem er” mad og drikke”, indtager vi dem, så lad os se på en syre, der sandsynligvis er den mest almindelige medicin: acetylsalicylsyre, også kendt som aspirin. Aspirin er kendt som en smertestillende og antipyretisk (feber reducer).
strukturen af aspirin er vist i den ledsagende figur. Syredelen er cirklet; det er h-atomet i den del, der kan doneres, da aspirin fungerer som en br-Lavtsyre. Fordi det ikke er angivet i tabel 12.2 “stærke syrer og baser”, er acetylsalicylsyre en svag syre. Det er dog stadig en syre, og i betragtning af at nogle mennesker bruger relativt store mængder aspirin dagligt, kan dets sure natur forårsage problemer i maveforingen på trods af mavens forsvar mod sin egen mavesyre.
figur 12.3 den molekylære struktur af Aspirin
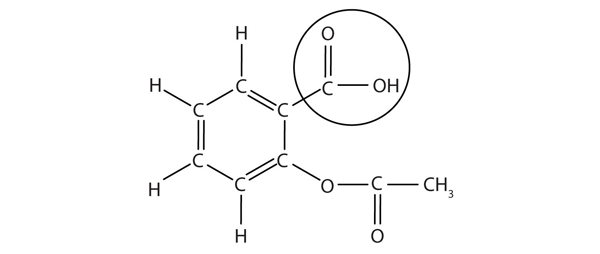
de cirklede atomer er syredelen af molekylet.
da syreegenskaberne af aspirin kan være problematiske, tilbyder mange aspirinmærker en “bufret aspirin” – form af medicinen. I disse tilfælde indeholder aspirinet også et buffermiddel—normalt MgO—der regulerer surhedsgraden af aspirinet for at minimere dets sure bivirkninger.
så nyttigt og almindeligt som aspirin er, blev det formelt markedsført som et lægemiddel startende i 1899. US Food and Drug Administration (FDA), det statslige agentur, der har til opgave at føre tilsyn med og godkende stoffer i USA, blev først dannet i 1906. Nogle har hævdet, at hvis FDA var blevet dannet før aspirin blev introduceret, kan aspirin aldrig have fået godkendelse på grund af dets potentiale for bivirkninger—gastrointestinal blødning, ringe i ørerne, Reyes syndrom (et leverproblem) og nogle allergiske reaktioner. Men for nylig er aspirin blevet udråbt for dets virkninger ved at mindske hjerteanfald og slagtilfælde, så det er sandsynligt, at aspirin er her for at blive.
nøgle grillbarer
- en buffer er en løsning, der modstår pludselige ændringer i pH.
øvelser
-
Definer buffer. Hvilke to relaterede kemiske komponenter kræves for at lave en buffer?
-
kan en buffer fremstilles ved at kombinere en stærk syre med en stærk base? Hvorfor eller hvorfor ikke?
-
hvilke kombinationer af forbindelser kan lave en buffer? Antag vandige opløsninger.
a) HCl og NaCl
b) HNO2 og NaNO2
c) NH4NO3 og HNO3
d) NH4NO3 og NH3
4. Hvilke kombinationer af forbindelser kan lave en buffer? Antag vandige opløsninger.
a) H3PO4 og Na3PO4
b) NaHCO3 og Na2CO3
c)NaNO3 og Ca(NO3) 2
d) HN3 og NH3
5. For hver kombination i Øvelse 3, der er en buffer, skal du skrive de kemiske ligninger for reaktionerne fra bufferkomponenterne, når der tilsættes en stærk syre og en stærk base.
6. For hver kombination i Øvelse 4, der er en buffer, skal du skrive de kemiske ligninger for reaktionerne fra bufferkomponenterne, når der tilsættes en stærk syre og en stærk base.
7. Det komplette fosfatbuffersystem er baseret på fire stoffer: H3PO4, H2PO4 -, HPO42−og PO43 -. Hvilke forskellige bufferopløsninger kan der laves af disse stoffer?
8. Forklar hvorfor NaBr ikke kan være en komponent i enten en sur eller en basisk buffer.
9. Der fremstilles to opløsninger, der indeholder de samme koncentrationer af opløste stoffer. Den ene løsning består af H3PO4 og Na3PO4, mens den anden er sammensat af HCN og NaCN. Hvilken løsning skal have den større kapacitet som buffer?
10. Der fremstilles to opløsninger, der indeholder de samme koncentrationer af opløste stoffer. Den ene løsning består af NH3 og NH4NO3, mens den anden består af H2SO4 og Na2SO4. Hvilken løsning skal have den større kapacitet som buffer?
svar
en buffer er kombinationen af en svag syre eller base og et salt af den svage syre eller base.
a) Nej
b) ja
c) Nej
d) Ja
3b: stærk syre: NO2− + H+ liter HNO2; stærk base: HNO2 + OH− liter NO2− + H2O; 3D: stærk base: NH4+ + OH− liter NH3 + H2O; stærk syre: NH3 + h+ liter NH4+7.
buffere kan laves af tre kombinationer: (1) H3PO4 og H2PO4−, (2) H2PO4− og HPO42−, og (3) HPO42− og PO43−. (Teknisk set kan en buffer fremstilles af to komponenter.)
fosfatbufferen skal have den større kapacitet.