se på de seneste artikler
abstrakt
lavt output hjertesvigt (LoHF) er en usædvanlig form for hjertesvigt (HF), men en der signalerer meget avanceret HF. Det er forbundet med ildevarslende prognose såvel som betydelig sygelighed og dødelighed. Imidlertid, LoHF forbliver stort set underundersøgt. Den traditionelle beskrivelse af HF fokuserede på kongestiv hjertesvigt (CHF) præget af lav hjerteproduktion og ledsaget af lunge/perifer overbelastning. Dette fokus bidrog til undervurdering af LoHF-patienter, der har ringe eller ingen tegn på overbelastning. Desuden har LoHF-patienter ingen dokumenteret behandling, og valget af passende behandling afhænger af individuel patofysiologi og underliggende ætiologi. LoHF-patienter har heterogen ætiologi og patofysiologi, der fremhæver vigtigheden af en dybdegående forståelse af dens kliniske træk, diagnose og klinisk styring, som danner grundlaget for denne gennemgang.
nøgleord
lavt output hjertesyndrom, lavt output hjertesvigt, lav output tilstand
introduktion
på trods af bemærkelsesværdige fremskridt inden for medicinske og kirurgiske terapier udgør effektiv styring af hjertesvigt (HF) fortsat betydelige udfordringer for sundhedsudbydere. Udfordringen afspejles af høje Hf-relaterede hospitalsindlæggelser sammen med øget dødelighed og sygelighed . En del af udfordringen er meget heterogen ætiologi, patofysiologi og kliniske præsentationer af forskellige former for HF, hvor nogle HF-former har en mangel på kliniske forsøgsdata og følgelig en begrænset forståelse. Især har den traditionelle beskrivelse af HF været næsten synonymt med kongestiv hjertesvigt (CHF), men udtrykket CHF udelukker et mindretal af HF-patienter, der har ringe eller ingen påviselige symptomer på lunge-og/eller perifer overbelastning . Lav-output HF (LoHF) har også været forbundet med en ildevarslende prognose og signalerer meget avanceret HF. Desuden understøtter symptomatiske og patofysiologiske forskelle i CHF og LoHF behovet for forskellige kliniske ledelsesmetoder . På trods af disse forskelle er traditionelle HF-terapier blevet generaliseret til alle former for HF inklusive CHF og LoHF, hvilket skaber et klinisk behov for at forstå patofysiologi, diagnose og klinisk styring af LoHF. I denne artikel, vi aggregerer offentliggjorte beviser for LoHF med hensyn til epidemiologi, ætiologi, patofysiologi, diagnose og klinisk ledelse. Hensigten er at forny kendskabet til LoHF ‘ s kliniske status samt forbedre den kliniske styring af HF generelt.
Definition
hjertesvigt er et komplekst klinisk syndrom præget af strukturelle og / eller funktionelle myokardiedefekter, der fører til nedsat ventrikelfyldning eller udstødning . Syndromets kompleksitet er tydelig i dets heterogene klassifikationer: højre -, venstre-eller bi-ventrikulær baseret på defektplacering; akut eller kronisk baseret på begyndelsestid; bevaret, borderline eller reduceret udstødningsfraktion baseret på funktionel status; lav-eller høj-output baseret på hjerteudgang (CO) og fremad eller bagud svigt baseret på retningen af blodgennemstrømningen. Hver af disse klassifikationer er signifikant for diagnose og behandling af HF . På trods af de mange klassifikationer er udtrykket CHF traditionelt blevet brugt ombytteligt med HF, men som ikke tilstrækkeligt beskriver LoHF på grund af flere symptomatiske og patofysiologiske forskelle.
LoHF, også kendt som lav CO i akut dekompenseret HF, beskriver en højskarphedsform af HF karakteriseret ved nedsat fremad CO (hjerteindeks< 2.0 L/min/m2 og systolisk blodtryk < 90 mmHg) og endorganhypoperfusion med ringe eller ingen tegn på lungestop . LoHF adskiller sig fra CHF, som beskriver HF karakteriseret ved reduceret CO, der forårsager pulmonal og perifer overbelastning, der fører til henholdsvis dyspnø og perifert ødem . 2005 European Society of Cardiology (ESC) retningslinjer for diagnose og styring af HF antyder et kontinuum fra lavt hjerteudgangssyndrom (LCOS) til LoHF til kardiogent shock. ESC-retningslinjerne definerer kardiogent shock som bevis for vævsperfusion induceret af HF efter korrektion af forbelastning karakteriseret ved systolisk BP < 90 mmHg eller en dråbe gennemsnitligt arterielt tryk > 30 mmHg; urinproduktion < 0,5 ml/kg/h; pulsfrekvens > 60 slag i minuttet (BPM) med eller uden tegn på overbelastning . LCO ‘ er er på den anden side almindelige hos postoperative HF-patienter og defineret som behovet for postoperativ intra-aorta ballonpumpe eller inotrop støtte i mere end 30 minutter i en akut plejeindstilling .
Epidemiologi
den nøjagtige prævalens og forekomst af LoHF i den generelle befolkning er fuldstændig ukendt. På nuværende tidspunkt er der ingen befolkningsbaserede epidemiologiske data, der er specifikke for LoHF. De eneste tilgængelige data er fra kliniske enkeltcentre, der undersøger en udvalgt population af HF-patienter, der har gennemgået hjertekirurgi. I 1975, Parr et al. lavede den sædvanlige beskrivelse af den kliniske enhed af LCO ‘ er og rapporterede en forekomst på 25% hos børn, der havde gennemgået hjertekirurgi baseret på nedsat CO defineret som CI < 2,0 L/min/m2. To årtier senere, Vernovsky et al. viste den samme forekomst af postoperative LCO ‘ er hos patienter, der havde gennemgået arteriel omskifteroperation, der forekom inden for 6-18 timer efter operationen. Meget nylige kliniske forsøg rapporterer en bred variation i prævalensen, fra 3,6% (mænd) og 5,9% (kvinder) til 9,1% og til 41% og en forekomst på 14,7% . I en nylig langsigtet (tyve år: 1990-2009) prospektivt klinisk forsøg med 25.176 på hinanden følgende koronararterie by-pass graft (CABG) kirurgi patienter, Algarni et al. rapporterede prævalensen af postoperative LCO ‘ er faldt markant fra 9,1% (1990-1994) til 2,4% (2005-2009) .
ætiologi
etiologien af LoHF er multifaktoriel. Generelt er det en konsekvens af venstre ventrikel (LV), højre ventrikel (RV) eller systemisk ventrikel (enkelt ventrikel anatomi) dysfunktion og kan omfatte en eller begge systolisk og/eller diastolisk dysfunktion . Forstyrrelser i ventrikulær fyldning eller udstødning fører til LoHF, hvilket er en hyppig komplikation hos patienter, der har gennemgået hjertekirurgi eller er i kardiogent shock . Det kan forekomme som en akut forværring hos patienter med kronisk HF, eller det kan være forbigående og reversibel episode med opløsning af den akutte trigger. Det er et klinisk syndrom, der betragtes som den endelige vej for en lang række sygdomme, der påvirker hjertefunktionen. Det er ikke tilstrækkeligt at stille diagnose af LoHF, den underliggende årsag eller trigger skal også bestemmes og om muligt behandles . Tabel 1 giver en oversigt over tilstande, der forårsager lav output-tilstand hos HF-patienter.
tabel 1. Ætiologi af lav-output tilstand ved patofysiologi
|
mekanismer |
årsagssygdomme |
|
tab af myocardial kontraktilitet |
koronararteriesygdom, kardiomyopati, myocarditis, dekompenseret kronisk HF, post-hjertekirurgi, toksiner, ernæring (fedme)m infiltrative sygdomme, nyresvigt i slutstadiet, Chagas sygdom eller hiv-infektion |
|
nedsat ventrikelfyldning eller udstødning |
pericarditis, pericardial effusion, hjertetamponade, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
den nuværende forståelse af patofysiologien af LoHF er i vid udstrækning afhængig af beviser fra kliniske forsøg på postoperative CABG-patienter . Det patologiske kendetegn er overdrevent deprimeret CO ledsaget af end-organ hypoperfusion. Fysiologisk fungerer hjertet som en pumpe til distribution af iltet blod i tilstrækkelige mængder til at tilfredsstille vævets metaboliske behov. Da metaboliske behov varierer under normale og stressende situationer, varierer CO også for at tilfredsstille denne dynamiske efterspørgsel . Den diastoliske fase af hjertecyklussen er kritisk hos LoHF-patienter, fordi det er under ventrikulær afslapning, at koronarfyldning forekommer for at give myokardial iltning . Hjertefrekvens (HR) er også signifikant i diastol, fordi for hurtig HR forhindrer hjertet i at opnå fuldstændig myokardie afslapning og perfusion. Hjertedysfunktion skyldes således strukturel (resterende hjerteanomali) eller funktionel hjertesygdom (forstyrrelser i ventrikulær fyldning eller tømning eller øget systemisk vaskulær resistens ).
patofysiologisk er CO afhængig af HR og slagvolumen (SV) (CO = HR * SV). Slagvolumen er igen nettoproduktet af tre indbyrdes relaterede cirkulationsvariabler: preload, afterload og kontraktilitet. Hvis en eller flere af disse komponenter er nedsat, kan der udvikles en lav-hjerteudgangstilstand . Desuden påvirker disse komponenter både systoliske og diastoliske faser af hjertecyklussen, der forårsager LV/RV systolisk dysfunktion og/eller diastolisk dysfunktion, også kendt som HF med bevaret udstødningsfraktion (Figur 1). Andre tilstande såsom valvulær hjertesygdom, pulmonal hypertension (PH), mekanisk ventildysfunktion og respirationssvigt kan udfælde eller forværre udviklingen af LoHF .
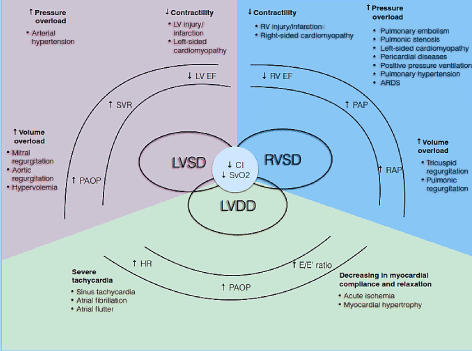
Figur 1. Patofysiologiske mekanismer med lavt output hjertesvigt
almindelige årsager og typiske; symptomer på LoHF er inkluderet. De vigtigste patofysiologiske mekanismer for LoHF er ventrikulær dysfunktion: LV systolisk og / eller diastolisk dysfunktion og RV systolisk dysfunktion, som alle deler fælles patologiske træk ved reduceret hjerteindeks (CI) og reduceret blandet venøs iltmætning (SvO2). LV og RV systolisk dysfunktion skyldes øget trykoverbelastning, øget volumenoverbelastning og nedsat kontraktilitet, mens LV diastolisk dysfunktion skyldes svær takykardi og nedsat myocardial overholdelse og afslapning. Tilpasset fra Lomivorotov et al. 2017, s. 293
LV ystolisk dysfunktion
venstre ventrikulær (LV) systolisk dysfunktion (eller deprimeret LV-udstødningsfraktion ) er den mest almindelige patofysiologiske mekanisme, der ses hos LoHF-patienter. Cirkulationsvariabler, der påvirker LV systolisk funktion, er forspænding, efter belastning og kontraktilitet . Generelt er LV systolisk dysfunktion en konsekvens af tab eller reduktion af funktionelle kardiomyocytter som følge af nekrose på grund af nedsat koronarcirkulation og iskæmi, reperfusionsskade eller det mindre forståede naturlige fænomen af kardiomyocytapoptose . Tabet af funktionelle kardiomyocytter kan være forbigående som set under myokardiebedøvelse defineret som et levedygtigt myokardium reddet af koronar reperfusion, som udviser langvarig post-iskæmisk dysfunktion efter reperfusion . Tabet af funktionel kardiomyocyt kan også være ildfast mod reversering under tilstande som infektion; takykardi; valvulær sygdom; metaboliske lidelser såsom acidose, hypoglykæmi, hypokalcæmi; eksponering for miljømæssige hjertetoksiner og kemikalier; idiopatisk udvidet kardiomyopati (DCM); DCM, hypertrofisk kardiomyopati og muskeldystrofier . Nedsat hjerterespons på forspænding forårsager et dramatisk fald i Co-og ilttilførsel til andre vigtige organer, forhøjet atrialt tryk, kapillært kiletryk og kardiogent lungeødem. Selvom kompenserende ændringer i LV tilpasser sig relativt højt systemisk arterielt tryk, kan signifikant stigning i efterbelastning inducere LV systolisk dysfunktion .
LV diastolisk dysfunktion
selvom det ikke er almindeligt, kan LoHF udvikles hos patienter med LV diastolisk dysfunktion med konserveret LVEF. Tilstanden skyldes manglende evne til det ventrikulære kammer til at fylde med tilstrækkeligt blodvolumen på trods af normal forspænding, som præsenterer som diastolisk dysfunktion . Underliggende tilstande såsom svær takykardi, nedsat myocardial overholdelse eller unormal ventrikulær afslapning forringer afslapning og påfyldning af LV under diastolfasen af hjertecyklussen. På kardiomyocytniveauet er disse tilstande forbundet med calciumfjernelse fra cytosol og calciumhomeostase, tilstrækkeligheden af tværbro-frigørelse og iboende funktionel cytoskeletal elementforstyrrelse . Cross-bridge-frigørelse kan bidrage til forsinket isovolumisk afslapningstid, hvilket resulterer i nedsat LV-slagvolumen, især ved højere HR . LV-afslapning afhænger også af retikulær retikulær calciumiongenoptagelse og signalering af salpetersyre, hvilket også letter detachement på tværs af broen. Da processen med tværbro-frigørelse er energiforbrugende, kan den forårsage et underskud i myokardieenergi og følgelig bremse LV myocardial afslapning .
På trods af at diastolisk dysfunktion er et udbredt fænomen set hos op til 70% af postoperative hjertepatienter , er diastolisk dysfunktion alene utilstrækkelig til at forklare udviklingen af akut HF. Ved indstilling af andre kliniske tilstande, såsom atrieflimren (af), nedsat koronarcirkulation og arteriel hypertension, kan diastolisk dysfunktion resultere i dekompenseret tilstand og antages således at være et tidligt tegn på myokardisk iskæmi . Det dynamiske forhold mellem LV diastoliske og systoliske funktioner bidrager også til diastolisk dysfunktion hos LoHF-patienter. Stimulering af inotrop catecholamin påvirker både diastol og systole og kan forbedre diastolisk dysfunktion. Deprimeret LVEF fører til en stigning i slut-systolisk volumen og forlænger den diastoliske fase af hjertecyklussen .
RV-dysfunktion
I LoHF, især efter koronararteriekirurgi, inkluderer de principielle patofysiologiske mekanismer for RV-dysfunktion øget forbelastning, øget afterload, nedsat perfusion af højre koronararterie og nedsat kontraktilitet . I modsætning til venstre koronararterie forekommer perfusionen af den højre koronararterie under både diastol og systole. Tilstedeværelsen af PH forårsager en stigning i RV-tryk, der fører til nedsat højre koronararterieperfusion, hvilket forklarer vigtigheden for at tilvejebringe optimal venstre og højre koronarcirkulation . Hos patienter, der har gennemgået koronararteriekirurgi, kan RV-dysfunktion udvikles som et resultat af en kombination af mekanismer. Perioperativ RV-iskæmi og infarkt er de vigtigste årsager til nedsat RV-kontraktilitet. Tricuspid eller pulmonal regurgitation re almindelige årsager til øget volumenforspænding, mens venstre sidet valvulær sygdom eller kardiomyopati, PH eller lungeemboli (PE), akut respiratorisk nødsyndrom og ventilation med højt positivt tryk er almindelige årsager til overbelastning af tryk . Da RV normalt tillader lavtryksperfusion af lungevaskulaturen, er den meget følsom selv for moderate stigninger i lungearterietryk (PAP). RV-svigt kan udvikle sig i indstillingen af PH eller nedsat kontraktilitet forbundet med en hurtig progression af RV-udvidelse, der fører til øget slutdiastolisk RV-tryk . Disse fysiologiske ændringer kan forårsage skift mellem ventrikulær septum mod et allerede underfyldt LV-kammer og følgelig forårsage en reduktion i LV-forspænding og et fald i CO .
risikofaktorer
risikofaktorer for LoHF forbliver et underundersøgt område. Imidlertid, få data tilgængelige fra kliniske forsøg med HF og fra postoperative LCO ‘ er-patienter giver værdifuld indsigt i risikofaktorer og forudsigere for LoHF. I analyse af 452 patienter indlagt med dekompenseret HF og lav hjerteproduktion var signifikante risikofaktorer for LoHF Chagas sygdom (relativ risiko : 3,66), deprimeret udstødningsfraktion (RR: 2,41), hyponatræmi (RR: 1,62) og nyresvigt (RR: 1,92) . Risikofaktorer for postoperativ LoHF inkluderer nedsat LV-funktion (< 50%), CABG på pumpen, akut eller kardiopulmonal bypass (CPB) kirurgi, ufuldstændig revaskularisering, alder> 65 år og en kombineret tilstedeværelse af diabetes mellitus og præoperativ nyresvigt . Foruden patient-og operationsrisikofaktorer er biokemiske prædiktorer for LoHF hos postoperative patienter lave hæmoglobinniveauer, totalt lymfocyttal < 2000 celler/RRL og præoperative niveauer af serum natriuretiske peptider . I løbet af de sidste to årtier har der været ændringer i udviklingen i nogle anerkendte risikofaktorer. Faktorer som hypertension, kvindelig køn, tredobbelt karsygdom og venstre hovedsygdom er ikke længere statistisk signifikante, mens risikoen forbundet med deprimeret præoperativ udstødningsfraktion er fordoblet .
diagnose
Der er ingen konsensusretningslinjer eller dokumenterede diagnostiske kriterier for LoHF-patienter. Derudover er kliniske tegn og symptomer ikke-specifikke. I mangel af standardiserede retningslinjer er diagnosen normalt afhængig af accepteret indsamling af hæmodynamiske og fysiologiske afvigelser, der er nyttige til at hæve klinisk mistanke om LoHF . Diagnose af LoHF alene er ofte ikke nok. Årsagen til lavudgangstilstanden skal også fastslås. I nogle årsager til lavudgangstilstand, såsom PE eller MI, er behandling af den underliggende årsag den vigtigste overvejelse, og det er derfor bydende nødvendigt at stille diagnosen. Da LoHF-patienter ofte er ustabile, er det også almindeligt, at klinisk evaluering, diagnose og behandling forekommer samtidig mere i akutte plejeindstillinger .
tegn og symptomer
lav hjerteproduktion som det præsenterende træk ved akut dekompenseret HF er ualmindeligt, hvilket kun påvirker 8,9 til 9,6% af indlagte Hf-patienter . LoHF kan dele mange kliniske træk med CHF, men der er bemærkelsesværdige forskelle, der kan understøtte eller vejlede efterfølgende diagnostiske beslutninger. Overdreven træthed og øget træningsintolerance er vigtige indledende tegn bemærket af LoHF-patienter, selv før diagnosen . Derudover er LoHF-patienter ofte til stede med agitation, forvirring og/eller nedsat bevidsthedsniveau; kold/vasokonstrikteret periferi eller forsinket kapillærpåfyldningstid; hypotension; takykardi eller bradykardi; thready puls; hævet jugulært venetryk; åndenød og hypoksæmi; og oliguri/anuria . Disse tegn og symptomer kan variere mellem lav perfusion og overbelastning hos HF-patienter (tabel 2).
tabel 2. Symptomer og tegn på lav perfusion vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: ESC-retningslinjerne fra 2016 om diagnose og styring af HF understreger vigtigheden af at opnå detaljeret patienthistorie og fysisk undersøgelse af alle patienter, der mistænkes for at have HF . Detaljeret historie fra patienten, eller pårørende og venner, hvis patienten er for utilpas, bør fokusere på at få information om symptomer, tidligere og nuværende hjerte-og ekstra-kardiale tilstande, der er i stand til at udfælde eller forværre HF, eksponering for risikofaktorer for HF eller lav output tilstand, og medicinhistorie for tidligere og nuværende medicinske tilstande . Ud over patientens historie anbefales fysisk undersøgelse til alle LoHF-patienter for at vurdere for kliniske indikatorer for hæmodynamisk, perifer perfusion, overbelastning, underliggende ætiologi og valvulær patologi. Hæmodynamiske parametre af interesse inkluderer blodtryk, HR og hjerterytme, galoprytme, iltmætning og åndedrætsfrekvens . Test for perifer perfusion bør omfatte bevidsthedsniveauer, perifer hud/central temperatur, kapillær genopfyldningstid og urinproduktion. Test for overbelastning omfatter forhøjet jugulært venetryk, perifert/pulmonalt ødem, hepatomegali, ascites og pleural effusioner. Tests for den underliggende ætiologi bør omfatte hjerte-kar-undersøgelse, og hjerte lyd og mumlen. Endelig bør bevis for valvulær dysfunktion omfatte perikardiel gnidning og bevis for perikardieeffusion med eller uden hjertetamponade .
kombinationen af patienthistorie og fysisk undersøgelse har vist sig uvurderlig i vurderingen af hæmodynamisk status og anerkendelse af LoHF . I 1976 Forrester et al. gennemført fysisk undersøgelse af patienter med akut myokardieinfarkt og identificerede fire hæmodynamiske profiler (A, B, L og C) som illustreret i figur 2. Hemodynamiske profiler er baseret på tilstedeværelse eller fravær af pulmonal overbelastning (pulmonal kapillær kiletryk > eller lut18 mmHg) og tilstrækkeligheden af perfusion (CI > 2,2 L/min/m2). Profil A repræsenterer ingen overbelastning / hypoperfusion; profil B overbelastning uden hypoperfusion; profil C hypoperfusion uden overbelastning; og profil L overbelastning og hypoperfusion . LoHF-patienter falder ind under profilerne L og C (hypoperfusion larrus-overbelastning baseret på Nohria et al. påvisning af, at Profil L og C har et gennemsnitligt CI på henholdsvis 1,6 L/min/m2 og 1,9 L/min/m2.
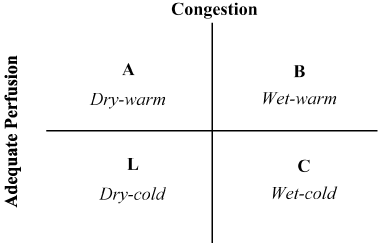
figur 2. Skematisk præsentation af klinisk profil for akut dekompenseret hjertesvigt
Congestion vurderes ved tilstedeværelse af orthopnø, jugular venøs distension, pulmonal rales, hepatojugular refluks, ascites, perifert ødem, abdominal refluks og Valsalva firkantet bølge. Lav perfusion blev vurderet ved tilstedeværelsen af et smalt pulstryk, pulsusændringer, kolde ekstremiteter, måske søvnige, faldende serumnatriumniveauer og forværret nyrefunktion. Tilpasset fra Nohria, et al.
elektrokardiogram (EKG): både AHA-og ESC-retningslinjer for HF anbefaler, at elektrokardiogram (EKG) skal udføres så tidligt som muligt hos alle patienter, der mistænkes for HF. EKG kan demonstrere en række abnormiteter og er meget usandsynligt, at det er normalt hos HF-patienter. Det kan også give tegn på en underliggende ætiologi af hjertedysfunktion, herunder bradykardi, atrioventrikulær blok, sinus takykardi, atriel eller ventrikulær takyarytmi, iskæmi, LV hypertrofi og lavspændingskomplekser .
grundlæggende laboratorietest: AHA-og ESC-Hf-retningslinjerne anbefaler også grundlæggende laboratorietest i den indledende kliniske evaluering for at understøtte diagnosen HF eller årsagen til lavudgangstilstand. Blodprøver skal udføres hos alle mistænkte HF-patienter. Hæmoglobin (Hb > 10 g/dL) indikerer optimal ilttilførsel til væv), kronisk anæmi er almindelig hos kronisk HF, og markant øgede hvide blodlegemer giver anledning til mistanke om alternativ diagnose. Test for serumelektrolyt til bestemmelse af niveauer af kalium, magnesium og calcium. Urea – og kreatinintest til vurdering af renal hypoperfusion og dysfunktion, der er almindelig ved HF. Test for nedsat leverfunktion, som antyder nedsat RV og/eller leverbelastning. Glukosetest til vurdering af hypoglykæmi, der kan forringe hjertefunktionen. Skjoldbruskkirtelfunktionstest for hypo – eller hyper-thyroidisme, der kan forårsage iboende myokardieinfarkt. Endelig test for serum natriuretiske peptider, hvis forhøjede niveauer indikerer øget ventrikulær vægspænding, men som ikke registrerer pludselige ændringer i ventrikulært påfyldningstryk på grund af deres lange halveringstid .
Hjerteafbildningstest: Hjerteafbildning spiller en central rolle i diagnosen HF såvel som i overvågning og vejledende terapi. Ekkokardiografi er den foretrukne modalitet af hensyn til nøjagtighed, tilgængelighed, sikkerhed og omkostningseffektivitet . Det kan suppleres med andre billeddannelsesmetoder valgt ud fra evnen til at besvare specifikke kliniske spørgsmål, mens man overvejer kontraindikationer og risici .
ekkokardiografi: ekkokardiografi anbefales kraftigt til alle mistænkte patienter på grund af dets evne til at bekræfte eller udelukke klinisk diagnose af LoHF, til at vurdere SV og dens variationer og til at bestemme årsagen til lav output tilstand . Transthoracic ekkokardiografi skal udføres så hurtigt som muligt efter klinisk diagnose af lavt hjerteudgang. Ikke kun måler det omfanget af systolisk og diastolisk dysfunktion, det giver også værdifuld information om ventrikulær morfologi, valvulær dysfunktion, myokardie-og perikardiel sygdom og regionale vægbevægelsesabnormiteter . Ekkokardiografi evaluerer systolisk funktion ved at måle LEVF, hvor > 45-50% betragtes som normal. På den anden side evalueres diastolisk funktion ved hjælp af mitral i strømningsmønstre, pulmonal venestrøm og vævsdoppler ved mitral annulus, mens CO og SV evalueres ved hjælp af Doppler-princippet. Pulmonal arterietryk (PAP) kan estimeres ved at måle regurgitate jethastighed. Høj PAP i nærvær af udvidet RV med septalfladning eller bøjning i LV, hvilket indikerer akut stigning i RV-tryk, der hæver klinisk mistanke om PE som årsag til lav udgangstilstand .røntgenbillede af brystet: røntgenbillede af brystet kan overvejes hos patienter, der mistænkes for LoHF. Vigtige indikatorer, der bør overvejes til vurdering, inkluderer forstørret hjerte, der indikerer kardiomegali eller LV-hypertrofi; pulmonal venøs overbelastning, der indikerer forhøjet LV-påfyldningstryk; og pleural effusion, der indikerer forhøjet LV-tryk, lungeemboli eller post-hjertekirurgi( .
koronar angiografi: indikationer for koronar angiografi hos LoHF-patienter skal være i overensstemmelse med anbefalingen af relevante konsensusretningslinjer for HF . Hos HF-patienter, der har brystsmerter og tegn på ST-elevation myokardieinfarkt (STEMI) på EKG, skal revaskularisering ved hjælp af primær perkutan koronar intervention udføres så hurtigt som muligt. Koronar angiografi bør også overvejes hos patienter med post-hjertestop af iskæmisk ætiologi, når der er tegn på HF og hos patienter, der er kommet sig efter lav output-tilstand, når årsagen ikke er bestemt .
klinisk ledelse
tilstedeværelsen af LoHF repræsenterer en meget højrisikotilstand, der kræver hurtig behandling, men mangler standardiserede retningslinjer for Klinisk styring . Derfor overvejer klinikere normalt individuel patofysiologi for at vælge den mest passende behandlingsstrategi . Hos akutte LoHF-patienter anbefaler ESC HF-retningslinjerne fra 2016 brugen af hæmodynamiske profiler (baseret på tilstedeværelse eller fravær af overbelastning og tilstrækkelighed af perfusion) til vejledning klinisk styring . For LoHF-patienter i profil L (ingen overbelastning, men hypoperfuseret) og profil C (både overbelastning og hypoperfuseret), der er i akut dekompensationstilstand, kan akutbehandlingsmål omfatte genoplivning af patienter, gendannelse af iltning, forbedring af organperfusion og optimering af hæmodynamisk (slagvolumen og CO) og løsning af symptomer. Andre efterfølgende mål inkluderer optimal overvågning og etablering af den underliggende årsag til lav hjerteproduktion og behandling af årsagen, hvis den er reversibel . På nuværende tidspunkt er tilgængelige terapeutiske mål for LoHF optimering af iltning af væv, stabilisering af cirkulation og behandling af reversible årsager til lav output tilstand (figur 3).
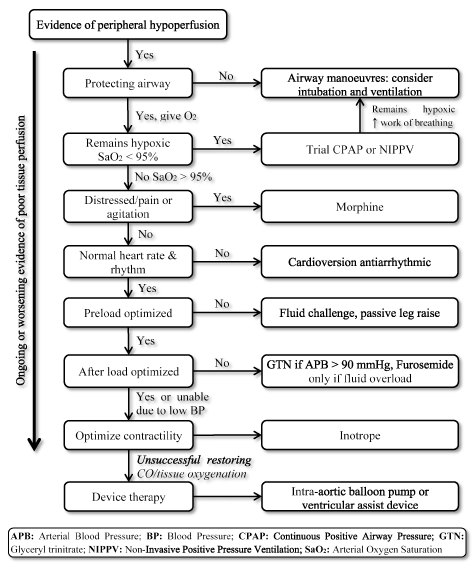
figur 3. Behandlingsalgoritme til hjertesvigt med lavt output
behandling af LoHF sigter mod forbedring af iltning af væv og stabilisering af cirkulation baseret på igangværende eller forværrede symptom på vævsperfusion. Behandlingen begynder med at forbedre ventilationen ved hjælp af levering af ilt med høj strømning, kontinuerligt positivt luftvejstryk (CPAP) eller ikke-invasiv ventilation med positivt tryk (NIPPV). Hvis det ikke lykkes, gives kardioversion eller antiarytmiske lægemidler til normalisering af hjerterytme, væskeudfordring for at optimere forbelastning og/eller vasodilatorer og inotroper for at manipulere og forbedre kontraktiliteten henholdsvis. Hvis tidligere ventilation og medicin ikke lykkes med at gendanne hjerteproduktion og/eller iltning af væv, kan enhedsterapi ved hjælp af intra-aorta ballonpumpe eller ventrikulære hjælpeanordninger overvejes
Optimer iltning af væv (ventilationsstrategier)
klinisk behandling af LoHF-patienter begynder ofte med vurdering af luftvej, vejrtrækning og cirkulation for tegn på perifer hypoperfusion. Ventilatorstrategier såsom oropharyngeal eller nasopharyngeal luftveje er almindelige hjælpestoffer, der bruges til at genoprette eller opretholde luftvejens åbenhed hos LoHF-patienter med nedsat bevidsthedsniveau på grund af nedsat cerebral perfusion. Yderligere endotrakeal intubation bør overvejes, hvis patienten forbliver med kompromitterede luftveje . Hvis patienter fortsætter med at forblive hypoksiske (SaO2 < 95%), kan maksimering af ilttilførsel ved hjælp af ilt med høj strømning, kontinuerligt positivt luftvejstryk (CPAP) eller ikke-invasiv ventilation med positivt tryk (NIPPV) overvejes. Hos patienter uden forbedring kan intubation eller ventilation overvejes .
Stabiliser cirkulation
hjerteudgang (CO) er en funktion af HR og SV. Til gengæld afhænger SV af fire cirkulationsvariabler – puls, forspænding, kontraktilitet og afterload. Optimering af alle disse variabler forbedrer CO hos LoHF-patienter . I klinisk indstilling afhænger strategier for at øge CO af den underliggende årsag og den berørte cirkulationsvariabel . Kliniske indgreb inkluderer volumenjustering, farmakologisk støtte og enhedsterapi.
puls / rytme: Som en del af kroppens fysiologiske respons øger stigende HR CO. For hurtig eller langsom HR har en skadelig virkning på CO. Hos LoHF-patienter med takykardi (for hurtig hvilende HR > 100 bpm), der er nødlidende, rastløse og dyspnø, kan morfin administreres for at lindre dyspnø, smerte og agitation såvel som det er en mild venodilator til reduktion af afterload, især hos CPAP-eller NIPPV-patienter . Hvis HR < 40 bpm med tegn på hæmodynamisk kompromis og/eller nedsat CO, skal medicin, der øger HR (atropin og antikolinergika ) eller interventioner såsom transkutan/transvenøs pacing udføres. Akut elektrisk kardioversion bør overvejes i udvalgte LoHF med ventrikulær/supraventrikulær takykardi eller Hurtig af med tegn på kardiovaskulær kompromis .
Optimer preload( Volumenjusteringer): måling af preload er afgørende for dens optimering. Det anbefales til patienter med klinisk evidens for nedsat perifer perfusion. En væskeudfordring bør udføres for at vurdere forspændingsresponsivitet. Hurtigt infusion af 250 ml væske (krystalloid eller kolloid) i over fem minutter og objektivt vurdering af effekten på SV. Hvis effekten er en stigning eller fald > 10%, skal patienten fortsætte med at modtage væskeboluser for at optimere forbelastningen, indtil de ikke længere er væskeresponsive . For patienter med tegn på overbelastning og lungeødem, der ikke kræver væskebolus, kan der foretages en passiv benopstigning – løft patientens ben til 45 grader for at udelukke behovet for væskeudfordring. Hvis svaret, hvis det er gunstigt, kan der gives en reel væskeudfordring .
manipulere afterload (farmakologisk støtte): Afterload er modstanden mod hvilken ventriklen skubber blod ud, til tider estimeret som SVR. Afterload bør reduceres hos LoHF-patienter med høj afterload, lav CO, tegn på dårlig perifer perfusion og lungeødem. Farmakologisk støtte ved anvendelse af vasodilatorer bør gives til LoHF-patienter med systolisk BP-karrus 110 mmHg. Hos patienter med systolisk BP < 90 mmHG og gennemsnitligt arterielt tryk < 65 mmHg anbefales vasodilatorer ikke på grund af risikoen for hypotension, hvilket kan komplicere organperfusion. Hos disse patienter anbefales inotroper som den første behandlingslinje .
forbedre kontraktilitet (farmakologisk støtte): Hvis patienten fortsætter med tegn på vævshypoperfusion eller nedsat ilttilførsel på trods af indgreb for puls, forspænding og efterbelastning, bør behandling for at forbedre kontraktiliteten overvejes. I mellemtiden bør optimering af ilttilførslen fortsættes med at sigte mod hæmoglobin på 10 g/dl og sikre optimale iltmætninger (SaO2). Faktorer, der påvirker myokardial kontraktilitet negativt, er hyperkaliæmi, hypomagnesæmi, hypokalcæmi, svær acidose, hypoksi og hypoglykæmi, som skal korrigeres. Inotroper anbefales for at forbedre kontraktiliteten og efterfølgende CO hos LoHF-patienter med lav BP og/eller lav CI i nærvær af tegn på dårlig perifer perfusion eller overbelastning . Imidlertid bør farmakologisk støtte ved hjælp af dobutamin (en inotrope) anvendes med forsigtighed hos patienter, der har takykardi eller af, fordi det øger av-nodeledningen og kan udfælde hurtige ventrikulære rytmer . På den anden side anbefales levosimendan til LoHF-patienter med akut myokardisk iskæmisk eller post-hjertekirurgi, da det ikke øger myokardisk iltbehov . Langsigtet effekt af inotroper kan være skadelig, og deres anvendelse bør derfor stoppes, når stabiliteten er opnået. Vasopressorer bør ikke være den første linje medicin i lav-output tilstande, da de øger SVR og efterfølgende forringer CO. Imidlertid anbefales en dobbeltbehandling af vasopressorer og inotrope til patienter, der har sepsis som den underliggende årsag til lav output-tilstand .
device therapy: Device therapy bør overvejes hos LoHF-patienter, når optimale medicinske terapier ikke har haft succes med at genoprette Co-og vævets iltning. Almindelige enhedsterapier inkluderer intra-aorta ballonpumpe (iabp) og ventrikulær hjælpeanordning (VAD). Brugen af Iabp er almindelig hos LoHF-patienter med iskæmisk hjertesygdom, præ-eller post-perkutan intervention eller post-hjertekirurgi. IABP består af en ballon indsat i aorta gennem lårarterien. Ballonen opblæses under diastol og tømmes under systole for at øge diastolisk BP og følgelig koronar perfusion og reducerer afterload derved stigende CO . På den anden side er brugen af VAD usædvanlig. Det kan kun bruges i specialcentre. Det bruges almindeligvis som en bro til hjertetransplantation hos patienter med gunstig livskvalitet eller til bedring hos patienter med akut myocarditis .
behandling af underliggende årsager
nogle årsager til lav output tilstand hos patienter med LoHF kan vendes med specifikke terapier. Reversible årsager skal identificeres tidligt under den indledende kliniske evaluering. Disse årsager inkluderer akut hjerteinfarkt, hjertetamponade, spændingspneumothoraks, lungeemboli og akut ventilfejl . (Tabel 3).
metaanalyse af diagnose og klinisk styring
grundlaget for klinisk diagnose af LoHF har været ekkokardiografisk bevis for LV/RV systolisk dysfunktion og / eller LV diastolisk dysfunktion ledsaget af bevis for reduceret CO og SvO2 . Hæmodynamiske profiler baseret på målinger af overbelastning og perfusion er blevet brugt til at klassificere akutte HF-patienter i fire profiler: tør-varm (a), våd-varm (B), tør-kold (L) og våd-kold (C) og nyttig til identifikation af LoHF-patienter . LoHF-patienter er klassificeret i profiler (L) og (C) baseret på tilstedeværelsen/fraværet af overbelastning og/eller utilstrækkeligheden af perifer perfusion . Disse to hæmodynamiske profiler har dannet grundlaget for udvælgelse af patienter med LoHF i kliniske forsøg samt giver enkel bedside vurdering for at hjælpe med at klassificere patienter på præsentationstidspunktet og til at guide udvælgelsen af indledende terapier . Målet med den nuværende metaanalyse er at samle offentliggjort bevis for almindelige diagnostiske træk og behandlingsresultater for patienter med LoHF.
søgestrategi
tre store online databaser (PubMed, EMBASE og Cochrane) blev systematisk søgt siden starten til December 2018 for undersøgelser, der undersøgte diagnose og klinisk styring af LoHF. For at undgå at overse undersøgelser, der ikke nævnte LoHF i titlen eller abstraktet, blev de første 200 relevansrangerede artikler hentet med en Google Scholar-søgning i fuld tekst inkluderet. Der blev ikke anvendt nogen offentliggørelsestid eller sprogbegrænsninger. Yderligere undersøgelser blev identificeret ved en manuel søgning af referencelisten fra de inkluderede undersøgelser samt fra relevante gennemgangsartikler, som derefter blev underkastet inklusionskriterierne. Søgekriterierne omfattede population af interesse (patienter med LoHF eller LCO ‘ er), diagnostiske test af interesse (ekkokardiografi og hæmodynamiske profiler) og intervention af interesse (ventilatorstrategier, volumenjustering, farmakologisk støtte og enhedsterapi). Undersøgelser blev inkluderet, hvis de opfyldte følgende kriterier: (a) inkluderede patienter med LoHF; (B) diagnosticeret ved hjælp af ekkokardiografi og hæmodynamiske profiler; (c) behandlede patienter til hæmodynamisk stabilisering; og (d) rapporterede behandlingsresultater. I tilfælde af undersøgelser, der rapporterede duplikatdata, var kun den undersøgelse, der gav det største antal patienter, inkluderet. Konferenceabstrakter, sagsrapporter og gennemgangsartikler blev udelukket.
Studievalg
figur 4 illustrerer den søge-og screeningsproces, der bruges til at inkludere kvalificerede undersøgelser. To korrekturlæsere uafhængigt screenet alle titler og abstracts hentet fra den systematiske online søgning. Abstracts, der omfattede befolkning, intervention og resultater af interesse blev inkluderet til fuldtekstsøgning. Bagefter gennemgik de to korrekturlæsere også uafhængigt fuldtekstartikler i forhold til inklusionskriterierne. I tilfælde af uoverensstemmelse blev det løst gennem diskussion og konsensus.

figur 4. Rutediagram over litteratursøgning og inklusionsproces
dataindsamling
to korrekturlæsere udtrækkede uafhængigt data fra de inkluderede undersøgelser, og enhver uoverensstemmelse blev løst gennem konsensus. De vigtigste data, der blev ekstraheret, var ekkokardiografiske og hæmodynamiske profildata og anvendt behandling og behandlingsresultat på hæmodynamisk (hjerteindeks, PCVP) og mortalitet. Ud over disse hoveddata ekstraherede de to korrekturlæsere også data om studiekarakteristika, patienters egenskaber og opfølgningsvarighed (Tabel 4).
statistisk analyse
resultater af interesse rapporteret i mere end en undersøgelse er hjerteindeks, PCVP og dødelighed. For hvert resultat blev der uddraget sammenfattende statistik (gennemsnitlig standardafvigelse i forhold til baseline) før og efter intervention eller forskellen mellem baseline og efter behandling. Disse sammenfattende statistikker blev ekstraheret separat for behandlings-og kontrol – /placebogrupper. Diagnostiske resultater og behandlingseffekter blev målt ved forskel i middel før og efter intervention og tilhørende 95% konfidensinterval. Skovarealer blev brugt til visuelt at undersøge heterogenitet (i2) på tværs af undersøgelser. Samlet diagnostisk og behandlingseffekt og tilhørende 95% konfidensinterval blev estimeret ved hjælp af fast effekt (i2 < 49%) eller tilfældig effektmodel (i2 > 50%). P-værdi > 0,05 blev betragtet som statistisk signifikant.
resultater
Studiekarakteristika
tolv (12) randomiserede kontrollerede forsøg (RCT ‘ er) opfyldte inklusionskriterierne. Syv (7) studier inkluderede LoHF-patienter og de resterende fem (5) inkluderede HF-patienter, der har gennemgået hjertekirurgi med lav hjerteudgang. Størstedelen af offentliggjorte kliniske forsøg (10) undersøgte medicin , der sammenlignede effekten af forskellige typer inotroper på hæmodynamisk og forebyggelse af død: kun dobutamin , dobutamin og dopamin ; levosimendan og dobutamin og levosimendan og placebo . Af de resterende to kliniske forsøg undersøgte hver vasodilator (nitroprussid) og placebo og Device therapy (iabp) og inotrope (levosimendan) alene eller i kombination med iapb . I alt omfattede de 12 kliniske studier 3.738 patienter i gennemsnitsalderen 64 år (interval = 55-74 år), hvoraf størstedelen var mænd (78%).
syntese af resultater
diagnosedata om LoHF var inkonsekvent. På tværs af de tolv kliniske forsøg opstod der ingen fælles definition af LoHF, der ville have været nyttigt at vejlede diagnosen. Hæmodynamiske kriterier anvendt til inklusion af patienter i forsøgene inkluderede CI < 2,0 L/min/m2 , CI < 2,2 L/min/m2 eller CI < 2,5 L/min/m2 og PCV > 15 mmHg eller 18 mmHg . Definitionen varierede også på tværs af undersøgelser – postoperativ tilstand med hypotension (systolisk BP < 90 mmHg for > 30 minutter) eller behovet for inotrop støtte til at opretholde systolisk BP > 90 mmHg og end-organ hypoperfusion (kolde periferier, urinproduktion < 30 ml/time) . Kardiogent shock er blevet beskrevet som et komplekst syndrom, der involverer en kaskade af akut LV-dysfunktion, nedsat CO, hypotension og vævshypoperfusion .
figur 5 og 6 viser skovområder for standardiseret gennemsnit af hjerteindeks ved baseline og efter henholdsvis inotrope eller vasodilatorbehandling. Baseline – hjerteindekset steg fra et gennemsnit på 1,93 (95% CI: 1,91-1,95) til et gennemsnit efter behandling på 2,82 (95% CI: 2,80-2,84). Figur 7 viser en skovplot for standard gennemsnitlig forskel (SMD) af hjerteindeks efter behandling med levosimendan og dobutamin. Levosimendan opnår højere hjerteindeks sammenlignet med dobutamin (SMD: 2,82; 95% CI: 2,54-3,10). Som profylaktisk mod LoHF hos postoperative patienter opnåede levosimendan-infusion efter anæstesi et højere hjerteindeks (2, 57) sammenlignet med præoperativ Iabp (2, 3) eller med en kombination af levosimendan (2, 4). Figur 8 viser en skov plot af dødelighed mellem levosimendan og placebo. Levosimendan havde lavere dødelighed sammenlignet med placebo (Odds Ratio : 0,83; 95% CI: 0,59-1,18), men forskellen var ikke statistisk signifikant (p=0,30). Endelig viser figur 9 yderligere, at Levosimendan har en lavere dødelighed sammenlignet med dobutamin (eller: 0,65; 95% CI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
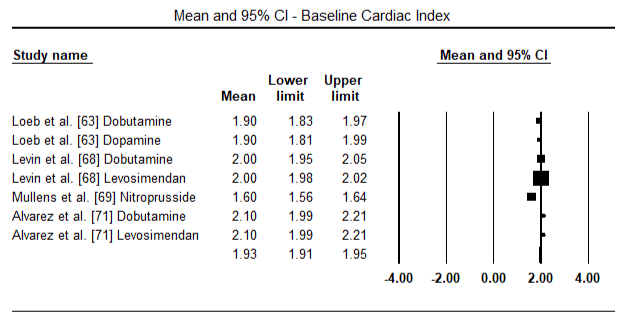
Figure 5. Mean baseline cardiac index
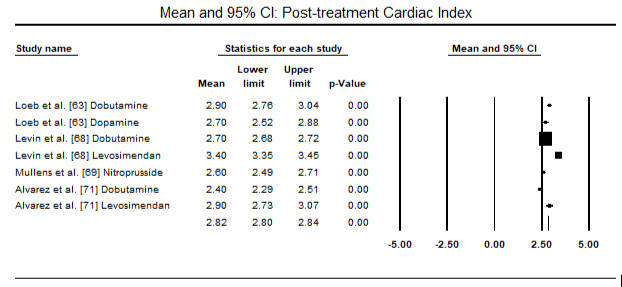
Figure 6. Mean post-treatment cardiac index
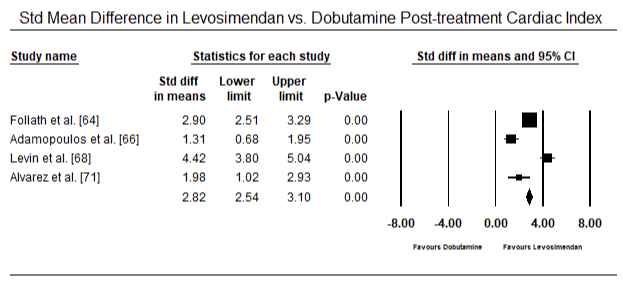
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
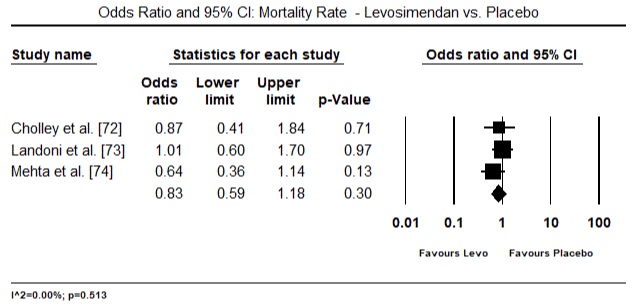
Figure 8. Mortality rate between levosimendan and placebo
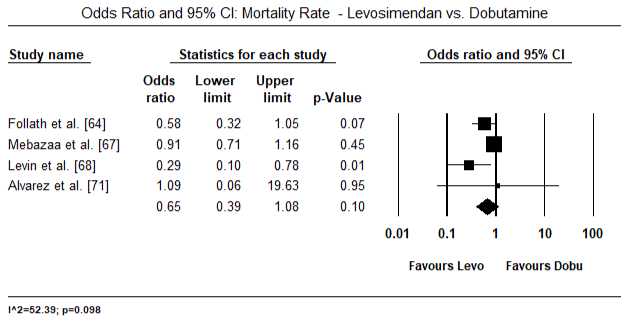
Figure 9. Dødelighed mellem levosimendan og dobutamin
diskussion af fund
denne systematiske gennemgang og metaanalyse vurderede almindelige diagnostiske træk og behandlingsresultater af medicinsk og enhedsterapi (iabp) på LoHF-patienter. Resultaterne indikerer, at LoHF-patienter mangler bredt accepterede eller standardiserede diagnosefunktioner. Selvom LoHF-patienter kunne udvise flere funktioner, herunder hjerteindeks, systolisk BP og SvO2 for at foreslå eller understøtte klinisk diagnose, alle disse funktioner har forskellige afskæringsværdier på tværs af undersøgelser. Hjerteindeks, som er det mest almindelige kliniske træk, der viser lavudgangstilstand i LoHF, har tre afskæringsværdier: < 2,0 L/min/m2, < 2,2 L/min/m2 eller < 2,5 L/min/m2 . Inotrop støtte opstod som en meget almindelig intervention til forbedring af perfusion og normalisering af hjerteproduktion hos LoHF-patienter.
inotrop medicin såsom levosimendan, Dobutamin, Dopamin, vasodilator (nitroprussid) og iabp forbedrede CI signifikant mellem baseline og efterbehandling. Med hensyn til inotroper er levosimendan mere effektiv til at forbedre hæmodynamisk stabilitet og en bedre profylaktisk mod kortvarig død (30-dages dødelighed) end dobutamin. Derudover kan inotroper virke som profylaktiske mod udviklingen af postoperativ LoHF. På den anden side, mens inotroper forbedrer hæmodynamisk og normaliserer hjerteproduktion, giver de ikke nogen signifikant bedre beskyttelse mod dødelighed uanset hvilken type inotrope der anvendes.
inotropes rolle i behandlingen af LoHF er blevet understøttet af en tidligere gennemgang af inotrope midler og vasodilatorstrategier til behandling af kardiogent shock og LCO ‘ er . Gennemgangen rapporterede inotroper forbedrer hæmodynamiske, bivirkninger i postoperative LCO ‘ er og reduceret dødelighed. Nyere inotroper såsom levosimendan (en calciumsensibilisator og inodilator) er en positiv inotrope har nogle vasodilatoriske egenskaber . Det kan også betragtes som en selektiv lever vasodilator, som kan forbedre portalvenestrømmen via leverarterie og portalvenestrøm sammenlignet med dobutamin, der kun kan forbedre portalvenestrømmen uden at vasodilatere leverarterien . Levosimendan øger heller ikke myokardisk iltbehov og anbefales over dobutamin hos LoHF-patienter med akut myokardisk iskæmisk eller post-hjertekirurgi . For postoperativ LoHF forbliver den beskyttende virkning af inotroper mod kortvarig dødelighed (30-dages dødelighed) ubetydelig sammenlignet med placebo .
den nuværende systematiske gennemgang og meta-analyse har nogle vigtige begrænsninger. LoHF kan forekomme i sekundær til underliggende hjertesygdom, såsom akut myokardieinfarkt eller postoperativ. De fleste af undersøgelserne omfattede undersøgt postoperativ LoHF med færre præsentation af LoHF fra andre årsager. De fleste af undersøgelserne fokuserede på to inotroper (Levosimendan og dobutamin), hvilket begrænsede forståelsen af andre inotroper såvel som andre terapier, såsom enhedsterapier. I nogle forsøg var analysen i fare for fejlklassificeringsforstyrrelse på grund af et betydeligt antal patienter, der mistede opfølgningen. Da de fleste af forsøgene ikke rapporterer parvis forskel før og efter intervention med tilknyttet standardafvigelse, før og efter intervention forskel med standardafvigelse, før og efter intervention resultater måler som uafhængige, dette opnår sider konfidensintervaller for behandlingseffekt med en tilknyttet standardafvigelse.
konklusion
hjertesvigt med lav output (LoHF) er et klinisk syndrom, der er kendetegnet ved nedsat hjerteproduktion ledsaget af hypoperfusion i slutorganet. Det er en usædvanlig form for hjertesvigt i den generelle befolkning, men udbredt i post-operation Hf patienter. Dens ætiologi er heterogen, der består af forskellige tilstande, der forårsager lavudgangstilstand og hjertekirurgi. De vigtigste patofysiologiske mekanismer er LV systolisk og/eller diastolisk dysfunktion og RV dysfunktion forårsaget af ændringer i puls, forspænding, afterload og / eller kontraktilitet. Generelle risikofaktorer for LoHF inkluderer Chagas sygdom, deprimeret udstødningsfraktion og nedsat nyrefunktion, mens det hos postoperative patienter inkluderer nedsat LV-funktion, ufuldstændig revaskularisering, ældre alder og tilstedeværelse af diabetes og nedsat nyrefunktion. Diagnose mangler standardiserede retningslinjer og afhængig af accepteret indsamling af hæmodynamiske og fysiologiske afvigelser inklusive tilstande, der forårsager lav output tilstand. Patienthistorie og fysisk undersøgelse hjælper med at vurdere hæmodynamisk status og genkende tilstand med lav output, mens ekkokardiografi bekræfter ventrikulær dysfunktion (HF) og lav hjerteproduktion. Andre tests til støtte for diagnose eller fastslå årsagen til lav output-tilstand inkluderer elektrokardiogram og basale laboratorietests (blod, serumelektrolyt, urinstof og kreatinin, levertest, skjoldbruskkirtelfunktion og serumnatriuretiske peptider) og hjerteafbildning (røntgenbillede af brystet eller koronar angiografi). Behandling mangler etablerede retningslinjer, men afhænger af vurderingen af individuel patofysiologi for at vælge den mest passende behandlingsstrategi. Behandling inkluderer ventilatorstrategier til forbedring af hjerterytme og rytme; volumenjustering for at optimere forbelastning; farmakologisk støtte (inotroper og vasodilatorer) til at manipulere afterload og forbedre kontraktilitet; og enhedsterapi (intra-aorta ballonpumpe eller ventrikulær hjælpeanordning), når disse strategier ikke gendanner hjertets output. Hos udvalgte patienter kan terapier til at vende underliggende sygdom genoprette hjerteproduktionen.
- Inamdar a, Inamdar A (2016) hjertesvigt diagnose, ledelse og udnyttelse. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) den seneste udvikling i hjertesvigt. Circ Res 117: e58-63. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Et Al. (2012) retningslinjer for diagnose og behandling af akut og kronisk hjertesvigt 2012: taskforcen for diagnose og behandling af akut og kronisk hjertesvigt 2012 fra European Society of Cardiology. Udviklet i samarbejde med ESC ‘ s hjertesvigt Association (HFA). Eur J Hjertesvigt 14: 803-869.
- Yancy m, Jessup M, Butler J, Casey de, et al. (2013) 2013 ACCF/AHA retningslinje for håndtering af hjertesvigt: en rapport fra American College of Cardiology Foundation/American Heart Association Task Force om retningslinjer for praksis. J Am Coll Cardiol 62: e147-239.P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 Esc retningslinjer for diagnosticering og behandling af akut og kronisk hjertesvigt: Taskforcen til diagnose og behandling af akut og kronisk hjertesvigt i European Society of Cardiology (ESC) udviklet med det særlige bidrag fra Heart Failure Association (HFA) fra ESC. Eur Hjerte J 37: 2129-2200.
- Masse L, Antonacci M (2005) lavt hjerteudgangssyndrom: identifikation og styring. Crit Pleje Nurs Clin 17: 375-383.
- Poppas A, runder S (2002) kongestiv hjertesvigt. Am J Respir Crit Pleje Med 165: 4-8.
- Nieminen MS, Bohm M, Hr. (2005) sammendrag af retningslinjerne for diagnose og behandling af akut hjertesvigt: taskforcen for akut hjertesvigt i European Society of Cardiology. Eur Hjerte J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JV (1975) Hjertepræstation og dødelighed tidligt efter intrakardial kirurgi hos spædbørn og små børn. Cirkulation 51: 867-874.Hanley FL, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) postoperativt forløb og hæmodynamisk profil efter arteriel omskifteroperation hos nyfødte og spædbørn: en sammenligning af lavstrøms kardiopulmonal bypass og cirkulationsstop. Cirkulation 92: 2226-2235.
- Hogue Jr., Sundt t 3rd, Barsilai B, Schectman KB, D Krisvila-Rom Krisn VG (2001) hjerte-og neurologiske komplikationer identificerer risici for dødelighed for både mænd og kvinder, der gennemgår koronar bypassoperation. Anæstesiologi 95: 1074-1078.
- Rao V, Ivanov J, Viisel RD, Ikonomidis JS, Christakis GT, et al. (1996) forudsigere for lavt hjerteudgangssyndrom efter koronararterie bypass. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierres F, Garcia-Puente JJ, et al. (2010) Epidemiologi og nye forudsigere for lavt hjerteudgangssyndrom efter isoleret koronar bypass-podning. Eur Hjerte J 31: 68-69. oj, Cavalcante, et al. (2012) risikofaktorer for lavt hjerteudgangssyndrom efter koronar bypass-podningskirurgi. Grill J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) forudsigere for lavt hjerteudgangssyndrom efter isoleret koronar bypassoperation: tendenser over 20 år. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) styring af det lave hjerteudgangssyndrom efter operation for medfødt hjertesygdom. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) lav-hjerte-output syndrom efter hjertekirurgi. J Cardiothorac Vasc Anæstesi31: 291-308.
- Tibby SM., Murdoch IA (2003) overvågning af hjertefunktion i intensiv pleje. Arch Dis Barn 88: 46-52.
- Carcillo JA, Field AI (2002) kliniske praksisparametre til hæmodynamisk understøttelse af pædiatriske og neonatale patienter i septisk chok. Crit Pleje Med 30: 1365-1378.
- Chiong M, Cao DJ, Troncoso R, et al. (2011) Kardiomyocytdød: mekanismer og translationelle implikationer. Celledød & sygdom 2: e244.
- Tavernarakis N (2007) Kardiomyocytnekrose: alternative mekanismer, effektive interventioner. Biochimica et Biophysica Acta (BBA)-Molekylær celleforskning 1773: 480-482.(2008) apoptotisk og ikke-apoptotisk programmeret kardiomyocytdød i ventrikulær remodellering. Cardiovasc Res 81: 465-473.Richard Conti C (1991) det bedøvede og dvale myokardium: en kort gennemgang. Clin Cardiol 14: 708-712. AA, Royse CF, Fouda MA, Royse AG (2012) diastolisk hjertesvigt efter hjertekirurgi. I koronararteriesygdom-aktuelle begreber i epidemiologi, Patofysiologi, diagnostik og behandling 2012. InTech.
- Kass DA, Brons JG, Paulus VJ (2004) hvilke mekanismer ligger til grund for diastolisk dysfunktion i hjertesvigt? Circ Res 94: 1533-1542.Borlaug BA, Paulus VJ (2010) hjertesvigt med bevaret uddrivningsfraktion: patofysiologi, diagnose og behandling. Eur Hjerte J 32: 670-679.
- Ramires-Correa GA, Murphy AM (2007) er Phospholamban eller Troponin i den “prima Donna” i den Purpur-adrenerge inducerede Lusitropi? Circ Res 101: 326-327.
- Paulus, Vantrimpont PJ, Shah AM (1994) akutte virkninger af salpetersyre på venstre ventrikulær afslapning og diastolisk distensibilitet hos mennesker. Vurdering ved bicoronær natriumnitroprussidinfusion. Circ 89: 2070-2078. Lappas GD, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) prævalens af venstre ventrikulær diastolisk Fyldningsabnorrnaliteter hos voksne Hjertekirurgiske patienter: en intraoperativ ekkokardiografisk undersøgelse. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) biventrikulære diastoliske påfyldningsmønstre efter koronararterie bypass graft kirurgi. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, maga A, Allegra L (2005) pulmonal arteriel hypertension: ekkokardiografiens nøglerolle. Bryst 127: 1836-1843. V, Jones N (2014) akut højre hjerte syndrom hos den kritisk syge patient. Hjerte lunge fartøj 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) indledende klinisk erfaring med en miniaturiseret transesophageal ekkokardiografi probe i en hjerteintensiv afdeling. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks h, Kirk ES, Vokonas PS, Urschel CV, Sonnenblick EH (1971) udførelse af højre ventrikel under stress: forhold til højre koronarstrøm. J Clin Investere 50: 2176-2183.
- pris LC, urt SJ, Finney SJ, Marino PS, Brett SJ (2010) pulmonal vaskulær og højre ventrikulær dysfunktion i Voksen kritisk pleje: nuværende og nye muligheder for ledelse: en systematisk litteraturgennemgang. Crit Pleje 14: R169. Pfisterer M (2003) højre ventrikulær involvering i myokardieinfarkt og kardiogent shock. Lancet 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) forudsigere for lav hjerteproduktion ved dekompenseret alvorlig hjertesvigt. Klinikker 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) klinisk resultat af akut koronar bypass-podning. J Koreansk Med Sci 22: 270-276.Maganti MD, Rao V, Borger MA, Ivanov J, David te (2005) forudsigere for lavt hjerteudgangssyndrom efter isoleret aortaklaffekirurgi. Cirkulation 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) evaluering af ernæringsmæssige screeningsværktøjer til patienter, der er planlagt til hjertekirurgi. Ernæring 29: 436-442.Hernriuretisk peptid (2013) hæmoglobin og B-type natriuretisk peptid præoperative værdier, men ikke inflammatoriske markører, er forbundet med postoperativ morbiditet i hjertekirurgi: en prospektiv kohortanalytisk undersøgelse. J Cardiothorac Surg 8: 170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) præoperativ total lymfocytantal i perifert blod som en forudsigelse for dårligt resultat i hjerteoperation hos voksne. J Cardiothorac Vasc Anesth 25: 975-980.Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminal Pro-B-type natriuretisk peptidniveauer og tidligt resultat efter hjertekirurgi: en prospektiv kohortestudie. Br J Anaesth 103: 647-653.
- Hutfless R, Casanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) anvendelighed af natriuretisk peptid af B-type til forudsigelse af postoperative komplikationer og resultater hos patienter, der gennemgår hjertekirurgi. J Am Coll Cardiol 43: 1873-1879.Gheorghiade M, Albert NM, Gattis Stough m, Greenberg BH, et al. (2007) forholdet mellem optagelse serumnatriumkoncentration og kliniske resultater hos patienter indlagt på grund af hjertesvigt: en analyse fra Optimer-HF-registreringsdatabasen. Eur Hjerte J 28: 980-988.Abrahams navn er et al. (2005) dødelighed på hospitalet hos patienter med akut dekompenseret hjertesvigt, der kræver intravenøs vasoaktiv medicin: en analyse fra Det nationale register for akut dekompenseret hjertesvigt (ADHÆR). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) teamledelse af patienter med hjertesvigt: en erklæring til sundhedspersonale fra Cardiovascular Nursing Council of the American Heart Association. Cirkulation 102: 2443-24456.Stevenson LV, Perloff JK (1989) den begrænsede pålidelighed af fysiske tegn til estimering af hæmodynamik ved kronisk hjertesvigt. Jama 261: 884-888.
- Nohria et al. (2003) klinisk vurdering identificerer hæmodynamiske profiler, der forudsiger resultater hos patienter indlagt med hjertesvigt. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Svane HJ (1976) medicinsk behandling af akut myokardieinfarkt ved anvendelse af hæmodynamiske undergrupper. N Engl J Med 295: 1356-1362.
- Nohria A, Levis E, Stevenson LV (2002) medicinsk behandling af avanceret hjertesvigt. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) ekkokardiografi i hjertesvigt: applikationer, nytteværdi og nye horisonter. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) ekkokardiografisk evaluering af hæmodynamik hos patienter med dekompenseret systolisk hjertesvigt. Circ Cardiovasc Billeddannelse 4: 220-227.lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) anbefalinger til kvantificering af hjertekammer ved ekkokardiografi hos voksne: en opdatering fra American Society of Echocardiography og European Association of Cardiovascular Imaging. Eur Hjerte J Cardiovasc Billeddannelse 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) Hensigtsmæssighedskriterier for brug af kardiovaskulær billeddannelse ved hjertesvigt: rapport om litteraturgennemgang. Eur Hjerte J Cardiovasc Billeddannelse 16: 147-153.Gimelli a, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) ikke-invasiv hjerteafbildningsevaluering af patienter med kronisk systolisk hjertesvigt: en rapport fra European Association of Cardiovascular Imaging (EACVI). Eur Hjerte J 35: 3417-3425.(2012) vurdering af akut dekompenseret hjertesvigt: strategier og værktøjer. Eur Cardiol 8: 128-133.
- grå a, Goodacre S, Nyby de, Masson M, Sampson F, et al. (2008) ikke-invasiv ventilation ved akut kardiogent lungeødem. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) hæmodynamisk overvågning ved akut hjertesvigt. Crit Pleje Med 36: S40-S43. Pa, afdeling DA, Courtney MD (2009) den intra-aorta ballonpumpe i hjerteinsufficiens: implikationer for sygeplejepraksis. Aust Crit Pleje 22: 125-131.
- Slaughter MS, Singh R (2012) rollen som ventrikulære hjælpeapparater i avanceret hjertesvigt. Revista Espa Kurtola de Cardiologia 65: 982-985. Shah Mr, Hasselblad V, Stinnett SS, Gheorghiade M, Svenberg K, et al. (2001) hæmodynamiske profiler af avanceret hjertesvigt: tilknytning til kliniske egenskaber og langsigtede resultater. J-Kort Mislykkes 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) overlegenhed af dobutamin over dopamin til forøgelse af hjerteudgang hos patienter med kronisk hjertesvigt med lavt output. Cirkulation 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholath H, et al. (2002) effekt og sikkerhed af intravenøs levosimendan sammenlignet med dobutamin ved svær hjertesvigt med lav effekt (LIDO-studiet): et randomiseret dobbeltblindt forsøg. The Lancet 360: 196-202.Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) lav-output, lavgradient aortastenose hos patienter med deprimeret venstre ventrikulær systolisk funktion: den kliniske nytte af dobutaminudfordringen i kateteriseringslaboratoriet. Cirkulation 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) virkninger af levosimendan versus dobutamin på inflammatoriske og apoptotiske veje ved akut dekompenseret kronisk hjertesvigt. Am J Cardiol 98: 102-106.en, Nieminen MS, Packer M, Cohen-Solal A, Kleber et al. (2007) Overlev Efterforskere. Levosimendan vs dobutamin til patienter med akut dekompenseret hjertesvigt: SURVIVE randomiseret forsøg. Jama 297: 1883-1891.Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) calciumsensibilisatoren levosimendan giver overlegne resultater til dobutamin i postoperativt lavt hjerteudgangssyndrom. Revista Espa Kurtola de Cardiolog Kurt (engelsk udgave) 61: 471-479.
- Mullens, Abrahams, Francis GS, Skouri HN, Starling RC, et al. (2008) natriumnitroprussid til avanceret hjertesvigt med lav output. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan versus en intra-aorta ballonpumpe hos hjertepatienter med høj risiko. J Cardiothorac Vasc Anth 26: 596-603. j, Baluja A, Selas S, Otero P, Rial M, et al. (2013) en sammenligning af doubutamin og levosimendan n leverblodstrøm hos patienter med lav hjerteudgangstilstand efter hjertekirurgi: en randomiseret kontrolleret undersøgelse. Anaesth Intensiv Pleje 41: 719-727.
- Colley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) effekt af levosimendan på lavt hjerteudgangssyndrom hos patienter med lav udstødningsfraktion, der gennemgår koronar bypass-podning med kardiopulmonal bypass: LICORN randomiseret klinisk forsøg. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan til hæmodynamisk støtte efter hjertekirurgi. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, mes J, Vang A, et al. (2017) Levosimendan hos patienter med venstre ventrikulær dysfunktion, der gennemgår hjertekirurgi. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondsinsky R, Viiche S, et al. (2018) inotrope midler og vasodilatorstrategier til behandling af kardiogent shock eller lavt hjerteudgangssyndrom. Cochrane Library. 2 : 1-10.