Eche un vistazo a los artículos recientes
Resumen
La insuficiencia cardíaca de bajo rendimiento (LoHF) es una forma poco frecuente de insuficiencia cardíaca (IC), pero que indica una IC muy avanzada. Se asocia con un pronóstico ominoso, así como con una morbilidad y mortalidad sustanciales. Sin embargo, LoHF sigue siendo en gran medida poco investigado. La descripción tradicional de la IC se centraba en la insuficiencia cardíaca congestiva (ICC) marcada por un bajo gasto cardíaco y acompañada de congestión pulmonar/periférica. Este enfoque contribuyó a la subestimación de los pacientes con LoHF que tienen poca o ninguna evidencia de congestión. Además, los pacientes con LoHF no tienen un tratamiento probado y la selección del tratamiento adecuado depende de la fisiopatología individual y de la etiología subyacente. Los pacientes con LoHF tienen etiología y fisiopatología heterogéneas, lo que destaca la importancia de comprender en profundidad sus características clínicas, diagnóstico y manejo clínico, que constituye la base de la presente revisión.
Palabras clave
síndrome cardíaco de bajo rendimiento, insuficiencia cardíaca de bajo rendimiento, estado de bajo rendimiento
Introducción
A pesar de los notables avances en las terapias médicas y quirúrgicas, el manejo eficaz de la insuficiencia cardíaca (IC) sigue planteando desafíos significativos a los proveedores de atención médica. El desafío se refleja en las altas tasas de reingresos hospitalarios relacionados con la IC, junto con el aumento de la mortalidad y la morbilidad . Parte del desafío es una etiología, fisiopatología y presentaciones clínicas muy heterogéneas de diferentes formas de IC, en las que algunas formas de IC tienen una escasez de datos de ensayos clínicos y, por lo tanto, una comprensión limitada. En particular, la descripción tradicional de la IC ha sido casi sinónimo de insuficiencia cardíaca congestiva (ICC), sin embargo, el término ICC excluye a una minoría de pacientes con IC que tienen pocos o ningún síntoma demostrable de congestión pulmonar y/o periférica . La IC de bajo rendimiento (LoHF) también se ha relacionado con un pronóstico ominoso y señales de IC muy avanzada. Además, las diferencias sintomáticas y fisiopatológicas en la ICC y la LoHF apoyan la necesidad de diferentes abordajes de manejo clínico . A pesar de estas diferencias, las terapias tradicionales para la IC se han generalizado a todas las formas de IC, incluidas la ICC y la LoHF, creando una necesidad clínica de comprender la fisiopatología, el diagnóstico y el manejo clínico de la LoHF. En este artículo, agregamos la evidencia publicada sobre la LoHF en términos de epidemiología, etiología, fisiopatología, diagnóstico y manejo clínico. La intención es renovar el conocimiento del estado clínico de la ICL, así como mejorar el manejo clínico de la IC en general.
Definición
La insuficiencia cardíaca es un síndrome clínico complejo marcado por defectos estructurales y / o funcionales del miocardio que conducen a un deterioro del llenado o eyección ventricular . La complejidad del síndrome es evidente en sus clasificaciones heterogéneas: derecha, izquierda o bi-ventricular según la localización del defecto; aguda o crónica según el tiempo de inicio; fracción de eyección conservada, límite o reducida según el estado funcional; gasto bajo o alto en función del gasto cardíaco (OC), y fallo hacia adelante o hacia atrás en función de la dirección del flujo sanguíneo. Cada una de estas clasificaciones es significativa para el diagnóstico y tratamiento de la IC . A pesar de las diversas clasificaciones, el término ICC se ha utilizado tradicionalmente indistintamente con IC, pero no describe suficientemente la ICL debido a varias diferencias sintomáticas y fisiopatológicas.
LoHF, también conocido como CO bajo en IC descompensada aguda, describe una forma de IC de alta agudeza caracterizada por una disminución del CO delantero (índice cardíaco < 2.0 L / min / m2 y presión arterial sistólica < 90 mmHg) e hipoperfusión de órganos terminales con poca o ninguna evidencia de congestión pulmonar . La ICL es distinta de la ICC, que describe la IC caracterizada por una reducción del CO que causa congestión pulmonar y periférica que conduce a disnea y edema periférico, respectivamente . Las directrices de la Sociedad Europea de Cardiología (ESC) de 2005 sobre el diagnóstico y el manejo de la IC sugieren un continuo desde el síndrome de bajo gasto cardíaco (LCOS) hasta la LoHF y el shock cardiogénico. Las guías de la ESC definen el shock cardiogénico como evidencia de perfusión tisular inducida por IC después de la corrección de la precarga caracterizada por PA sistólica < 90 mmHg o una caída de la presión arterial media > 30 mmHg; gasto urinario < 0,5 ml/kg/h; frecuencia del pulso > 60 latidos por minuto (lpm) con o sin evidencia de congestión . Por otro lado, el LCOS es común en pacientes con IC postoperatoria y se define como la necesidad de bomba de balón intraaórtico postoperatorio o soporte inotrópico durante más de 30 minutos en un entorno de atención aguda .
Epidemiología
La prevalencia e incidencia exactas de LoHF en la población general es completamente desconocida. En la actualidad, no hay datos epidemiológicos basados en la población específicos de la LoHF. Los únicos datos disponibles proceden de ensayos clínicos en un solo centro que investigan a una población selecta de pacientes con IC sometidos a cirugía cardíaca. En 1975, Parr et al. realizó la descripción seminal de la entidad clínica de los LCOS y reportó una incidencia de 25% en niños sometidos a cirugía cardíaca basada en la disminución del CO definido como IC < 2,0 L/min/m2. Dos décadas después, Wernovsky et al. se demostró la misma incidencia de LCOS postoperatorios en pacientes que se habían sometido a una operación de cambio arterial que se produjo dentro de las 6-18 horas posteriores a la cirugía. Muchos ensayos clínicos recientes reportan una amplia variación en la prevalencia, de 3,6% (hombres) y 5,9% (mujeres) a 9,1% y 41% y una incidencia de 14,7% . A largo plazo (veinte años): 1990-2009) ensayo clínico prospectivo en el que participaron 25.176 pacientes consecutivos de cirugía de derivación de arteria coronaria (CABG), Algarni et al. se informó que la prevalencia de LCOS postoperatorios disminuyó significativamente del 9,1% (1990-1994) al 2,4% (2005-2009).
Etiología
La etiología de la LoHF es multifactorial. En general, es una consecuencia de una disfunción del ventrículo izquierdo (VI), el ventrículo derecho (VD) o el ventrículo sistólico (anatomía del ventrículo único) y puede incluir disfunción sistólica y/o diastólica, o ambas . Las perturbaciones en el llenado o expulsión ventricular conducen a LoHF, que es una complicación frecuente en pacientes que se han sometido a cirugía cardíaca o están en shock cardiogénico . Puede presentarse como un deterioro agudo en pacientes con IC crónica o puede ser episodio transitorio y reversible con resolución del desencadenante agudo. Es un síndrome clínico considerado la vía final de una multitud de enfermedades que afectan la función cardíaca. No es suficiente hacer un diagnóstico de LoHF, también se debe determinar la causa subyacente o desencadenante y, si es posible, tratar . La Tabla 1 ofrece un resumen de las condiciones que causan un estado de bajo rendimiento en pacientes con IC.
Cuadro 1. Etiología del estado de bajo rendimiento por fisiopatología
|
Mecanismos |
Condiciones causales |
|
Pérdida de contractilidad miocárdica |
Enfermedad arterial coronaria, miocardiopatía, miocarditis, IC crónica descompensada, cirugía postcardiaca, toxinas, nutrición (obesidad)m enfermedades infiltrativas, insuficiencia renal terminal, enfermedad de Chagas o infección por VIH |
|
Deterioro del llenado o expulsión ventricular |
Pericarditis, derrame pericárdico, taponamiento cardíaco, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
La comprensión actual de la fisiopatología de la LoHF se basa en gran medida en la evidencia de ensayos clínicos en pacientes con CRM postoperatorio . El sello patológico es la disminución excesiva de CO acompañada de hipoperfusión de órganos terminales. Fisiológicamente, el corazón funciona como una bomba para distribuir sangre oxigenada en cantidades suficientes para satisfacer las necesidades metabólicas de los tejidos. Dado que las necesidades metabólicas varían en situaciones normales y estresantes, el CO también varía para satisfacer esta demanda dinámica . La fase diastólica del ciclo cardíaco es crítica en los pacientes con LoHF porque es durante la relajación ventricular que se produce el llenado coronario para proporcionar oxigenación miocárdica . La frecuencia cardíaca (FC) también es significativa en la diástole porque la FC demasiado rápida impide que el corazón logre una relajación y perfusión miocárdicas completas. Por lo tanto, la disfunción cardíaca es el resultado de un trastorno cardíaco estructural (anomalía cardíaca residual) o funcional (alteraciones en el llenado o vaciado ventricular, o aumento de la resistencia vascular sistémica ).
Fisiopatológicamente, el CO depende de la FC y del volumen de ictus (SV) (CO = HR * SV). El volumen de carrera, a su vez, es el producto neto de tres variables de circulación interrelacionadas: precarga, poscarga y contractilidad. Si uno o más de estos componentes se ve afectado, se puede desarrollar un estado de bajo gasto cardíaco . Además, estos componentes afectan a las fases sistólica y diastólica del ciclo cardíaco, causando disfunción sistólica del VI/VD y / o disfunción diastólica también conocida como IC con fracción de eyección conservada (Figura 1). Otras afecciones, como la cardiopatía valvular, la hipertensión pulmonar (HP), la disfunción valvular mecánica y la insuficiencia respiratoria, pueden precipitar o agravar el desarrollo de LoHF .
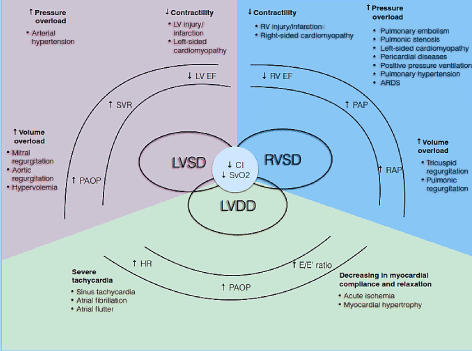
Figura 1. Mecanismos fisiopatológicos de insuficiencia cardíaca de bajo gasto Causas comunes y típicas; se incluyen síntomas de LoHF. El principal mecanismo fisiopatológico de la LoHF es la disfunción ventricular: Disfunción sistólica y / o diastólica del VI y disfunción sistólica del VD, todas las cuales comparten características patológicas comunes de reducción del índice cardíaco (IC) y reducción de la saturación venosa mixta de oxígeno (SvO2). La disfunción sistólica del VI y del VD es el resultado del aumento de la sobrecarga de presión, el aumento de la sobrecarga de volumen y la disminución de la contractilidad, mientras que la disfunción diastólica del VI es el resultado de una taquicardia grave y una disminución del cumplimiento y la relajación miocárdicos. Adaptado de Lomivorotov et al. 2017, p. 293
Disfunción estólica del VI
La disfunción sistólica del ventrículo izquierdo (VI) (o fracción de eyección del VI deprimida ) es el mecanismo fisiopatológico más común observado en pacientes con LoHF. Las variables de circulación que afectan a la función sistólica del VI son precarga, postcarga y contractilidad . Generalmente, la disfunción sistólica del VI es una consecuencia de la pérdida o reducción de cardiomiocitos funcionales como resultado de necrosis por deterioro de la circulación coronaria e isquemia, lesión por reperfusión o el fenómeno natural menos comprendido de la apoptosis de cardiomiocitos . La pérdida de cardiomiocitos funcionales puede ser transitoria como se observa durante el aturdimiento miocárdico definido como un miocardio viable rescatado por reperfusión coronaria, que presenta disfunción postisquémica prolongada después de la reperfusión . La pérdida de cardiomiocitos funcionales también puede ser refractaria a la reversión en condiciones como infección; taquicardia; enfermedad valvular; trastornos metabólicos como acidosis, hipoglucemia, hipocalcemia; exposición a toxinas y productos químicos cardíacos ambientales; miocardiopatía dilatada idiopática (MCD); y trastornos genéticos como MCD familiar, miocardiopatía hipertrófica y distrofias musculares . La respuesta cardíaca alterada a la precarga causa una disminución dramática en el suministro de CO y oxígeno a otros órganos clave del cuerpo, presión auricular elevada, presión de cuña capilar y edema pulmonar cardiogénico. Aunque los cambios compensatorios en el VI se adapten a la presión arterial sistémica relativamente alta, el aumento significativo de la poscarga puede inducir disfunción sistólica del VI .
Disfunción diastólica del VI
Aunque es poco frecuente, la FOH puede desarrollarse en pacientes con disfunción diastólica del VI con FEVI conservada. La condición es el resultado de la incapacidad de la cámara ventricular para llenarse con un volumen adecuado de sangre a pesar de la precarga normal, lo que se presenta como disfunción diastólica . Las condiciones subyacentes, como taquicardia severa, disminución de la compliance miocárdica o relajación ventricular anormal, afectan la relajación y el llenado del VI durante la fase diástole del ciclo cardíaco. A nivel de los cardiomiocitos, estas condiciones están asociadas con la eliminación de calcio del citosol y la homeostasis del calcio, la adecuación del desprendimiento de puente cruzado y el trastorno funcional intrínseco del elemento citoesquelético . El desprendimiento de puente cruzado puede contribuir a retrasar el tiempo de relajación isovolúmica, lo que resulta en una disminución del volumen de ictus del VI, especialmente a una FC más alta . La relajación del VI también depende de la recaptación de iones de calcio reticular sarcoplásmico y de la señalización de óxido nítrico, que también facilitan el desprendimiento de puentes cruzados. Dado que el proceso de desprendimiento de puente cruzado consume energía, puede causar un déficit de energía miocárdica y, en consecuencia, ralentizar la relajación miocárdica del VI .
A pesar de que la disfunción diastólica es un fenómeno generalizado que se observa en hasta el 70% de los pacientes cardíacos postoperatorios , la disfunción diastólica por sí sola es insuficiente para explicar el desarrollo de IC aguda. En el contexto de otras afecciones clínicas, como la fibrilación auricular (FA), el deterioro de la circulación coronaria y la hipertensión arterial, la disfunción diastólica puede provocar un estado descompensado y, por lo tanto, se cree que es un signo temprano de isquemia miocárdica . La relación dinámica entre las funciones diastólica y sistólica del VI también contribuye a la disfunción diastólica en pacientes con ICL. La estimulación de la catecolamina inotrópica afecta tanto a la diástole como a la sístole, y puede mejorar la disfunción diastólica. La FEVI deprimida conduce a un aumento del volumen sistólico final y prolonga la fase diastólica del ciclo cardíaco .
Disfunción del VD
En la LoHF, particularmente después de la cirugía de la arteria coronaria, los principales mecanismos fisiopatológicos de la disfunción del VD incluyen aumento de la precarga, aumento de la poscarga, deterioro de la perfusión de la arteria coronaria derecha y disminución de la contractilidad . A diferencia de la arteria coronaria izquierda, la perfusión de la arteria coronaria derecha ocurre durante la diástole y la sístole. La presencia de PH provoca un aumento de la presión del VD que conduce a una disminución de la perfusión de la arteria coronaria derecha, lo que explica la importancia de proporcionar una circulación coronaria izquierda y derecha óptima . En los pacientes que se han sometido a cirugía de arteria coronaria, la disfunción del VD puede desarrollarse como resultado de una combinación de mecanismos. La isquemia e infarto perioperatorios del VD son las principales causas de deterioro de la contractilidad del VD. La regurgitación tricúspide o pulmonar es causas comunes de aumento de la precarga de volumen, mientras que la enfermedad valvular del lado izquierdo o la cardiomiopatía, el PH o la embolia pulmonar (EP), el síndrome de dificultad respiratoria aguda y la ventilación con alta presión positiva son causas comunes de sobrecarga de presión . Dado que el VD normalmente permite la perfusión a baja presión de la vasculatura pulmonar, es altamente sensible incluso a aumentos moderados de la presión arterial pulmonar (PAP). El fracaso del VD puede desarrollarse en el entorno de PH o contractilidad deteriorada asociada con una progresión rápida de la dilatación del VD que conduce a un aumento de la presión diastólica final del VD . Estas alteraciones fisiológicas pueden provocar un desplazamiento del tabique interventricular hacia una cámara ventricular izquierda ya llena y, en consecuencia, una reducción de la precarga del VI y una disminución del CO .
Factores de riesgo
Los factores de riesgo para la LoHF siguen siendo un área poco investigada. Sin embargo, los pocos datos disponibles de ensayos clínicos sobre IC y de pacientes con LCOS postoperatorios proporcionan información valiosa sobre los factores de riesgo y los predictores de la LoHF. En el análisis de 452 pacientes hospitalizados con IC descompensada y bajo gasto cardíaco, los factores de riesgo significativos para ICL fueron enfermedad de Chagas (riesgo relativo : 3,66), fracción de eyección deprimida (RR: 2,41), hiponatremia (RR: 1,62) y disfunción renal (RR: 1,92) . Los factores de riesgo para la LoHF postoperatoria incluyen deterioro de la función del VI (< 50%), CABG con bomba, cirugía de emergencia o de bypass cardiopulmonar (BPC), revascularización incompleta, edad > 65 años, y una presencia combinada de diabetes mellitus y disfunción renal preoperatoria . Además de los factores de riesgo para el paciente y la operación, los predictores bioquímicos de LoHF en pacientes postoperatorios son niveles bajos de hemoglobina , recuento total de linfocitos < 2000 células/µL y niveles preoperatorios de péptidos natriuréticos séricos . En las últimas dos décadas, se han producido cambios en las tendencias de algunos factores de riesgo reconocidos. Factores como la hipertensión, el sexo femenino, la enfermedad de los vasos triples y la enfermedad del tronco común izquierdo ya no son estadísticamente significativos, mientras que el riesgo asociado con la fracción de eyección preoperatoria deprimida se ha duplicado .
Diagnóstico
No hay directrices consensuadas ni criterios diagnósticos comprobados para los pacientes con LoHF. Además, los signos y síntomas clínicos no son específicos. En ausencia de guías estandarizadas, el diagnóstico generalmente se basa en una colección aceptada de aberraciones hemodinámicas y fisiológicas útiles para elevar la sospecha clínica de LoHF . Diagnóstico de LoHF solo no es suficiente. También hay que determinar la causa del estado de baja producción. En algunas causas de estado de bajo rendimiento, como la EP o el IM, el tratamiento de la causa subyacente es la consideración más importante y, por lo tanto, es imperativo hacer el diagnóstico. Dado que los pacientes con LoHF a menudo son inestables, también es común que la evaluación clínica, el diagnóstico y el tratamiento se realicen simultáneamente, más en entornos de atención aguda .
Signos y síntomas
El bajo gasto cardiaco como característica de presentación de la IC descompensada aguda es poco frecuente, afectando apenas al 8,9 a 9,6% de los pacientes hospitalizados con IC . La LoHF puede compartir muchas características clínicas con la ICC, pero hay diferencias notables que pueden apoyar u orientar las decisiones diagnósticas posteriores. La fatiga excesiva y el aumento de la intolerancia al ejercicio son signos iniciales importantes que notan los pacientes con LoHF incluso antes del diagnóstico . Además, los pacientes con LoHF presentan con frecuencia agitación, confusión y/o disminución de los niveles de consciencia; periféricas frías/vasoconstrictas o retraso del tiempo de recarga capilar; hipotensión; taquicardia o bradicardia; pulso filiforme; presión venosa yugular elevada; dificultad para respirar e hipoxemia; y oliguria/anuria . Estos signos y síntomas pueden diferir entre baja perfusión y congestión en pacientes con IC (Tabla 2).
Cuadro 2. Los síntomas y signos de perfusión baja vs congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Las directrices de la ESC de 2016 sobre diagnóstico y manejo de la IC enfatizan la importancia de obtener una historia clínica detallada y un examen físico de todos los pacientes con sospecha de IC . La historia clínica detallada del paciente, o de familiares y amigos si el paciente se encuentra demasiado enfermo, debe centrarse en obtener información sobre los síntomas, las condiciones cardíacas y extrac corazón anteriores y actuales capaces de precipitar o agravar la IC, la exposición a factores de riesgo de IC o de estado de bajo rendimiento, y la historia clínica de medicamentos para condiciones médicas anteriores y actuales . Además de la historia clínica del paciente, se recomienda un examen físico a todos los pacientes con LoHF para evaluar los indicadores clínicos de hemodinámica, perfusión periférica, congestión, etiología subyacente y patología valvular. Los parámetros hemodinámicos de interés incluyen presión arterial, FC y ritmo cardíaco, ritmo al galope, saturación de oxígeno y frecuencia respiratoria . Las pruebas de perfusión periférica deben incluir los niveles de conciencia, la temperatura periférica de la piel/central, el tiempo de recarga capilar y la producción de orina. Las pruebas de congestión incluyen presión venosa yugular elevada, edema periférico / pulmonar, hepatomegalia, ascitis y derrames pleurales. Las pruebas para la etiología subyacente deben incorporar examen cardiovascular, y sonido y soplos cardíacos. Por último, la evidencia de disfunción valvular debe incluir el frote pericárdico y la evidencia de derrame pericárdico con taponamiento cardíaco o sin él .
La combinación de la historia clínica del paciente y el examen físico ha demostrado ser invaluable en la evaluación del estado hemodinámico y el reconocimiento de la LoHF . En 1976, Forrester et al. se realizó un examen físico de los pacientes con infarto agudo de miocardio y se identificaron cuatro perfiles hemodinámicos (A, B, L y C), como se ilustra en la Figura 2. Los perfiles hemodinámicos se basan en la presencia o ausencia de congestión pulmonar (presión de cuña capilar pulmonar > o ≤ 18 mmHg) y la adecuación de la perfusión (IC > 2,2 L/min/m2). El perfil A representa no congestión / hipoperfusión; el Perfil B congestión sin hipoperfusión; el Perfil C hipoperfusión sin congestión; y el Perfil L congestión e hipoperfusión . Los pacientes con LoHF pertenecen a los perfiles L y C (hipoperfusión ± congestión basada en Nohria et al. demostración de que los perfiles L y C tienen un IC medio de 1,6 L/min/m2 y 1,9 L/min/m2, respectivamente.
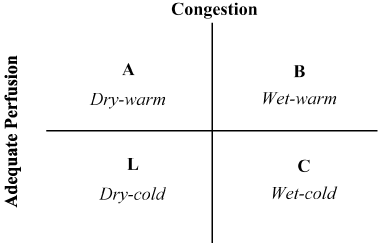
Figura 2. La presentación esquemática del perfil clínico de la congestión de insuficiencia cardíaca descompensada aguda se evalúa por la presencia de ortopnea, distensión venosa yugular, estertores pulmonares, reflujo hepatoyugular, ascitis, edema periférico, reflujo abdominal y onda cuadrada de Valsalva. La baja perfusión se evaluó por la presencia de presión de pulso estrecha, alteraciones del pulso, extremidades frías, tal vez sueño, disminución de los niveles séricos de sodio y empeoramiento de la función renal. Adaptado de Nohria, et al.
Electrocardiograma (ECG): Las guías de AHA y ESC sobre IC recomiendan que se realice el electrocardiograma (ECG) lo antes posible en todos los pacientes sospechosos de IC. El ECG puede demostrar una variedad de anomalías y es muy poco probable que sea normal en pacientes con IC. También puede proporcionar evidencia de una etiología subyacente de disfunción cardíaca que incluye bradicardia, bloqueo auriculoventricular, taquicardia sinusal, taquiarritmia auricular o ventricular, isquemia, hipertrofia del VI y complejos de baja tensión .
Pruebas de laboratorio básicas: Las guías de IC de AHA y ESC también recomiendan pruebas de laboratorio básicas en la evaluación clínica inicial para apoyar el diagnóstico de IC o de la causa del estado de bajo rendimiento. Se deben realizar análisis de sangre en todos los pacientes con sospecha de IC. Hemoglobina (Hb > 10 g / dL) indica un suministro óptimo de oxígeno a los tejidos), la anemia crónica es común en la IC crónica y el marcado aumento de los glóbulos blancos hace sospechar un diagnóstico alternativo. Pruebas de electrolitos séricos para determinar los niveles de potasio, magnesio y calcio. Pruebas de urea y creatinina para evaluar la hipoperfusión renal y la disfunción frecuentes en la IC. Pruebas para la función hepática alterada, que sugieren alteración del VD y/o congestión hepática. Prueba de glucosa para determinar si hay hipoglucemia que pueda alterar la función cardíaca. Pruebas de función tiroidea para detectar hipotiroidismo o hipertiroidismo que pueden causar infarto de miocardio intrínseco. Por último, las pruebas de péptidos natriuréticos séricos cuyos niveles elevados indican un aumento del estrés de la pared ventricular, pero que no detectan cambios bruscos en las presiones de llenado ventricular debido a su larga vida media .Pruebas de imagen cardíaca: La imagen cardíaca desempeña un papel central en el diagnóstico de la IC, así como en el monitoreo y la guía de la terapia. La ecocardiografía es la modalidad preferida por razones de precisión, disponibilidad, seguridad y rentabilidad . Puede complementarse con otras modalidades de diagnóstico por imágenes seleccionadas en función de la capacidad de responder preguntas clínicas específicas mientras se consideran las contraindicaciones y los riesgos .Ecocardiografía: La ecocardiografía es muy recomendable para todos los pacientes sospechosos debido a su capacidad para confirmar o excluir el diagnóstico clínico de LoHF, para evaluar el VS y sus variaciones, y para determinar la causa del estado de bajo gasto . La ecocardiografía transtorácica debe realizarse lo antes posible tras el diagnóstico clínico de bajo gasto cardiaco. No solo mide el alcance de la disfunción sistólica y diastólica, sino que también proporciona información valiosa sobre la morfología ventricular, la disfunción valvular, la enfermedad miocárdica y pericárdica y las anomalías de movimiento de la pared regional . La ecocardiografía evalúa la función sistólica midiendo el FEVC, donde > 45-50% se considera normal. Por otro lado, la función diastólica se evalúa utilizando patrones de flujo mitral, flujo venoso pulmonar y Doppler tisular en el anillo mitral, mientras que el CO y el SV se evalúan utilizando el principio Doppler. La presión arterial pulmonar (PAP) se puede estimar midiendo la velocidad del chorro de regurgitación. PAP alta en presencia de VD dilatado con aplanamiento septal o inclinación hacia el VI, lo que indica un aumento agudo de la presión del VD, lo que aumenta la sospecha clínica de DP como causa del estado de bajo rendimiento .Radiografía de tórax: Se podría considerar la radiografía de tórax en pacientes con sospecha de FoHL. Indicadores importantes que deben considerarse para su evaluación incluyen agrandamiento del corazón que indica cardiomegalia o hipertrofia del VI; congestión venosa pulmonar que indica presión de llenado del VI elevada; derrame pleural que indica presión del VI elevada, embolia pulmonar o cirugía postcardiaca( .
Coronariografía: Las indicaciones para la coronariografía en pacientes con ICL deben estar en concordancia con la recomendación de las guías de consenso pertinentes para la IC . En pacientes con IC que presenten dolor torácico y evidencia de infarto de miocardio con elevación del segmento ST (IAMCEST) en el ECG, la revascularización mediante intervención coronaria percutánea primaria debe realizarse lo antes posible. La coronariografía también debe considerarse en pacientes con paro cardiaco posterior a la etiología isquémica, cuando hay evidencia de IC y en pacientes que se han recuperado del estado de bajo gasto cuando no se ha determinado la causa .
Manejo clínico
La presencia de LoHF representa una afección de riesgo muy alto que requiere tratamiento inmediato, pero carece de directrices estandarizadas para el manejo clínico . En consecuencia, los médicos normalmente consideran la fisiopatología individual para seleccionar la estrategia de tratamiento más adecuada . En los pacientes con ICL aguda, las guías de IC de la ESC de 2016 recomiendan el uso de perfiles hemodinámicos (basados en la presencia o ausencia de congestión y la adecuación de la perfusión) para guiar el manejo clínico . Para los pacientes con LoHF de Perfil L (sin congestión pero con hipoperfusión) y Perfil C (congestión e hipoperfusión) que se encuentran en estado de descompensación aguda, los objetivos de tratamiento de emergencia pueden incluir resucitar a los pacientes, restaurar la oxigenación, mejorar la perfusión de órganos y optimizar la hemodinámica (volumen de ictus y CO), y resolver los síntomas. Otros objetivos posteriores incluyen el monitoreo óptimo y el establecimiento de la causa subyacente del bajo gasto cardíaco y el tratamiento de la causa si es reversible . En la actualidad, las dianas terapéuticas disponibles para la LoHF optimizan la oxigenación de los tejidos, estabilizan la circulación y tratan las causas reversibles de estado de bajo rendimiento (Figura 3).
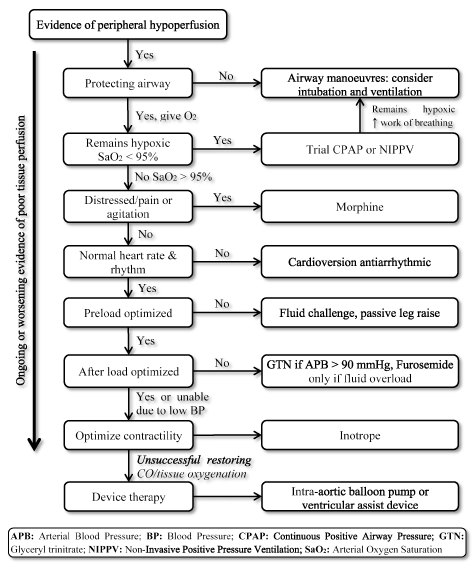
Figura 3. Algoritmo de tratamiento para insuficiencia cardíaca de bajo rendimiento Tratamiento de objetivos LoHF que mejoran la oxigenación tisular y estabilizan la circulación en función de los síntomas de perfusión tisular en curso o que empeoran. El tratamiento comienza mejorando la ventilación mediante el suministro de oxígeno de alto flujo, presión positiva continua en las vías respiratorias (CPAP, por sus siglas en inglés) o ventilación con presión positiva no invasiva (NIPPV, por sus siglas en inglés). Si no tiene éxito, se administran fármacos cardioversivos o antiarrítmicos para normalizar la frecuencia cardíaca, desafío de líquidos para optimizar la precarga y/o vasodilatadores e inotrópicos para manipular y mejorar la contractilidad, respectivamente. Si la ventilación y la medicación previas no logran restaurar el gasto cardíaco y/o la oxigenación tisular, se puede considerar la terapia con dispositivos que utilizan bomba de balón intraaórtico o dispositivos de asistencia ventricular
Optimizar la oxigenación tisular (estrategias ventilatorias)
El manejo clínico de los pacientes con LoHF a menudo comienza con la evaluación de las vías respiratorias, la respiración y la circulación para detectar evidencia de hipoperfusión periférica. Las estrategias de ventilación mecánica, como las vías respiratorias orofaríngeas o nasofaríngeas, son complementos comunes que se usan para restaurar o mantener la permeabilidad de las vías respiratorias en pacientes con LoHF con disminución de los niveles de conciencia debido a la disminución de la perfusión cerebral. Se debe considerar la intubación endotraqueal adicional si el paciente sigue teniendo las vías respiratorias comprometidas . Si los pacientes siguen siendo hipóxicos (SaO2 < 95%), se puede considerar la maximización del suministro de oxígeno utilizando oxígeno de alto flujo, presión positiva continua en las vías respiratorias (CPAP) o ventilación con presión positiva no invasiva (NIPPV). En pacientes sin mejoría, se puede considerar la intubación o ventilación .
Estabilizar la circulación
El gasto cardíaco (CO) es una función de la FC y el VS. A su vez, la VS depende de cuatro variables de circulación: frecuencia cardíaca, precarga, contractilidad y postcarga. La optimización de todas estas variables mejorará el CO en los pacientes con FoHL . En el entorno clínico, las estrategias para aumentar el CO dependen de la causa subyacente y de la variable de circulación afectada . Las intervenciones clínicas incluyen ajuste de volumen, apoyo farmacológico y terapia con dispositivos.
Frecuencia / Ritmo cardíaco: Como parte de la respuesta fisiológica del cuerpo, el aumento de la FC aumenta el CO. La HR demasiado rápida o lenta tiene un efecto perjudicial sobre el CO. En pacientes con LoHF con taquicardia (FC en reposo demasiado rápido > 100 lpm) que están angustiados, inquietos y disneicos, se puede administrar morfina para aliviar la disnea, el dolor y la agitación, así como es un venodilatador leve para reducir la poscarga, especialmente en pacientes con CPAP o NIPPV . Si la FC < 40 lpm con evidencia de compromiso hemodinámico y/o deterioro del CO, se deben realizar medicamentos que aumenten la FC (atropina y anticolinérgicos ) o intervenciones como estimulación transcutánea/transvenosa. Se debe considerar la cardioversión eléctrica urgente en una LoHF seleccionada con taquicardia ventricular / supraventricular o FA rápida con evidencia de compromiso cardiovascular .
Optimizar la precarga( Ajustes de volumen): La medición de la precarga es esencial para su optimización. Se recomienda en pacientes con evidencia clínica de alteración de la perfusión periférica. Se debe realizar un desafío de fluidos para evaluar la capacidad de respuesta de la precarga. Perfusión rápida de 250 ml de líquido (cristaloide o coloide) durante más de cinco minutos y evaluación objetiva del efecto sobre el SV. Si el efecto es un aumento o una disminución > 10%, el paciente debe seguir recibiendo bolos de líquido para optimizar la precarga hasta que deje de responder a los líquidos . Para los pacientes con signos de congestión y edema pulmonar que no requieren bolo de líquido, se puede hacer un levantamiento pasivo de la pierna, levantando la pierna del paciente a 45 grados para excluir la necesidad de desafío de líquidos. Si la respuesta es favorable, se puede dar un verdadero desafío de fluidos .
Manipular la poscarga( Soporte farmacológico): La poscarga es la resistencia contra la que el ventrículo está expulsando sangre, a veces estimada como RVS. Se debe reducir la poscarga en pacientes con LoHF que presenten una poscarga alta, CO bajo, evidencia de perfusión periférica deficiente y edema pulmonar. Se debe dar apoyo farmacológico con vasodilatadores a los pacientes con FoHL con PA sistólica ≥110 mmHg. En pacientes con PA sistólica < 90 mmHg y presión arterial media < 65 mmHg, no se recomiendan vasodilatadores debido al riesgo de hipotensión, que puede complicar la perfusión de órganos. En estos pacientes, se recomienda usar inotrópicos como primera línea de tratamiento .
Mejorar la contractilidad (Soporte farmacológico): Si el paciente persiste con evidencia de hipoperfusión tisular o reducción del suministro de oxígeno a pesar de las intervenciones para la frecuencia cardíaca, precarga y poscarga, se debe considerar el tratamiento para mejorar la contractilidad. Mientras tanto, se debe continuar optimizando el suministro de oxígeno para alcanzar una hemoglobina ≥10 g/dl y garantizar saturaciones de oxígeno óptimas (SaO2). Los factores que afectan negativamente a la contractilidad miocárdica son hiperpotasemia, hipomagnesemia, hipocalcemia, acidosis grave, hipoxia e hipoglucemia, que deben corregirse. Se recomiendan inotrópicos para mejorar la contractilidad y, posteriormente, el CO en pacientes con LoHF con PA baja y / o IC bajo en presencia de signos de perfusión periférica deficiente o congestión . Sin embargo, el apoyo farmacológico con Dobutamina (un inótropo) debe utilizarse con precaución en pacientes con taquicardia o FA, ya que aumenta la conducción del ganglio AV y puede precipitar ritmos ventriculares rápidos . Por otro lado, el levosimendán se recomienda en pacientes con LoHF con isquemia miocárdica aguda o post cirugía cardíaca, ya que no aumenta la demanda de oxígeno miocárdico . El efecto a largo plazo de los inotrópicos podría ser perjudicial y, por lo tanto, su uso debe detenerse una vez que se haya logrado la estabilidad. Los vasopresores no deben ser el medicamento de primera línea en estados de bajo rendimiento, ya que aumentan la RVS y, posteriormente, deterioran el CO. Sin embargo, se recomienda una terapia dual de vasopresores e inotrópicos en pacientes con sepsis como la causa subyacente del estado de bajo rendimiento .
Terapia con dispositivos: Se debe considerar la terapia con dispositivos en pacientes con LoHF cuando las terapias médicas óptimas no han logrado restaurar el CO y la oxigenación tisular. Las terapias con dispositivos comunes incluyen la bomba de balón intraaórtico (BIA) y el dispositivo de asistencia ventricular (DAV). El uso de BIA es común en pacientes con FOHL con cardiopatía isquémica, intervención percutánea previa o posterior o cirugía cardíaca posterior. El BIA se compone de un balón insertado en la aorta a través de la arteria femoral. El balón se infla durante la diástole y se desinfla durante la sístole para aumentar la PA diastólica y, en consecuencia, la perfusión coronaria, y reduce la poscarga, aumentando así el CO . Por otro lado, el uso de DAV es poco común. Solo se puede utilizar en centros especializados. Se utiliza comúnmente como puente para el trasplante cardíaco en pacientes con calidad de vida favorable o para la recuperación en pacientes con miocarditis aguda .
Tratamiento de las causas subyacentes
Algunas causas de estado de bajo rendimiento en pacientes con LoHF se pueden revertir con terapias específicas. Las causas reversibles deben identificarse al principio de la evaluación clínica inicial. Estas causas incluyen infarto agudo de miocardio, taponamiento cardíaco, neumotórax a tensión, embolia pulmonar y falla valvular aguda . (Cuadro 3).
Meta-análisis del diagnóstico y manejo clínico
La base del diagnóstico clínico de LoHF ha sido la evidencia ecocardiográfica de disfunción sistólica del VI/VD y / o disfunción diastólica del VI acompañada de evidencia de reducción de CO y SvO2 . Se han utilizado perfiles hemodinámicos basados en medidas de congestión y perfusión para clasificar a los pacientes con IC aguda en cuatro perfiles: seco-cálido (A), húmedo-cálido (B), seco-frío (L) y húmedo-frío (C), útiles para identificar a los pacientes con ICL . Los pacientes con LoHF se clasificaron en perfiles (L) y (C) en función de la presencia/ausencia de congestión y/o la insuficiencia de la perfusión periférica . Estos dos perfiles hemodinámicos han constituido la base para seleccionar a los pacientes con LoHF en los ensayos clínicos, además de proporcionar una evaluación sencilla de la cabecera para ayudar a clasificar a los pacientes en el momento de la presentación y guiar la selección de terapias iniciales . El objetivo del presente metanálisis es agregar las pruebas publicadas de las características diagnósticas comunes y los resultados del tratamiento para los pacientes con FoHL.
Estrategia de búsqueda
Se realizaron búsquedas sistemáticas en tres bases de datos en línea principales (PubMed, EMBASE y Cochrane) desde su creación hasta diciembre de 2018 para buscar estudios que investigaran el diagnóstico y el manejo clínico de la LoHF. Para evitar pasar por alto los estudios que no mencionaban LoHF en el título o el resumen, se incluyeron los primeros 200 artículos clasificados por relevancia recuperados con una búsqueda de texto completo en Google Scholar. No se aplicaron restricciones de tiempo de publicación ni de idioma. Se identificaron estudios adicionales a través de una búsqueda manual de la lista de referencias de los estudios incluidos, así como de los artículos de revisión relevantes, que luego fueron sometidos a los criterios de inclusión. Los criterios de búsqueda incluyeron población de interés( pacientes con LoHF o LCOS), pruebas diagnósticas de interés (ecocardiografía y perfiles hemodinámicos) e intervención de interés (estrategias ventilatorias, ajuste de volumen, soporte farmacológico y terapia con dispositivos). Se incluyeron estudios si cumplían los siguientes criterios: (a) pacientes incluidos con LoHF; (b) diagnosticado mediante ecocardiografía y perfiles hemodinámicos; (c) pacientes tratados para estabilización hemodinámica; y (d) resultados del tratamiento notificados. En los casos de estudios que notificaron datos duplicados, solo se incluyó el estudio que proporcionó el mayor número de pacientes. Se excluyeron resúmenes de conferencias, informes de casos y artículos de revisión.
Selección del estudio
La Figura 4 ilustra el proceso de búsqueda y selección utilizado para incluir los estudios elegibles. Dos revisores examinaron de forma independiente todos los títulos y resúmenes recuperados de la búsqueda sistemática en línea. Se incluyeron resúmenes que incluían población, intervención y resultados de interés para la búsqueda de texto completo. Posteriormente, los dos revisores también revisaron de forma independiente los artículos de texto completo en función de los criterios de inclusión. En los casos de discrepancia, se resuelve mediante el debate y el consenso.

Figura 4. Diagrama de flujo del proceso de búsqueda e inclusión de literatura
Recolección de datos
Dos revisores extrajeron de forma independiente los datos de los estudios incluidos y cualquier discrepancia se resolvió por consenso. Los principales datos extraídos fueron los datos del perfil ecocardiográfico y hemodinámico, el tratamiento utilizado y el resultado del tratamiento en hemodinámica (índice cardíaco, PCWP) y mortalidad. Además de estos datos principales, los dos revisores también extrajeron datos sobre las características del estudio, las características de los pacientes y la duración del seguimiento (Tabla 4).
Análisis estadístico
Los resultados de interés reportados en más de un estudio son índice cardíaco, PCWP y mortalidad. Para cada resultado, se extrajeron estadísticas sumarias (media ± desviación estándar) antes y después de la intervención o la diferencia entre el valor basal y después del tratamiento. Estas estadísticas de resumen se extrajeron por separado para los grupos de tratamiento y de control/placebo. Los resultados diagnósticos y los efectos del tratamiento se midieron mediante la diferencia de medias antes y después de la intervención y el intervalo de confianza del 95% asociado. Se utilizaron parcelas forestales para examinar visualmente la heterogeneidad (I2) en todos los estudios. El efecto combinado de diagnóstico y tratamiento y el intervalo de confianza del 95% asociado se estimaron utilizando un modelo de efecto fijo (I2 < 49%) o de efecto aleatorio (I2 > 50%). El valor de P > 0,05 se consideró estadísticamente significativo.
Resultados
Características del estudio
Doce (12) ensayos controlados aleatorios (ECA) cumplieron los criterios de inclusión. Siete (7) ensayos reclutaron pacientes con LoHF y los cinco (5) restantes reclutaron pacientes con IC sometidos a cirugía cardíaca con bajo gasto cardíaco. La mayoría de los ensayos clínicos publicados (10) investigaron medicamentos comparando el efecto de diferentes tipos de inotrópicos sobre la hemodinámica y la prevención de la muerte: solo dobutamina , dobutamina y dopamina ; levosimendán y dobutamina , y levosimendán y placebo . De los dos ensayos clínicos restantes, cada uno investigó vasodilatador (nitroprusiato) y placebo , y terapia con dispositivos (IBP) e inotrópico (levosimendán) solos o en combinación con IBP . En total, los 12 ensayos clínicos incluyeron a 3.738 pacientes, de edad media de 64 años (intervalo = 55-74 años), la mayoría de los cuales eran hombres (78%).
Síntesis de resultados
Los datos de diagnóstico de la LoHF fueron inconsistentes. En los doce ensayos clínicos, no surgió una definición común de LoHF que hubiera sido útil para guiar el diagnóstico. Hemodinámica criterios utilizados para la inclusión de pacientes en los ensayos incluidos CI < 2,0 L/min/m2 , CI < 2.2 L/min/m2 o CI < 2,5 L/min/m2 y PCPE > 15 mmHg o ≥18 mmHg . La definición también varió entre los estudios: condición postoperatoria con hipotensión (PA sistólica < 90 mmHg para > 30 minutos) o la necesidad de soporte inotrópico para mantener la PA sistólica > 90 mmHg e hipoperfusión de órganos terminales (periféricas frías,< 30 ml/hora) . El shock cardiogénico ha sido descrito como un síndrome complejo que involucra una cascada de disfunción aguda del VI, disminución del CO, hipotensión e hipoperfusión tisular .
Las figuras 5 y 6 muestran las gráficas forestales para la media estandarizada del índice cardíaco al inicio y después de la terapia inotrópica o vasodilatadora, respectivamente. El índice cardíaco basal aumentó de una media de 1,93 (IC del 95%: 1,91-1,95) a una media después del tratamiento de 2,82 (IC del 95%: 2,80-2,84). La figura 7 muestra una gráfica de bosque para la diferencia media estándar (DME) del índice cardíaco después del tratamiento con levosimendán y dobutamina. El levosimendán alcanza un índice cardíaco más alto en comparación con la dobutamina (DME: 2,82; IC del 95%: 2,54-3,10). Como profiláctico frente a la LoHF en pacientes postoperatorios, la perfusión de levosimendán tras la anestesia alcanzó un índice cardíaco más alto (2,57) en comparación con el BIA preoperatorio (2,3) o con una combinación de levosimendán (2,4). La Figura 8 muestra una gráfica forestal de la tasa de mortalidad entre levosimendán y placebo. El levosimendán tuvo una tasa de mortalidad más baja en comparación con el placebo (Odds Ratio : 0,83; IC del 95%: 0,59-1,18), pero la diferencia no fue estadísticamente significativa (p=0,30). Finalmente, la Figura 9 muestra además que el levosimendán tiene una tasa de mortalidad más baja en comparación con la dobutamina (OR: 0,65; IC del 95%: 0,39-1).08) but the difference was not statistically significant (p=0.10).
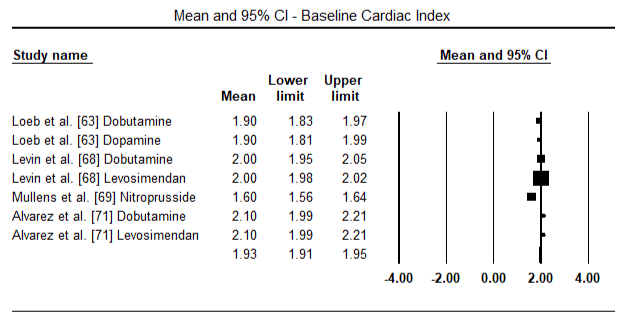
Figure 5. Mean baseline cardiac index
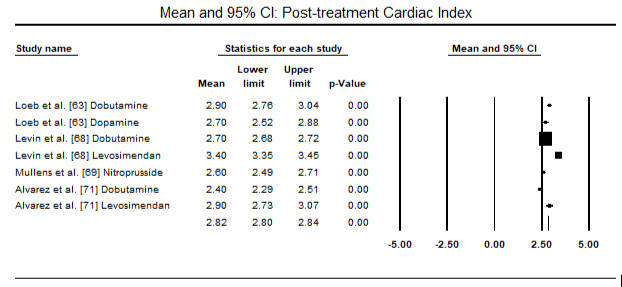
Figure 6. Mean post-treatment cardiac index
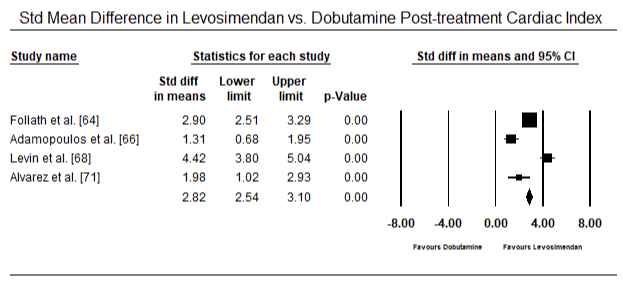
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
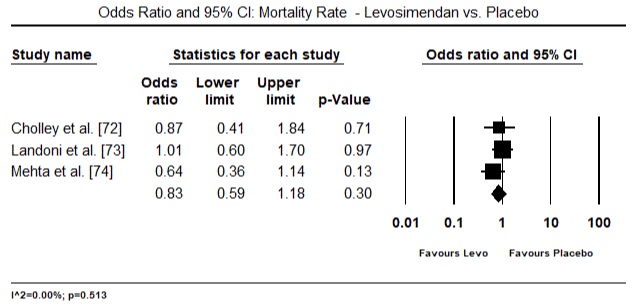
Figure 8. Mortality rate between levosimendan and placebo
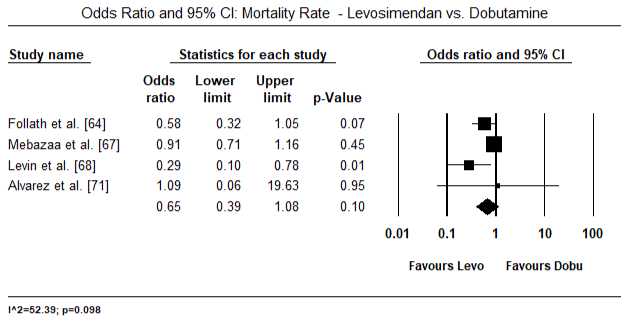
Figure 9. Tasa de mortalidad entre levosimendán y dobutamina
Discusión de los hallazgos
En esta revisión sistemática y metanálisis se evaluaron las características diagnósticas comunes y los resultados del tratamiento de la terapia médica y con dispositivos (BIA) en pacientes con FoHL. Los resultados indican que los pacientes con LoHF carecen de características diagnósticas ampliamente aceptadas o estandarizadas. Aunque los pacientes con LoHF podrían presentar varias características, como índice cardíaco, PCWP, PA sistólica y SvO2, para sugerir o apoyar el diagnóstico clínico, todas estas características tienen valores de corte diferentes en los estudios. El índice cardíaco, que es la característica clínica más común que demuestra el estado de bajo rendimiento en LoHF, tiene tres valores de corte: < 2,0 L/min/m2 , < 2,2 L/min/m2 o < 2,5 L/min/m2 . El soporte inotrópico surgió como una intervención muy común para mejorar la perfusión y normalizar el gasto cardíaco en pacientes con LoHF.
La medicación inotrópica como levosimendán, dobutamina, dopamina, vasodilatador (nitroprusiato) y BIA mejoró significativamente el IC entre el inicio y el post-tratamiento. En términos de inotrópicos, el levosimendán es más eficaz para mejorar la estabilidad hemodinámica y un mejor profiláctico contra la muerte a corto plazo (mortalidad a 30 días) que la dobutamina. Además, los inotrópicos pueden actuar como profilácticos contra el desarrollo de LoHF postoperatorio. Por otro lado, aunque los inotrópicos mejoran la hemodinámica y normalizan el gasto cardíaco, no proporcionan una protección significativamente mejor contra la mortalidad, independientemente del tipo de inotrópico utilizado.
El papel de los inotrópicos en el tratamiento de la LoHF ha sido respaldado por una revisión previa de agentes inotrópicos y estrategias vasodilatadoras para el tratamiento del shock cardiogénico y los LCOS . La revisión reportó que los inotrópicos mejoran la hemodinámica, los eventos adversos en el OBC postoperatorio y reducen la mortalidad. Los inotrópicos más nuevos, como el levosimendán (un sensibilizador de calcio e inodilatador), son un inotrópico positivo que tiene algunas propiedades vasodilatadoras . También se puede considerar como un vasodilatador hepático selectivo, que puede mejorar el flujo venoso portal a través de la arteria hepática y el flujo venoso portal en comparación con la dobutamina que solo puede mejorar el flujo venoso portal sin vasodilatar la arteria hepática . El levosimendán tampoco aumenta la demanda miocárdica de oxígeno y se recomienda sobre la dobutamina en pacientes con LoHF con isquemia miocárdica aguda o después de cirugía cardíaca . Para la LoHF postoperatoria, el efecto protector de los inotrópicos frente a la tasa de mortalidad a corto plazo (mortalidad a 30 días) sigue siendo insignificante en comparación con el placebo .
La presente revisión sistemática y metanálisis tiene algunas limitaciones importantes. La LoHF puede ocurrir en enfermedades cardíacas secundarias a subyacentes, como infarto agudo de miocardio o postoperatorio. La mayoría de los estudios incluyeron LoHF posoperatoria investigada con menos presentación de LoHF de otras causas. La mayoría de los estudios se centraron en dos inotrópicos (levosimendán y dobutamina), lo que limitó la comprensión de otros inotrópicos, así como de otras terapias, como las terapias con dispositivos. En algunos ensayos, el análisis estuvo en riesgo de sesgo de clasificación errónea debido a la pérdida de un número significativo de pacientes en el seguimiento. Dado que la mayoría de los ensayos no notifican diferencias por pares antes y después de la intervención con la desviación estándar asociada, diferencias antes y después de la intervención con la desviación estándar, medidas de resultados antes y después de la intervención como independientes, se obtienen intervalos de confianza sider para el efecto del tratamiento con una desviación estándar asociada.
Conclusión
La insuficiencia cardíaca de bajo gasto (LoHF) es un síndrome clínico caracterizado por una disminución del gasto cardíaco acompañada de hipoperfusión de órganos terminales. Es una forma poco frecuente de insuficiencia cardíaca en la población general, pero prevalente en pacientes con IC postoperatoria. Su etiología es heterogénea, compuesta por diversas afecciones que causan estado de bajo rendimiento y cirugía cardíaca. Los principales mecanismos fisiopatológicos son la disfunción sistólica y / o diastólica del VI y la disfunción del VD causada por cambios en la frecuencia cardíaca, precarga, postcarga y/o contractilidad. Los factores de riesgo generales para la LoHF incluyen la enfermedad de Chagas, la fracción de eyección deprimida y la disfunción renal, mientras que en los pacientes postoperatorios incluyen deterioro de la función del VI, revascularización incompleta, edad avanzada y presencia de diabetes y disfunción renal. El diagnóstico carece de pautas estandarizadas y depende de la colección aceptada de aberraciones hemodinámicas y fisiológicas, incluidas las condiciones que causan un estado de bajo rendimiento. La historia clínica y el examen físico del paciente ayudan a evaluar el estado hemodinámico y a reconocer el estado de bajo gasto, mientras que la ecocardiografía confirma la disfunción ventricular (IC) y el bajo gasto cardíaco. Otras pruebas para apoyar el diagnóstico o establecer la causa del estado de bajo rendimiento incluyen electrocardiograma y pruebas de laboratorio básicas (sangre, electrolitos séricos, urea y creatinina, pruebas hepáticas, función tiroidea y péptidos natriuréticos séricos) e imágenes cardíacas (radiografía de tórax o angiografía coronaria). El tratamiento carece de directrices establecidas, pero depende de la evaluación de la fisiopatología individual para seleccionar la estrategia de tratamiento más adecuada. El tratamiento incluye estrategias de ventilación mecánica para mejorar la frecuencia y el ritmo cardíacos; ajuste del volumen para optimizar la precarga; apoyo farmacológico (inotrópicos y vasodilatadores) para manipular la postcarga y mejorar la contractilidad; y terapia con dispositivos (bomba de balón intraaórtico o dispositivo de asistencia ventricular) cuando estas estrategias no restablecen el gasto cardíaco. En pacientes seleccionados, las terapias para revertir la enfermedad subyacente pueden restaurar el gasto cardíaco.
- Inamdar A, Inamdar A (2016) Diagnóstico, manejo y utilización de la insuficiencia cardíaca. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) Desarrollos recientes en insuficiencia cardíaca. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 de la Sociedad Europea de Cardiología. Desarrollado en colaboración con la Asociación de Insuficiencia Cardíaca (HFA) de la ESC. Eur J Heart Fail 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, et al. (2013) 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation / American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) Guía ESC 2016 para el diagnóstico y tratamiento de la insuficiencia cardíaca aguda y crónica: El Grupo de Trabajo para el diagnóstico y tratamiento de la insuficiencia cardíaca aguda y crónica de la Sociedad Europea de Cardiología (ESC) Se desarrolló con la contribución especial de la Asociación de Insuficiencia Cardíaca (HFA) de la ESC. Eur Heart J 37: 2129-2200.
- Masse L, Antonacci M (2005) Síndrome de bajo gasto cardíaco: identificación y manejo. Crit Care Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) Insuficiencia cardíaca congestiva. Am J Respir Crit Care Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, et al. (2005) Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: The Task Force on Acute Heart Failure de la Sociedad Europea de Cardiología. Eur Heart J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) Cardiac performance and mortality early after intracardiac surgery in infants and young children. Circulation 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) Curso postoperatorio y perfil hemodinámico después de la operación de cambio arterial en neonatos y lactantes: una comparación de circulación extracorpórea de bajo flujo y parada circulatoria. Circulation 92: 2226-2235.
- Hogue CW Jr, Sundt T 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) Las complicaciones cardíacas y neurológicas identifican riesgos de mortalidad para hombres y mujeres sometidos a cirugía de injerto de derivación de arteria coronaria. Anaesthesiology 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) Predictors of low cardiac output syndrome after coronary artery bypass. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutiérrez F, García-Puente JJ, et al. (2010) Epidemiología y nuevos predictores de síndrome de bajo gasto cardiaco tras injerto de derivación de arteria coronaria aislado. Eur Heart J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, et al. (2012) Factores de riesgo para el síndrome de bajo gasto cardíaco después de la cirugía de revascularización coronaria. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Predictores de síndrome de bajo gasto cardiaco tras cirugía de derivación coronaria aislada: tendencias a lo largo de 20 años. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Manejo del síndrome de bajo gasto cardíaco después de una cirugía para una cardiopatía congénita. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) Síndrome de bajo gasto cardíaco después de una cirugía cardíaca. J Cardiothorac Vasc Anesth31: 291-308.
- Tibby SM., Murdoch IA (2003) Monitoring cardiac function in intensive care. Arch Dis Child 88: 46-52.
- Carcillo JA, Field AI (2002) Parámetros de práctica clínica para soporte hemodinámico de pacientes pediátricos y neonatales en shock séptico. Crit Care Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, et al. (2011) Muerte cardiomiocítica: mecanismos e implicaciones traslacionales. Muerte celular & enfermedad 2: e244.
- Tavernarakis N (2007) Necrosis cardiomiocítica: mecanismos alternativos, intervenciones eficaces. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research 1773: 480-482.
- Dorn GW (2008) Muerte cardiomiocitaria programada apoptótica y no apoptótica en el remodelado ventricular. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) The stunned and hibernating myocardium: a brief review. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) Insuficiencia cardíaca diastólica después de cirugía cardíaca. En Enfermedad Arterial Coronaria – Conceptos Actuales en Epidemiología, Fisiopatología, Diagnóstico y Tratamiento 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) ¿Qué mecanismos subyacen a la disfunción diastólica en la insuficiencia cardíaca? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) Insuficiencia cardíaca con fracción de eyección conservada: fisiopatología, diagnóstico y tratamiento. Eur Heart J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) ¿Es el Fosfolambano o Troponina I la «prima Donna» en la Lusitropía inducida por β-adrenérgicos? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) Efectos agudos del óxido nítrico en la relajación ventricular izquierda y la distensibilidad diastólica en humanos. Evaluación mediante infusión bicoronaria de nitroprusiato sódico. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prevalence of Left Ventricular Diastolic Filling Abnorrnalities in Adult Cardiac Surgical Patients: An Intraoperative Echo cardiographic Study. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) Patrones de llenado diastólico biventricular después de la cirugía de injerto de derivación de arteria coronaria. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Hipertensión arterial pulmonar: el papel clave de la ecocardiografía. Chest 127: 1836-1843.
- Zochios V, Jones N (2014) Síndrome agudo del corazón derecho en el paciente crítico. Vaso cardiopulmonar 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015) Experiencia clínica inicial con una sonda de ecocardiografía transesofágica miniaturizada en una unidad de cuidados intensivos cardíacos. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Performance of the right ventricle under stress: Relation to right coronary flow. J Clin Invest 50: 2176-2183.
- Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Disfunción vascular pulmonar y ventricular derecha en cuidados críticos en adultos: Opciones actuales y emergentes para el manejo: Una revisión sistemática de la literatura. Hematocrito 14: R169.
- Pfisterer M (2003) Compromiso ventricular derecho en infarto de miocardio y shock cardiogénico. Lancet 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Predictores de bajo gasto cardíaco en insuficiencia cardíaca grave descompensada. Clinics 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Resultado clínico del injerto de derivación de arteria coronaria urgente. J Korean Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Predictores de síndrome de bajo gasto cardíaco después de cirugía aislada de válvula aórtica. Circulación 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) Evaluation of nutritional screening tools for patients scheduled for cardiac surgery. Nutrition 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) Los valores preoperatorios de hemoglobina y péptido natriurético de tipo B, pero no los marcadores inflamatorios, se asocian con la morbilidad postoperatoria en cirugía cardíaca: Un estudio analítico de cohortes prospectivo. J Cardiothorac Surg 8: 170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011) Recuento total de linfocitos en sangre periférica preoperatoria como predictor de resultados precarios en cirugía cardíaca en adultos. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminal pro-B-type natriuretic peptide levels and early outcome after cardiac surgery: A prospective cohort study. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Utility of B-type natriuretic peptide in predicting postoperative complications and outcomes in patients undergoing heart surgery. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) Relationship between admission sérico sodium concentration and clinical outcomes in patients hospitalized for heart failure: an analysis from the OPTIMIZE-HF registry. Eur Heart J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) Mortalidad hospitalaria en pacientes con insuficiencia cardíaca aguda descompensada que requieren medicamentos vasoactivos intravenosos: un análisis del Registro Nacional de Insuficiencia Cardíaca Aguda Descompensada (ADHERE). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Team management of patients with heart failure: a statement for healthcare professionals del Consejo de Enfermería Cardiovascular de la American Heart Association. Circulation 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) The limited reliability of physical signs for estimating hemodynamics in chronic heart failure. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) La evaluación clínica identifica perfiles hemodinámicos que predicen resultados en pacientes ingresados con insuficiencia cardíaca. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Terapia médica del infarto agudo de miocardio mediante la aplicación de subconjuntos hemodinámicos. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E, Stevenson LW (2002) Medical management of advanced heart failure. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) Ecocardiografía en insuficiencia cardíaca: aplicaciones, utilidad y nuevos horizontes. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) Evaluación ecocardiográfica de la hemodinámica en pacientes con insuficiencia cardíaca sistólica descompensada. Circ Cardiovasc Imaging 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) Recommendations for cardiac chamber quantification by ecocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014)Criterios de adecuación para el uso de imágenes cardiovasculares en insuficiencia cardíaca: informe de revisión de la literatura. Eur Heart J Cardiovasc Imaging 16: 147-153.
- Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) Non-invasive cardiac imaging evaluation of patients with chronic sistolic heart failure: a report from the European Association of Cardiovascular Imaging (EACVI). Eur Heart J 35: 3417-3425.
- Vazir A, Cowie MR (2012) Evaluación de la insuficiencia cardíaca descompensada aguda: Estrategias y herramientas. Eur Cardiol 8: 128-133.
- Gray A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) Ventilación no invasiva en edema pulmonar cardiogénico agudo. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) Monitorización hemodinámica en insuficiencia cardíaca aguda. Crit Care Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) The intraaortic balloon pump in heart failure management: implications for nursing practice. Aust Crit Care 22: 125-131.
- Slaughter MS, Singh R (2012) El papel de los dispositivos de asistencia ventricular en la insuficiencia cardíaca avanzada. Revista Española de Cardiología 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) Hemodinamic profiles of advanced heart failure: association with clinical characteristics and long-term outcomes. Fallo de la tarjeta J 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) Superioridad de la dobutamina sobre la dopamina para el aumento del gasto cardíaco en pacientes con insuficiencia cardíaca crónica de bajo gasto. Circulation 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, et al. (2002) Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double-blind trial. The Lancet 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, et al. (2002) Estenosis aórtica de bajo rendimiento y bajo gradiente en pacientes con función sistólica ventricular izquierda deprimida: la utilidad clínica del desafío de dobutamina en el laboratorio de cateterismo. Circulation 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Effects of levosimendan versus dobutamine on inflammatory and apoptotic pathways in acutely decompensated chronic heart failure. Am J Cardiol 98: 102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, et al. (2007) Survive Investigators. Levosimendán vs dobutamina para pacientes con insuficiencia cardíaca aguda descompensada: el ensayo aleatorizado SURVIVE. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) El sensibilizador de calcio levosimendán da resultados superiores a la dobutamina en el síndrome de bajo gasto cardíaco postoperatorio. Revista Española de Cardiología (English edition) 61: 471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, et al. (2008) Sodium nitroprusside for advanced low-output heart failure. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, et al. (2012) Levosimendan versus an intra-aortic balloon pump in high-risk cardiac patients. J Cardiothorac Vasc Anesth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) A comparison of doubutamine and levosimendan n hepatic blood flow in patients with a low cardiac output state after cardiac surgery: a randomised controlled study. Anaesth Intensive Care 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Efecto de levosimendan en el síndrome de bajo gasto cardíaco en pacientes con baja fracción de eyección sometidos a cirugía de revascularización coronaria con circulación extracorpórea: la LICORNE ensayo clínico aleatorizado. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendán para soporte hemodinámico después de cirugía cardíaca. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendán en pacientes con disfunción ventricular izquierda sometidos a cirugía cardíaca. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) Estrategias de agentes inotrópicos y vasodilatadores para el tratamiento del shock cardiogénico o síndrome de bajo gasto cardíaco. La Biblioteca Cochrane. 2 : 1-10.