Entalpía y Reacciones Químicas
7.3 Entalpía y Reacciones Químicas
Objetivos de aprendizaje
- Definen entalpía.
- Expresar correctamente el cambio de entalpía de las reacciones químicas.
- Explicar cómo se miden experimentalmente los cambios de entalpía.
Ahora que hemos demostrado cómo la energía, el trabajo y el calor están relacionados, estamos listos para considerar los cambios de energía en las reacciones químicas. Un concepto fundamental es que cada reacción química ocurre con un cambio simultáneo de energía. Ahora necesitamos aprender a expresar adecuadamente estos cambios de energía.
Nuestro estudio de gases en el Capítulo 6 » Gases «y nuestra definición de trabajo en la Sección 7.2″ Trabajo y calor » indican que condiciones como la presión, el volumen y la temperatura afectan el contenido de energía de un sistema. Lo que necesitamos es una definición de energía que se mantenga cuando se especifican algunas de estas condiciones (algo similar a nuestra definición de temperatura y presión estándar en nuestro estudio de gases). Definimos el cambio de entalpía El calor de un proceso a presión constante; denotado ΔH. (ΔH) como el calor de un proceso cuando la presión se mantiene constante:
ΔH pressure presión constante qat
La letra H significa «entalpía», un tipo de energía, mientras que la Δ implica un cambio en la cantidad. Siempre estaremos interesados en el cambio en H, en lugar del valor absoluto de H en sí.
Cuando se produce una reacción química, hay un cambio característico en la entalpía. El cambio de entalpía para una reacción se escribe típicamente después de una ecuación química equilibrada y en la misma línea. Por ejemplo, cuando dos moles de hidrógeno reaccionan con un mol de oxígeno para hacer dos moles de agua, el cambio de entalpía característico es de 570 kJ. Escribimos la ecuación como
2H2 (g) + O2(g) → 2H2O (Δ) ΔH = -570 kJ
Una ecuación química que incluye un cambio de entalpía se denomina ecuación termoquímica Una ecuación química que incluye un cambio de entalpía.. Se supone que una ecuación termoquímica se refiere a la ecuación en cantidades molares, lo que significa que debe interpretarse en términos de moles, no de moléculas individuales.
Ejemplo 5
Escriba la ecuación termoquímica para la reacción de PCl3(g) con Cl2(g) para hacer PCl5 (g), que tiene un cambio de entalpía de -88 kJ.
Solución
La ecuación termoquímica es
PCl3(g) + Cl2(g) → PCl5(g) ΔH = -88 kJ
Prueba
Escribir la ecuación termoquímica de la reacción de N2(g) O2(g) para hacer 2NO(g), que tiene un cambio de entalpía de 181 kJ.
Respuesta
N2(g) + O2(g) → 2NO(g) ΔH = 181 kJ
Es posible que haya notado que el ΔH para una reacción química puede ser positivo o negativo. Se supone que el número es positivo si no tiene signo; se puede agregar un signo + explícitamente para evitar confusiones. Una reacción química que tiene un ΔH positivo se dice que es una reacción química endotérmica que tiene un cambio positivo en la entalpía., mientras que una reacción química que tiene un ΔH negativo se dice que es una reacción química exotérmica que tiene un cambio negativo en la entalpía..
¿Qué significa si el ΔH de un proceso es positivo? Significa que el sistema en el que se produce la reacción química está ganando energía. Si se considera que la energía de un sistema se representa como una altura en una gráfica de energía vertical, el cambio de entalpía que acompaña a la reacción se puede diagramar como en la parte (a) de la Figura 7.3 «Energía de reacción»: la energía de los reactivos tiene cierta energía, y el sistema aumenta su energía a medida que va a los productos. Los productos son más altos en la escala vertical que los reactivos. Endotérmico, entonces, implica que el sistema gana, o absorbe, energía.
Existe una situación opuesta para un proceso exotérmico, como se muestra en la parte (b) de la Figura 7.3 «Energía de reacción». Si el cambio de entalpía de una reacción es negativo, el sistema está perdiendo energía, por lo que los productos tienen menos energía que los reactivos, y los productos son más bajos en la escala de energía vertical que los reactivos. Exotérmico, entonces, implica que el sistema pierde, o emite, energía.
Figura 7.3 Energía de reacción
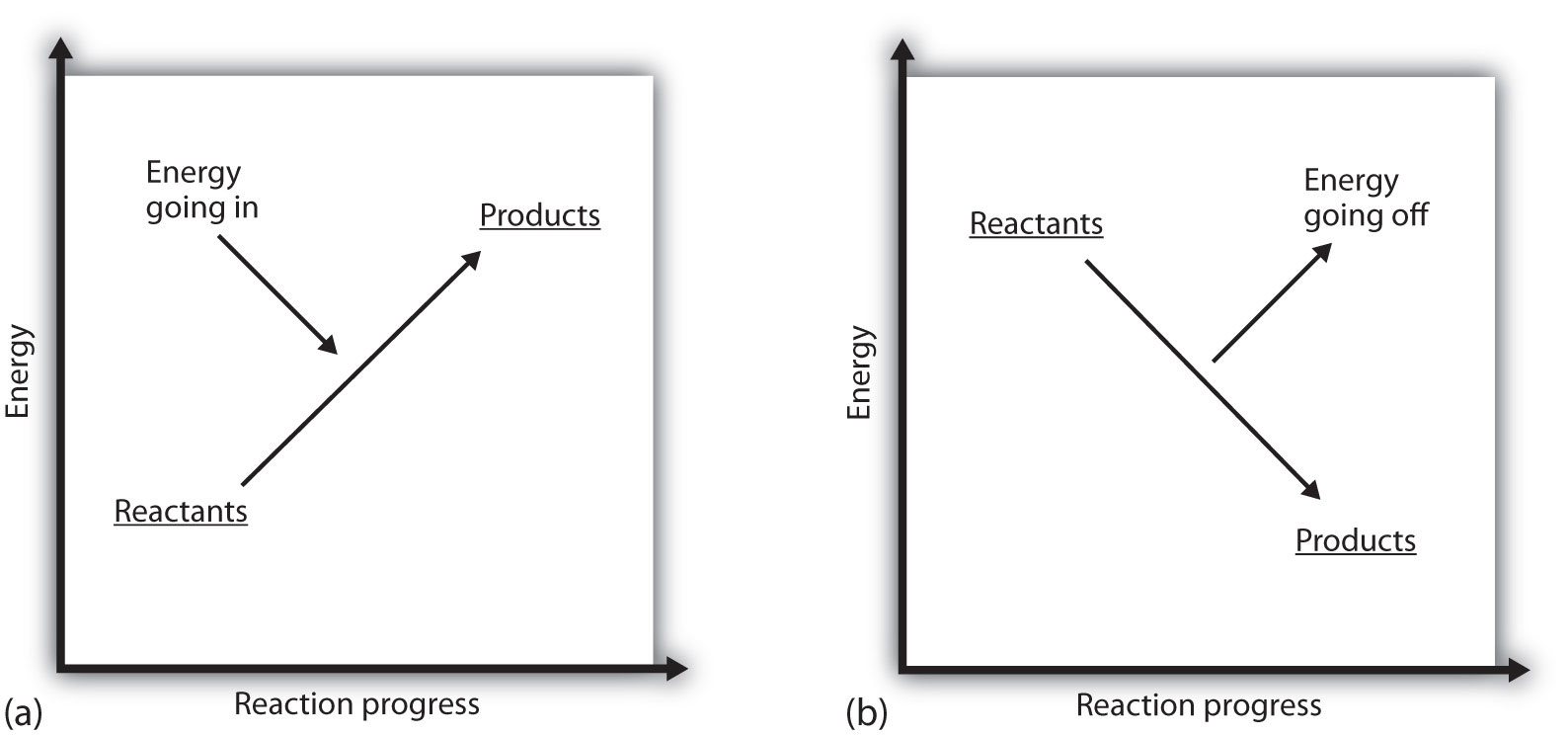
(a) En una reacción endotérmica, la energía del sistema aumenta (es decir, se mueve más alto en la escala vertical de energía). (b) En una reacción exotérmica, la energía del sistema disminuye (es decir, se mueve más bajo en la escala vertical de energía).
Ejemplo 6
Considere esta ecuación termoquímica.
2CO(g) + O2(g) → 2CO2 (g) ΔH = -565 kJ
¿Es exotérmico o endotérmico? ¿Cuánta energía se emite o absorbe?
Solución
Por definición, una reacción química que tiene un ΔH negativo es exotérmica, lo que significa que esta cantidad de energía, en este caso, 565 kJ, es emitida por la reacción.
Pruébese a sí mismo
Considere esta ecuación termoquímica.
CO2 (g) + H2(g) → CO(g) + H2O(g) ΔH = 42 kJ
¿Es exotérmico o endotérmico? ¿Cuánta energía se emite o absorbe?
Respuesta
Endotérmica; se absorben 42 kJ.
¿Cómo se miden experimentalmente los valores ΔH? En realidad, ΔH no se mide; q se mide. Pero las mediciones se realizan en condiciones de presión constante, por lo que ΔH es igual a la q medida.
Experimentalmente, q se mide aprovechando la ecuación
q = mcΔT
Medimos previamente la masa de los productos químicos en un sistema. Luego dejamos que ocurra la reacción química y medimos el cambio de temperatura (ΔT) del sistema. Si conocemos el calor específico de los materiales en el sistema (por lo general, lo sabemos), podemos calcular q. Ese valor de q es numéricamente igual al ΔH del proceso, que podemos escalar hasta una escala molar. El contenedor en el que reside el sistema suele estar aislado, por lo que cualquier cambio de energía se destina a cambiar la temperatura del sistema, en lugar de filtrarse del sistema. El recipiente se conoce como un recipiente calorimétrico utilizado para medir el calor de una reacción química., y el proceso de medición de cambios en la entalpía se llama calorimetría El proceso de medición de cambios en la entalpía para reacciones químicas..
Figura 7.4 Calorímetros
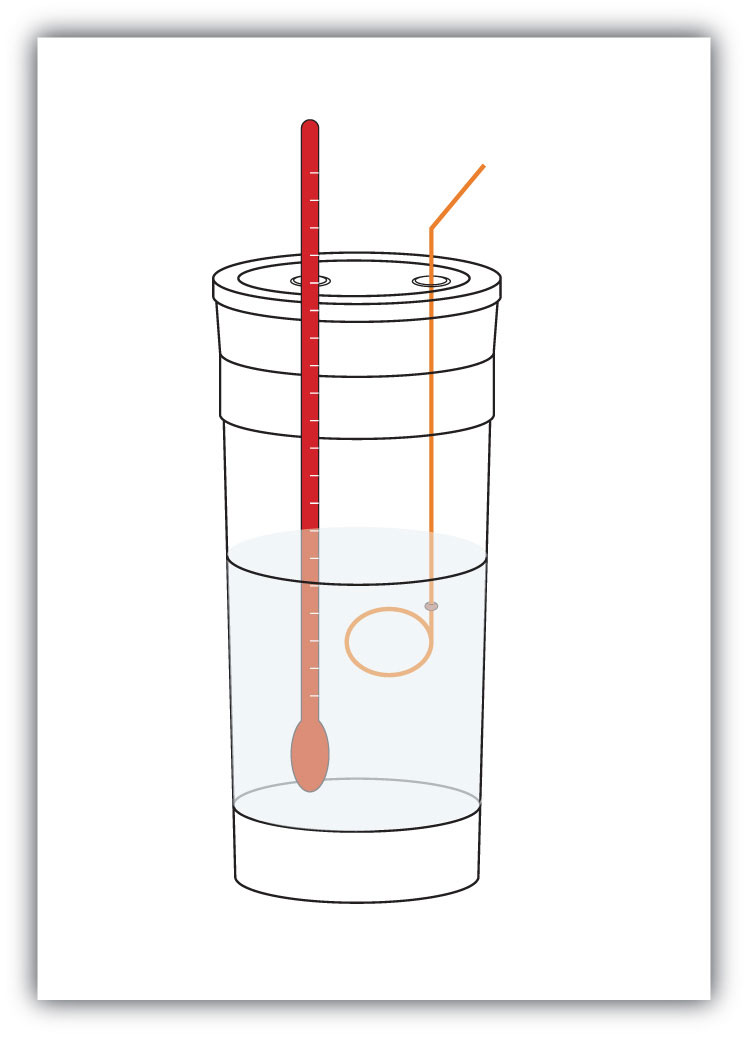
Se puede construir un calorímetro simple a partir de tazas de café de espuma anidadas, una cubierta, un termómetro y un agitador.
Por ejemplo, supongamos 4.0 g de NaOH, o 0,10 mol de NaOH, se disuelve para hacer 100.0 mL de solución acuosa, mientras que 3.65 g de HCl, o 0,10 mol de HCl, se disuelve a hacer otra 100.0 mL de solución acuosa. Las dos soluciones se mezclan en un calorímetro aislado, se inserta un termómetro y se cubre el calorímetro (consulte la Figura 7.4 «Calorímetros» para ver un ejemplo de configuración). El termómetro mide el cambio de temperatura a medida que se produce la siguiente reacción química:
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ)
Un observador observa que la temperatura aumenta de 22,4°C a 29,1°C. Suponiendo que las capacidades de calor y las densidades de las soluciones son las mismas que las del agua pura, ahora tenemos la información que necesitamos para determinar el cambio de entalpía de la reacción química. La cantidad total de solución es de 200,0 mL, y con una densidad de 1,00 g/ml, tenemos 200,0 g de solución. Usando la ecuación para q, sustituimos nuestras mediciones experimentales y el calor específico del agua(Tabla 7.1 «Calores específicos de Varias Sustancias»):
q=(200.0 g) (4.184 J g⋅°C) (6.7°C)
Resolviendo para q, obtenemos
q=5.600 J Δ ΔH para la reacción
El calor q es igual al ΔH para la reacción porque la reacción química ocurre a presión constante. Sin embargo, la reacción está emitiendo esta cantidad de energía, por lo que el signo real en ΔH es negativo:
ΔH = -5.600 J para la reacción
Por lo tanto, tenemos la siguiente ecuación termoquímica para la reacción química que se produjo en el calorímetro:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(aq)+110 H2O(Δ)ΔH=-5.600 J
Los coeficientes de 1/10 están presentes para recordarnos que comenzamos con una décima parte de mol de cada reactivo, así que hacemos una décima parte de un mol de cada producto. Por lo general, sin embargo, reportamos ecuaciones termoquímicas en términos de lunares, no una décima parte de un lunar. Para escalar hasta cantidades molares, debemos multiplicar los coeficientes por 10. Sin embargo, cuando hacemos esto, obtenemos 10 veces más energía. Por lo tanto, tenemos
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
El ΔH se puede convertir en unidades kJ, por lo que nuestra ecuación termoquímica final es
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Acabamos de tomar nuestros datos experimentales de la calorimetría y determinamos la cambio de entalpía de una reacción química. Mediciones similares en otras reacciones químicas pueden determinar los valores ΔH de cualquier reacción química que desee estudiar.
Ejemplo 7
Una solución de 100 mL de 0.se mezclaron 25 mol de Ca2+(aq) con 0,50 mol de iones F−(aq), y se precipitó CaF2:
Ca2+(aq) + 2F−(aq) → CaF2(s)
La temperatura de la solución aumentó en 10,5°C. ¿Cuál fue el cambio de entalpía para la reacción química? ¿Cuál fue el cambio de entalpía para la producción de 1 mol de CaF2? Supongamos que la solución tiene la misma densidad y calor específico que el agua.
Solución
Dado que se nos da ΔT directamente, podemos determinar el calor de la reacción, que es igual a ΔH:
q=(100 g)(4.184 J g⋅°C)(10.5 ° C)
Resolviendo para q, obtenemos
q = 4.400 J
Por lo tanto, ΔH = -4.400 J.
De acuerdo con la estequiometría de la reacción, se formará exactamente 0,25 mol de CaF2, por lo que esta cantidad de calor es de 0,25 mol. Para 1 mol de CaF2, necesitamos escalar el calor en un factor de cuatro:
q = 4,400 J × 4 = 17,600 J para 1 mol de CaF2
Sobre una base molar, el cambio en la entalpía es
ΔH = -17,600 J = -17.6 kJ
Pruébese a sí mismo
En un calorímetro a presión constante, 0.10 mol de CH4(g) y 0.20 mol de O2(g) reaccionan.
CH4 (g) + 2O2(g) → CO2(g) + 2H2O(ℓ)
La reacción calienta 750.0 g de H2O por 28,4°C. ¿Qué es ΔH para la reacción en una escala molar?
Respuesta
-891 kJ
Conclusiones clave
- Cada reacción química ocurre con un cambio simultáneo de energía.
- El cambio en la entalpía equivale a calor a presión constante.
- Los cambios de entalpía se pueden expresar mediante ecuaciones termoquímicas.
- Los cambios de entalpía se miden mediante calorimetría.
Ejercicios
-
Bajo qué circunstancias se q y ΔH la misma?
-
¿En qué circunstancias son diferentes q y ΔH?
-
El gas hidrógeno y el gas cloro reaccionan para producir cloruro de hidrógeno con un cambio de entalpía de -184 kJ. Escriba una ecuación termoquímica adecuadamente equilibrada para este proceso.
-
El propano (C3H8) reacciona con el gas de oxígeno elemental para producir dióxido de carbono y agua líquida con un cambio de entalpía de -2,220 kJ. Escriba una ecuación termoquímica adecuadamente equilibrada para este proceso.
-
El gas nitrógeno reacciona con el gas oxígeno para producir NO (g) mientras absorbe 180 kJ. Escriba una ecuación termoquímica adecuadamente equilibrada para este proceso.
-
El sodio sólido reacciona con el gas de cloro para producir cloruro de sodio sólido mientras emite 772 kJ. Escriba una ecuación termoquímica adecuadamente equilibrada para este proceso.
-
El gas hidrógeno y el gas cloro reaccionan para producir cloruro de hidrógeno con un cambio de entalpía de -184 kJ. ¿Este proceso es endotérmico o exotérmico?
-
El propano (C3H8) reacciona con el gas de oxígeno elemental para producir dióxido de carbono mientras emite 2.220 kJ de energía. ¿Este proceso es endotérmico o exotérmico?
-
El gas nitrógeno reacciona con el gas oxígeno para producir NO (g) mientras absorbe 180 kJ. ¿Es este proceso exotérmico o endotérmico?
-
El metal de sodio puede reaccionar con nitrógeno para producir azida de sodio (NaN3) con un ΔH de 21,72 kJ. ¿Es este proceso exotérmico o endotérmico?
-
Dibujar un diagrama de nivel de energía para la reacción química en el Ejercicio 8. (Véase la Figura 7.3 «Energía de reacción» para un ejemplo.)
-
Dibujar un diagrama de nivel de energía para la reacción química en el Ejercicio 9. (Véase la Figura 7.3 «Energía de reacción» para un ejemplo.)
-
En una solución de 250 ml, se combinan 0,25 mol de KOH(aq) y 0,25 mol de HNO3(aq). La temperatura de la solución aumenta de 22,5°C a 35,9°C. Suponga que la solución tiene la misma densidad y capacidad calorífica del agua. ¿Cuál es el calor de la reacción, y cuál es el ΔH de la reacción sobre una base molar?
-
En una solución de 600 mL, 0.se combinan 50 mol de Ca(OH)2(aq) y 0,50 mol de H2SO4(aq). La temperatura de la solución aumenta en 22,3°C. ¿Cuál es el calor de la reacción y cuál es el ΔH de la reacción en base molar? Supongamos que la solución tiene la misma densidad y capacidad calorífica del agua.
-
Para calentar 400,0 g de H2O, se quema 0,050 mol de etanol (C2H5OH). El agua se calienta de 24,6 ° C a 65,6°C. ¿Cuál es el calor de la reacción y cuál es el ΔH de la reacción en base molar?
-
Para calentar 100.0 g de H2O, 0.066 mol de cera se quema. El agua se calienta de 21,4 ° C a 25,5°C. ¿Cuál es el calor de la reacción y cuál es el ΔH de la reacción en base molar?
Respuestas
-
bajo condiciones de presión constante
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exotérmica
-
endotérmica
-
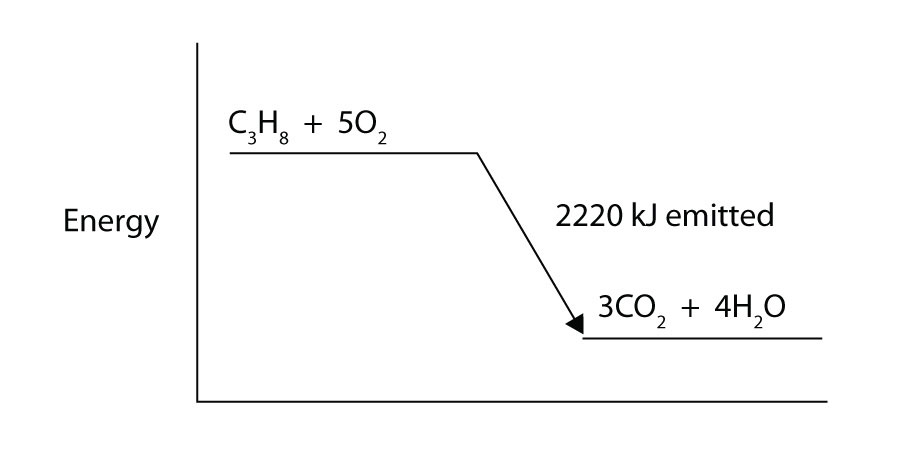
-
el calor de reacción = -14.0 kJ; ΔH = -56.0 kJ/mol de reactivos
-
el calor de reacción = -68.6 kJ; ΔH = -1,370 kJ/mol de etanol